
- •Упругие волны. Волновой процесс.
- •Уравнение плоской бегущей волны
- •Связь групповой и фазовой скорости
- •Звуковые волны (акустические волны)
- •Интенсивность звука (сила звука)
- •Эффект Доплера
- •Электромагнитные волны
- •3). Если
- •Дифракция света Принцип Гюйгенса — Френеля
- •Метод зон Френеля (1)
- •Дифракция Френеля на круглом отверстии и диске
- •Дифракция Фраунгофера на щели (дифракция в параллельных лучах)
- •Дифракция Фраунгофера на дифракционной решетке
- •Число максимумов, даваемое дифракционной решеткой
- •Дифракция на пространственной решетке Пространственная (трехмерная) решетка
- •Ф ормула Вульфа—Брэггов
- •Критерий Рэлея. Разрешающая способность спектрального прибора
- •Разрешающая способность спектрального прибора
- •Разрешающая способность дифракционной решетки
- •Поляризация света Естественный и поляризованный свет
- •Закон Малюса. Прохождение света через два поляризатора Степень поляризации света
- •Д войное лучепреломление
- •Пластинка в четверть волны (пластинка λ/4)
- •Анализ поляризованного света
- •Искусственная оптическая анизотропия
- •Закон Брюстера
- •Применение поляризованного света
- •Тепловое излучение и его характеристики
- •Характеристики теплового излучения
- •Закон Стефана – Больцмана
- •Вольт – амперная характеристика фотоэффекта.
- •Законы Столетова.
- •Применение фотоэффекта
- •Постулаты Бора.
- •Опыты Франка и Герца.
- •Элементы квантовой механики
- •Соотношения неопределенностей.
- •Описание микрочастиц с помощью волновой функции.
- •Общее уравнение Шредингера
- •Какое уравнение должно описывать движение микрочастиц?
- •Движение свободной частицы
- •Частица в одномерной прямоугольной «потенциальной яме» с бесконечно высокими «стенками»
- •Уравнения Шредингера для стационарных состояний
- •Линейный гармонический осциллятор в квантовой механике
- •Квантовые числа
- •Спин электрона. Спиновое квантовое число Опыты Штерна и Герлаха
- •Спин электрона
- •Принцип неразличимости тождественных частиц. Фермионы и бозоны
- •Принцип Паули. Распределение электронов в атоме по состояниям
- •Сплошной (тормозной) рентгеновский спектр
- •Характеристический рентгеновский спектр. Закон Мозли
- •Молекулы: химические связи, понятие об энергетических уровнях
- •Молекулярные спектры
- •Понятие о квантовой статистике. Бозе-Эйнштейна и Ферми-Дирака.
- •Элементы квантовой теории металлов.
- •Основные положения квантовой теории металлов.
- •Квантование энергии свободных электронов в металлах.
- •Функция распределения Ферми и её статистический смысл.
- •Металлы, диэлектрики, полупроводники.
- •Полупроводниковые диоды
Постулаты Бора.
Идея Бора связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель Резерфорда и квантовый характер излучения и поглощения света. Нильс Бор в основу своей теории положил два постулата:
Первый постулат Бора:
В атоме существуют стационарные (не изменяющиеся со временем) состояния, характеризующиеся определенными дискретными значениями энергии, в которых он не излучает энергию.
Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию
![]() (n=1,2,3,…),
(n=1,2,3,…),
где
![]() -
масса электрона,
-
масса электрона,
![]() -
его скорость по n-ой
орбите радиуса
-
его скорость по n-ой
орбите радиуса
![]() ,
,
![]() .
.
Второй постулат Бора.
При переходе электрона с одной орбиты на другую излучается (поглощается) один фотон с энергией
![]() =En-Em,
=En-Em,
равной разности энергий соответствующих стационарных состояний (Еn и Еm – соответственно энергии стационарных состояний атома до и после излучения (поглощения)).
При
![]() происходит излучение фотона ( переход
атома из состояния с большей энергией,
т. е. переход электрона с более удаленной
от ядра орбиты на более близлежащую),при
происходит излучение фотона ( переход
атома из состояния с большей энергией,
т. е. переход электрона с более удаленной
от ядра орбиты на более близлежащую),при
![]() – поглощение фотона (переход атома в
состояние с большей энергией, т. е.
переход электрона на более удаленную
от ядра орбиту).
– поглощение фотона (переход атома в
состояние с большей энергией, т. е.
переход электрона на более удаленную
от ядра орбиту).
Набор возможных дискретных частот
![]()
Квантовых переходов определяет линейчатый спектр атома.
Опыты Франка и Герца.
Цель опытов: доказательство существования в атомах стационарных состояний, т.е. экспериментальное подтверждение постулатов Бора.
Э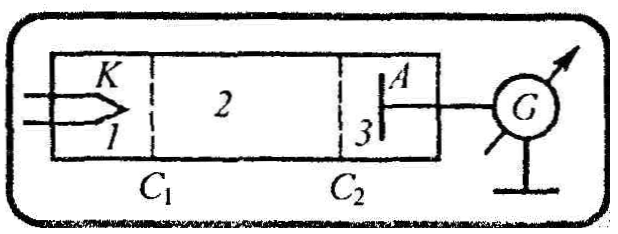 кспериментальная
установка
кспериментальная
установка
Э лектроны,
ускоренные в области 1, попадают в область
2 между сетками, где испытывают соударения
с атомами паров ртути. Электроны, которые
после соударения имеют достаточную
энергию для преодоления задерживающего
потенциала в области 3, достигают анода.
лектроны,
ускоренные в области 1, попадают в область
2 между сетками, где испытывают соударения
с атомами паров ртути. Электроны, которые
после соударения имеют достаточную
энергию для преодоления задерживающего
потенциала в области 3, достигают анода.
Опытные данные.
Ближайшим к основному, невозбужденному, состоянию атома ртути является возбужденное состояние, отстоящее от основного по шкале энергий на 4,86 эВ. Пока разность потенциалов между катодом и сеткой меньше 4,86 В, электроны, встречая на своем пути атомы ртути, испытывают с ними только упругие соударения.
При
![]() =4,86
эВ энергия электрона становится
достаточной, чтобы вызвать неупругий
удар, при котором электрон отдает атому
ртути всю кинетическую энергию, возбуждая
переход одного из электронов атома из
нормального энергетического состояния
на возбужденный энергетический уровень.
Этим и объясняется первое резкое падение
тока (см. рисунок).
=4,86
эВ энергия электрона становится
достаточной, чтобы вызвать неупругий
удар, при котором электрон отдает атому
ртути всю кинетическую энергию, возбуждая
переход одного из электронов атома из
нормального энергетического состояния
на возбужденный энергетический уровень.
Этим и объясняется первое резкое падение
тока (см. рисунок).
Итак, 4,86 эВ – наименьший квант энергии, поглощаемый атомом ртути в основном состоянии. Таким образом, в атоме действительно существуют стационарные состояния (подтверждение первого постулата Бора).
Атомы ртути,
получившие при соударении с электронами
энергию
![]() Е,
оказавшись в возбужденном состоянии,
должны вернуться в основное, излучая,
согласно второму постулату Бора, световой
квант с частотой
Е,
оказавшись в возбужденном состоянии,
должны вернуться в основное, излучая,
согласно второму постулату Бора, световой
квант с частотой
![]() (
=255
нм). Опыт действительно обнаруживает
подобную линию (подтверждение второго
постулата Бора).
(
=255
нм). Опыт действительно обнаруживает
подобную линию (подтверждение второго
постулата Бора).
Спектр атома водорода по Бору.
Постулаты,
выдвинутые Бором, позволили рассчитать
спектр атома водорода и водородоподобных
систем. Систем, состоящих из ядра с
зарядом Ze
и одного электрона (![]() ).
).
Получено выражение
для радиуса стационарной орбиты
![]() ,
,
для атома водорода Z=1 при n=1 радиус первой орбиты электрона
![]() = a
=
= 0,528
= a
=
= 0,528![]() м.
м.
Проверить эти
теоретические расчеты возможно с помощью
измерения излучаемой и поглощаемой
энергии, получаем
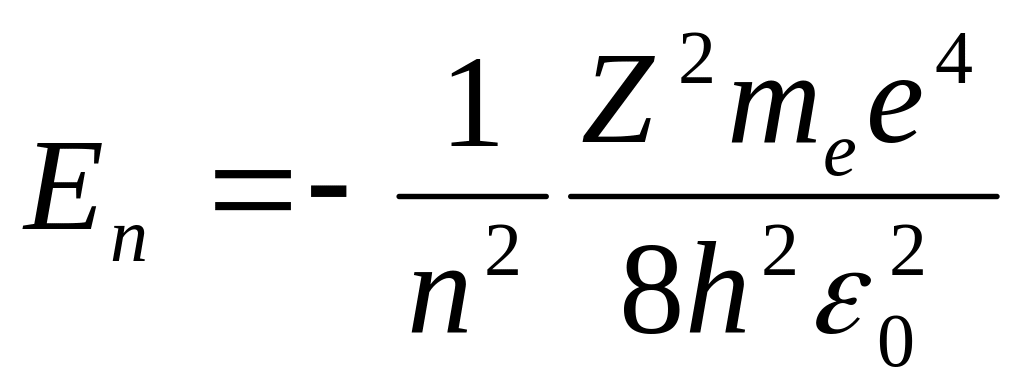 ,
,
где знак “ - “ показывает, что электрон находится в связанном состоянии.
Согласно второму
постулату Бора при переходе атома
водорода (Z=1)
из стационарного состояния n
с большей энергией в стационарное
состояние с меньшей энергией испускается
квант
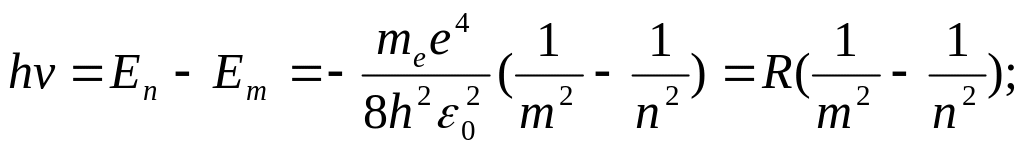
![]()
эта величина в точности совпадает с величиной постоянной Ридберга, определяемой экспериментально в эмпирической формуле для атома водорода в формуле Бальмера
Бальмер разобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра
![]() n=3,4,5...
n=3,4,5...
![]() -постоянная Ридберга
-постоянная Ридберга
Так как
![]() ,
то
,
то
![]() ,
где
,
где
![]()
Отсюда следует, что спектральные линии, отличающиеся значениями n, образуют группу или серию линий называемую серией Бальмера (в видимой области спектра)
Далее в спектре атома водорода было обнаружено несколько серий
В ультрафиолетовой области спектра
Серия Лаймана
![]() (n=2,3,4,…)
(n=2,3,4,…)
В видимой области спектра
Серия Бальмера (n=3,4,5,…)
В инфракрасной области спектра
Серия Пашена
![]() (n=4,5,6,…)
(n=4,5,6,…)
Серия Брэкета
![]() (n=5,6,7,…)
(n=5,6,7,…)
Серия Пфунда
![]() (n=6,7,8,…)
(n=6,7,8,…)
Серия Хэмфри
![]() (n=7,8,9,…)
(n=7,8,9,…)
Эти формулы подобраны эмпирически, подтверждены экспериментально, но не имели теоретического обоснования. Вид формул повторяемость в них целых чисел, универсальность постоянной Ридберга наводит на мысль о глубоком физическом смысле этих закономерностей, не объяснимых в рамках классической физики.
