
- •Міністерство освіти I науки україни українська інженерно-педагогічна академія
- •Програма
- •Уведення
- •I. Будова речовини
- •1. Будова атомів і систематика хімічних елементів
- •2. Хімічний зв’язок
- •3. Типи взаємодії молекул. Конденсований стан речовини
- •II. Загальні закономірності протікання хімічних процесів
- •1.Енергетика хімічних процесів і хімічна спорідненість
- •2. Хімічна кінетика і рівновага в гомогенних системах
- •3. Тверді розчини
- •4. Гетерогенні дисперсні системи
- •5. Електрохімічні процеси
- •6. Корозія і захист металів
- •Контрольні завдання
- •Основні поняття хімії
- •Контрольні питання
- •Будова атома
- •Періодична система елементів д. І. Менделєєва
- •Контрольні питання.
- •Хімічний зв’язок і будова молекул. Конденсований стан речовини.
- •Контрольні питання
- •Енергетика хімічних процесів (термохімічні розрахунки)
- •Стандартні теплоти (ентальпії) утворення деяких речовин
- •Контрольні питання
- •Хімічна спорідненість
- •Стандартна енергія Гіббса утворення деяких речовин
- •Стандартні абсолютні ентропії деяких речовин
- •Контрольні питання
- •Хімічна кінетика і рівновага
- •Контрольні питання
- •Способи виразу концентрації розчину
- •Контрольні питання
- •Властивості розчинів
- •Контрольні питання
- •Іонно-молекулярні (іонні) реакції обміну
- •Константи і ступені дисоціації деяких слабких електролітів
- •Розчинність солей і основ у воді
- •Контрольні питання
- •Гідроліз солей
- •Контрольні питання
- •Окислювально-відновні реакції
- •Контрольні питання
- •Електродні потенціали й електрорушійні сили
- •Стандартні електродні потенціали (e0) деяких металів, b.
- •Контрольні питання
- •Електроліз
- •Контрольні питання
- •Корозія металів
- •Контрольні питання
- •Комплексні сполуки
- •Контрольні питання
- •Контрольні питання
- •Твердість води і методи її усунення
- •Контрольні питання
- •Контрольні питання
- •Контрольні питання
Будова атома
Приклад 1. Що таке квантові числа? Які значення вони можуть приймати?
Рішення. Рух електрона в атомі носить імовірний характер. Біляядерний простір, у якому з найбільшою імовірністю (90–95%) може знаходитися електрон, називається атомною орбіталлю (АО). Атомна орбіталь, як будь–яка геометрична фігура, характеризується трьома параметрами (координатами), що одержали назву квантових чисел (n, l, ml) . Квантові числа приймають не будь-які, а визначені, дискретні значення. Сусідні значення квантових чисел відрізняються на одиницю.
Квантові числа визначають розмір (n), форму(l) і орієнтацію (ml) атомної орбіталі в просторі. Займаючи ту, або іншу атомну орбіталь, електрон утворює електронну хмару, яка у електронів того самого атома може мати різну форму. Форми електронних хмар аналогічні АО. Їх також називають електронними або атомними орбіталями. Електронна хмара характеризується чотирма квантовими числами(n, l, ml і ms). Ці квантові числа зв’язані з фізичними властивостями електрона, число n (головне квантове число) характеризує енергетичний (квантовий) рівень електрона, число l (орбітальне) – момент кількості руху (енергетичний підрівень), число ml (магнітне) – магнітний момент, ms – спін. Спін електрона виникає за рахунок обертання його навколо власної осі. Електрони в атомі повинні відрізнятися хоча б одним квантовим числом (принцип Паули), тому на АО можуть знаходитися не більш двох електронів, що відрізняються своїми спінами (ms = ± 1/2).
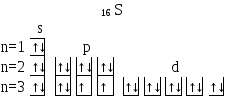
Приклад 2. Складіть електронні формули атомів елементів з порядковими номерами 16 і 22. Покажіть розподіл електронів цих атомів по квантовим (енергетичним) коміркам.
Рішення. Електронні формули відображають розподіл електронів в атомі по енергетичним рівням, підрівням (атомним орбіталям). Електронна конфігурація позначається групами символів nlx де n – головне квантове число, l – орбітальне квантове число (замість нього указують відповідне літерне позначення – s, p, d, f), x – число електронів на даному підрівні (орбіталі). При цьому варто враховувати, що електрон займає той енергетичний підрівень, на якому він має найменшу енергію – менша сума n + l (правило Клечковского). Послідовність заповнення енергетичних рівнів і підрівнів наступна:
1s → 2s → 2р → 3s → 3р → 4s→3d →4р →5s → 4d → 5р → 6s→ (5d1) →4f→ 5d →6p→7s→ (6d1–2)→5f→6d→7p
Число електронів в атомі того або іншого елемента дорівнює його порядковому номеру в таблиці Д.И.Менделєєва, тобто для елементів № 16 (сірка) і № 22 (титан) електронні формули мають вигляд:
16 S 1s22s22p63s23p4
22 Ti 1s22s22p63s23p63d24s2
Електронна структура атома може бути зображена також у виді схем розміщення електронів у квантових (енергетичних) комірках, що є схематичним зображенням атомних орбіталей. Квантову комірку позначають у виді прямокутника, кола або лінійки, а електрони в цих комірках позначають стрільцями. У кожній квантовій комірці може бути не більш двох електронів із протилежними спінами (розходження в спінах позначають різним напрямком стрілок).
Орбіталі даного підрівня заповнюються спочатку по одному електрону з однаковими спінами, а потім по другому електрону з протилежними спінами (правило Хунда):
22
Ti
s
n=1 ↑↓
p
n=2 ↑↓
↑↓
↑↓
↑↓
d
n=3 ↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
f
n=4
↑↓
↑↓
↑
↑
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
Контрольні питання.
21. Напишіть електронні формули атомів елементів з порядковими номерами 9 і 28. Покажіть розподіл електронів цих атомів по квантових комірках. До якого електронного сімейства відноситься кожний з цих елементів?
22. Напишіть електронні формули атомів елементів з порядковими номерами 16 і 26. Розподілите електрони цих атомів по квантових комірках. До якого електронного сімейства відноситься кожний з цих елементів?
23. Яке максимальне число електронів може знаходитись на s-, p-, d- і f- орбіталях даного енергетичного рівня? Чому? Напишіть електронну формулу атома елемента з порядковим номером 31.
24. Напишіть електронні формули атомів елементів з порядковими номерами 25 і 34. До якого електронного сімейства відноситься кожний з цих елементів?
25. Які орбіталі атома заповнюються електронами раніш: 4s або 3d ; 5s або 4p? Чому? Напишіть електронну формулу атома елемента з порядковим номером 21.
26.Напишіть електронні формули іонів Zn2+, Cl¯ і Al 3+ . До якого електронного сімейства відноситься кожний з цих елементів?
27.Які орбіталі атома заповнюються електронами раніш: 4d або 5s; 6s або 5p? Чому? Напишіть електронну формулу атома елемента з порядковим номером 43.
28. Що таке ізотопи? Чим можна пояснити, що в більшості елементів періодичної системи атомні маси виражаються дробовим числом? Чи можуть атоми різних елементів мати однакову масу? Як називаються подібні атоми?
29. Чому дорівнює кількість підрівнів у рівні? По якій формулі можна визначити максимальне число електронів на підрівні? Обчислить максимальне число електронів на 3d- і 4p- підрівнях.
30. Напишіть електронні формули атомів елементів з порядковими номерами 14 і 40. Скільки вільних d-орбіталей у атома останнього елемента?
31. У чому сутність правила Хунда? Розмістить шість електронів по атомних орбіталях 3d- підрівня. Чому дорівнює їх сумарне спінове число?
32. Напишіть електронні формули атомів елементів з порядковими номерами 15 і 28. Чому дорівнює максимальний спін p-електронів в атомів першого і d-електронів в атомів другого елемента?
33. Напишіть електронні формули атомів елементів з порядковими номерами 21 і 23. Скільки вільних d-орбіталей в атомах цих елементів?
34. Скільки і які значення може приймати магнітне квантове число ml при орбітальному числі l = 0; 1; 2 і 3? Які елементи в періодичній системі називають s-, p-, d- і f - елементами? Наведіть приклади.
35. Які значення можуть приймати квантові числа n, l, ml і ms, що характеризують стан електронів в атомі? Які значення вони приймають для зовнішніх електронів атома магнію?
36. Які з електронних формул, що відображують будову незбудженого атома деякого елемента невірні: а) 1s2 2s2 2p5 3s1; б) 1s2 2s2 2p6; в) 1s2 2s2 2p6 3s2 3p6 3d4; г) 1s2 2s2 2p6 3s2 3p6 4s2; д) 1s2 2s2 2p6 3s2 3d2? Чому? Атомам яких елементів відповідають правильно складені електронні формули?
37. Напишіть електронні формули атомів елементів з порядковими номерами 24 і 33, з огляду на те, що в першого відбувається „провал” одного з 4s-електронів на 3d-підрівень. Чому дорівнює максимальний спін d-електронів в атомі першого і p-електронів в атомі другого елемента?
38. Квантові числа для електронів зовнішнього енергетичного рівня атомів деякого елемента мають наступні значення: n = 4; l = 0; ml = 0; ms = 1/2. Напишіть електронну формулу атома цього елемента і визначте, скільки вільних 3d-орбиталей він містить.
39. У чому полягає принцип Паули? Чи може бути на якому-небудь підрівні атома p7, або d12 електронів? Чому? Складіть електронну формулу атома елемента з порядковим номером 22 і вкажіть його валентні електрони.
40. Складіть електронні формули атомів елементів з порядковими номерами 32 і 42, з огляду на те, що в останнього відбувається „провал” одного з 5s-електронів на 4d-підрівень. До якого електронного сімейства належить кожний з цих елементів?
