
- •Міністерство освіти I науки україни українська інженерно-педагогічна академія
- •Програма
- •Уведення
- •I. Будова речовини
- •1. Будова атомів і систематика хімічних елементів
- •2. Хімічний зв’язок
- •3. Типи взаємодії молекул. Конденсований стан речовини
- •II. Загальні закономірності протікання хімічних процесів
- •1.Енергетика хімічних процесів і хімічна спорідненість
- •2. Хімічна кінетика і рівновага в гомогенних системах
- •3. Тверді розчини
- •4. Гетерогенні дисперсні системи
- •5. Електрохімічні процеси
- •6. Корозія і захист металів
- •Контрольні завдання
- •Основні поняття хімії
- •Контрольні питання
- •Будова атома
- •Періодична система елементів д. І. Менделєєва
- •Контрольні питання.
- •Хімічний зв’язок і будова молекул. Конденсований стан речовини.
- •Контрольні питання
- •Енергетика хімічних процесів (термохімічні розрахунки)
- •Стандартні теплоти (ентальпії) утворення деяких речовин
- •Контрольні питання
- •Хімічна спорідненість
- •Стандартна енергія Гіббса утворення деяких речовин
- •Стандартні абсолютні ентропії деяких речовин
- •Контрольні питання
- •Хімічна кінетика і рівновага
- •Контрольні питання
- •Способи виразу концентрації розчину
- •Контрольні питання
- •Властивості розчинів
- •Контрольні питання
- •Іонно-молекулярні (іонні) реакції обміну
- •Константи і ступені дисоціації деяких слабких електролітів
- •Розчинність солей і основ у воді
- •Контрольні питання
- •Гідроліз солей
- •Контрольні питання
- •Окислювально-відновні реакції
- •Контрольні питання
- •Електродні потенціали й електрорушійні сили
- •Стандартні електродні потенціали (e0) деяких металів, b.
- •Контрольні питання
- •Електроліз
- •Контрольні питання
- •Корозія металів
- •Контрольні питання
- •Комплексні сполуки
- •Контрольні питання
- •Контрольні питання
- •Твердість води і методи її усунення
- •Контрольні питання
- •Контрольні питання
- •Контрольні питання
Окислювально-відновні реакції
Окислювально-відновними називаються реакції, що супроводжуються зміною ступеня окислювання атомів, що входять до складу реагуючих речовин. Під ступенем окислювання (п) розуміють той умовний заряд атома, що обчислюється виходячи з припущення, що молекула складається тільки з іонів. Іншими словами: ступінь окислювання – це той умовний заряд, що придбав би атом елемента, якщо припустити, що він прийняв або віддав те або інше число електронів.
Окислювання-відновлення це єдиний, взаємозалежний процес. Окислювання приводить до підвищення ступеня окислювання відновника, а відновлення – до її зниження в окислювача.
Підвищення або зниження ступеня окислювання атомів відображається в електронних рівняннях; окислювач приймає електрони, а відновник їх віддає. При цьому не має значення, чи переходять електрони від одного атома до іншого цілком і утворюються іонні зв’язки або електрони тільки відтягаються до більш електронегативного атома і виникає полярний зв’язок. Про здатності тієї або іншої речовини виявляти окислювальні, відновні або двоїсті (як окислювальні, так і відновні) властивості можна судити по ступеню окислювання атомів окислювача і відновника.
Атом того або іншого елемента у своєму вищому ступені окислювання не може його підвищити (віддати електрони) і виявляє тільки окислювальні властивості, а у своєму нижчому ступені окислювання не може його понизити (прийняти електрони) і виявляє тільки відновні властивості. Атом же елемента, що має проміжний ступінь окислювання, може виявляти як окислювальні, так і відновні властивості.
Наприклад:
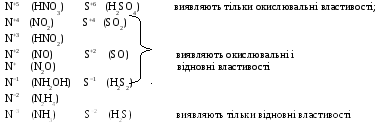
При окислювально-відновних реакціях валентність атомів може і не змінюватися. Наприклад, в окислювально-відновній реакції H20 + Cl20 = 2НС1 валентність атомів водню і хлору до і після реакції дорівнює одиниці. Змінився їхній ступінь окислювання. Валентність визначає число зв’язків, утворених даним атомом, і тому знака не має. Ступінь же окислювання має знак плюс або мінус.
Приклад 1. Виходячи зі ступеня окислювання (n) азоту, сірки і марганцю в сполуках NH3, HNO2, НNО3, H2S, Н2SО3, Н2SО4, МnО2, KMnO4, визначте, які з них можуть бути тільки відновниками, тільки окислювачами і які виявляють як окислювальні, так і відновні властивості.
Рішення. Ступінь окислювання n(N) у зазначених сполуках відповідно дорівнює: –3 (нижча), +3 (проміжна), +5 (вища); n(S) відповідно дорівнює: –2 (нижча), +4 (проміжна), +6 (вища); n(Мn) відповідно дорівнює: +4 (проміжна), +7 (вища). Звідси: NH3, H2S – тільки відновники; НNО3, Н2SО4, KMnO4 – тільки окислювачі; HNO2, Н2SО3, МnО2 – окислювачі і відновники.
Приклад 2. Чи можуть відбуватися окислювально-відновні реакції між наступними речовинами: а) H2S і HI; б) H2S і H2SO3 ; в) H2SO3 і HClО4 ?
Рішення, а) Ступінь окислювання в H2S n(S) = –2; у HI n (I) = –1. Оскільки і сірка, і иод знаходяться у своєму нижчому ступені окислювання, то обидві узяті речовини виявляють тільки відновні властивості і взаємодіяти один з одним не можуть; б) у H2S n(S) = –2 (нижча); у H2SO3 n(S) = +4 (проміжна). Отже, взаємодія цих речовин можлива, причому H2SO3 є окислювачем; в) у H2SO3 n(S) = +4 (проміжна); у HClО4 n(CI) = +7 (вища). Узяті речовини можуть взаємодіяти H2SO3 у цьому випадку буде виявляти відновні властивості.
Приклад 3. Складіть рівняння окислювально-відновної реакції, що йде за схемою:
KMn+7O4 + Н3Р+3О3 + H2SO4 → Mn+2SO4 + Н3Р+5O4 + K2SO4 + Н2О
Рішення.
Якщо в умові задачі задані як вихідні
речовини, так і продукти їхньої взаємодії,
то написання рівняння реакції зводиться,
як правило, до визначення і розміщення
коефіцієнтів. Коефіцієнти визначають
методом електронного
балансу
за допомогою електронних
рівнянь.
Обчислюємо, як змінюють свій ступінь
окислювання відновник і окислювач, і
відображаємо це в електронних рівняннях:
![]()
З агальне
число електронів, відданих відновником,
повинне дорівнювати числу електронів,
що приєднує окислювач. Загальне найменше
кратне для відданих і прийнятих
електронів десять. Розділивши це число
на 5, одержуємо коефіцієнт 2 для окислювача
і продукту його відновлення, а при
діленні
10
на
2
одержуємо коефіцієнт
5
для відновника і продукту його
окислювання. Коефіцієнти перед
речовинами, атоми яких не змінюють свій
ступінь окислювання, знаходять підбором.
Рівняння реакції буде мати вигляд:
агальне
число електронів, відданих відновником,
повинне дорівнювати числу електронів,
що приєднує окислювач. Загальне найменше
кратне для відданих і прийнятих
електронів десять. Розділивши це число
на 5, одержуємо коефіцієнт 2 для окислювача
і продукту його відновлення, а при
діленні
10
на
2
одержуємо коефіцієнт
5
для відновника і продукту його
окислювання. Коефіцієнти перед
речовинами, атоми яких не змінюють свій
ступінь окислювання, знаходять підбором.
Рівняння реакції буде мати вигляд:
2KMnО4 + 5H3PO3 + 3H2SO4 → 2MnSO4 + 5H3PO4 + K2SO4 + 3H2O
Приклад 4. Складіть рівняння реакції взаємодії цинку з концентрованою сульфатною кислотою, враховуючи максимальне відновлення останньої.
Рішення. Цинк, як будь-який метал, виявляє тільки відновні властивості. В концентрованій сульфатній кислоті окисну функцію несе сірка (+6). Максимальне відновлення сірки означає, що вона здобуває мінімальний ступінь окислювання. Мінімальний ступінь окислювання сірки як p-елемента VI-A групи дорівнює –2. Цинк як метал II-В групи має постійний ступінь окислювання +2. Відображаємо сказане в електронних рівняннях;
![]()


![]()
Складаємо рівняння реакції:
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
Перед H2SO4 стоїть коефіцієнт 5, а не 1, оскільки чотири молекули H2SO4 йдуть на зв’язування чотирьох іонів Zn2+.
