
- •Глава XI создание классической электродинамики
- •Джеймс Кларк Максвелл
- •Развитие и экспериментальное подтверждение теории Максвелла
- •Изобретение радио
- •Глава XII развитие теплофизики и атомистики в XIX веке.
- •Теплофизика и атомистика на рубеже XVIII – XIX столетий
- •Сади Карно
- •Открытие закона сохранения и превращения энергии
- •Создание теоретических основ термодинамики
- •Концепция «тепловой смерти» Вселенной
- •«Демон» Максвелла
- •Развитие молекулярно-кинетической теории
- •Метод термодинамических потенциалов
- •Людвиг Больцман
- •Развитие методов статистической механики
- •Низкие температуры и проблема сжижения газов
- •Глава XIII
- •Трудности гипотезы эфира
- •Интерферометрические опыты Хука и Физо
- •Мысленный эксперимент Максвелла
- •Эксперимент Майкельсона-Морли
- •Гипотеза лоренц-фитцджеральдовского сокращения
- •Баллистическая гипотеза Ритца
- •Эффект Доплера
- •Развитие электронной теории
- •Развитие электродинамики движущихся сред
- •Глава XIV проблема излучения абсолютно черного тела. Гипотеза квантов
- •Физика в конце XIX века
- •Проблема излучения абсолютно черного тела
- •Формулы Вина и Пашена
- •Формула Рэлея – Джинса.
- •Опыты Люммера и Прингсгейма
- •Формула Планка
- •Глава XV зарождение атомной физики
- •Открытие внешнего фотоэффекта
- •Разработка метода спектрального анализа
- •Создание периодической системы элементов
- •Спектральные серии атома водорода
- •Открытие рентгеновских лучей
- •Открытие электрона
- •Открытие радиоактивности
- •Открытие зависимости массы электрона от скорости
- •Электромагнитная теория материи
- •Исследования природы
- •Открытие закона радиоактивных превращений
- •Глава XVI теория относительности
- •Эволюция представлений о пространстве и времени
- •Создание специальной теории относительности
- •Создание четырехмерной формулировки теории относительности
- •Физическая наука и философская мысль на рубеже XIX и XX веков
- •Создание общей теории относительности
- •Зарождение и развитие релятивистской космологии
- •Попытки создания единой теории поля
Создание теоретических основ термодинамики
Поэтому Клаузиус считает, что одновременно с отказом от исповедуемой Карно концепции теплорода надо сохранить основную мысль Карно в виде нового принципа, который Клаузиус формулирует следующим образом: «Теплота не может переходить сама собой от более холодного тела к более тёплому». В своих последующих статьях Клаузиус неоднократно возвращался к этому принципу (который есть не что иное, как второе начало термодинамики) и разъяснял смысл выражения «сама собой». Теплота в ряде процессов может перейти от более холодного тела к тёплому, но «тогда одновременно с этим переходом … должен иметь место и противоположный переход теплоты от более тёплого к более холодному, либо должно произойти какое-либо другое изменение, обладающее той особенностью, что оно не может быть обращено без того, чтобы не вызвать со своей стороны … такой противоположный переход теплоты». Клаузиус указывает, что такой противоположный процесс должен рассматриваться «как компенсация перехода теплоты от более холодного тела к более тёплому», и даёт ещё одну формулировку принципа: «Переход теплоты от более холодного тела к более тёплому не может иметь место без компенсации».
Наглядным примером процесса такого рода может служить работа холодильника, цикл которого является обратным по отношению к циклу Карно идеальной тепловой машины. Однако для осуществления такого процесса требуется работа внешних сил, которая и играет роль компенсации.
Опираясь на первое
и второе начала термодинамики, Клаузиус
получил выражение для КПД идеальной
тепловой машины:
![]() .
.
Существенный вклад в развитие основ термодинамики внёс английский физик Уильям Томсон, получивший в 1892 году титул лорда Кельвина. В 1848 году он ввёл понятия абсолютной температуры и абсолютной шкалы температур (шкала Кельвина). Томсон заинтересовался вопросом о смысле понятия «температура» и обнаружил, что из теоремы Карно можно сделать простой, но очень важный вывод. Основное затруднение, возникавшее ранее при измерениях температуры, заключалось в том, что температурные шкалы, устанавливаемые с помощью различных термометрических тел, не совпадали друг с другом. Однако из теоремы Карно следовало совершенно не зависящее от рода вещества свойство, которое могло служить безупречным термометрическим свойством для установления температурной шкалы. Свойство это состояло в том, что коэффициент полезного действия обратимой тепловой машины совершенно не зависит от рода рабочего тела и определяется лишь температурами нагревателя и холодильника.
Если рабочее тело отбирает при температуре Т1 у нагревателя количество тепла Q1 и отдаёт холодильнику количество тепла Q2 при температуре Т2 , то оказывается справедливым соотношение:
![]() или
или
![]() .
(12.1)
.
(12.1)
Это соотношение,
справедливое для любого вещества,
позволяет использовать обратимую
тепловую машину Карно в качестве
своеобразного термометра. Измеряя
отношение количеств теплоты, взятой у
нагревателя и отданной холодильнику,
мы получаем отношение температур
нагревателя и холодильника
![]() .
Если при этом условиться, что разность
температур кипения воды и плавления
льда, как и по шкале Цельсия, составляет
100°,
можно построить физически безупречную
температурную шкалу. Действительно,
если взять в качестве нагревателя в
машине Карно кипящую воду, а в качестве
холодильника – тающий лёд, то будет
выполняться соотношение (12.1), где Т1
и Т2
– соответственно температуры кипения
воды и таяния льда, Q1
и Q2
– количества теплоты, полученное от
нагревателя и отданное холодильнику.
.
Если при этом условиться, что разность
температур кипения воды и плавления
льда, как и по шкале Цельсия, составляет
100°,
можно построить физически безупречную
температурную шкалу. Действительно,
если взять в качестве нагревателя в
машине Карно кипящую воду, а в качестве
холодильника – тающий лёд, то будет
выполняться соотношение (12.1), где Т1
и Т2
– соответственно температуры кипения
воды и таяния льда, Q1
и Q2
– количества теплоты, полученное от
нагревателя и отданное холодильнику.
Если взять далее в качестве холодильника некоторое исследуемое тело, температуру которого мы обозначим через Т, оставив в качестве нагревателя резервуар с кипящей водой, то, измерив количество теплоты Q1 , полученное рабочим телом у нагревателя (оно останется таким же, как и в первом случае), и количество теплоты Q , отданное холодильнику, мы опять сможем написать соотношение:
![]()
Добавляя к этим двум соотношениям третье: Т1 – Т2 = 100 , мы получим систему трёх уравнений для определения искомой температуры Т и температур Т1 и Т2 . Предложенная Кельвином температурная шкала, основанная на свойствах обратимой машины Карно, получила название термодинамической шкалы температур, а выраженные в этой шкале температуры измеряются в кельвинах (К).
К сожалению, при
всей красоте теоретического построения
шкалы Кельвина практическая реализация
идеального цикла Карно оказывается
технически невыполнимой. Но в этом и
нет нужды, т.к. установленная с помощью
машины Карно температурная шкала хорошо
воспроизводится в случае, когда в
качестве термометрического тела
используется идеальный газ. А именно,
температуры, измеренные по шкале
идеального газового термометра (где
значение температуры для 1 моля идеального
газа получается из соотношения
![]() )
в точности совпадают с температурой,
которая была бы получена в случае
технической осуществимости идеального
цикла Карно.
)
в точности совпадают с температурой,
которая была бы получена в случае
технической осуществимости идеального
цикла Карно.
В 1851 году Томсон сделал в Эдинбургском королевском обществе доклады, опубликованные в «Трудах» общества за 1851 г. и в «Philosophical Magazine» за 1852 г. под общим заглавием «О динамической теории теплоты». Эта работа обобщала новую точку зрения на теплоту, согласно которой «теплота представляет собой не вещество, а динамическую форму механического эффекта». Поэтому «должна существовать некоторая эквивалентность между механической работой и теплотой». Томсон указывает, что этот принцип был, по-видимому, сформулирован впервые в работах Майера и Джоуля. Томсон утверждает, что вся теория движущей силы теплоты основана на двух принципах.
Первый из них восходит к Джоулю и формулируется следующим образом: «Во всех случаях, когда равные количества механической работы производятся каким бы то ни было способом исключительно за счёт теплоты или бывают израсходованы на получение тепловых действий, всегда теряются или приобретаются равные количества теплоты». Это не что иное, как закон сохранения энергии, утверждающий эквивалентность теплоты и работы.
Второй принцип Томсон формулирует так: «Если какая-либо машина устроена таким образом, что при работе её в противоположном направлении все механические и физические процессы в любой части её движения превращаются в противоположные, то она производит ровно столько механической работы, сколько могла бы произвести за счёт заданного количества тепла любая термодинамическая машина с теми же самыми температурными источниками тепла и холода». Иначе говоря, Томсон утверждает, что коэффициент полезного действия обратимой тепловой машины однозначно определяется температурами нагревателя и холодильника, и что невозможно создать более эффективную или менее эффективную обратимую тепловую машину, чем машина, работающая по циклу Карно.
Действительно, пусть в нашем распоряжении имеются две обратимые тепловые машины с различными коэффициентами полезного действия 1 > 2 , или
![]() .
(12.2)
.
(12.2)
Тогда, заставив
эти машины работать в связке таким
образом, что более эффективная, работая
в прямом направлении, производит работу
Q1
– Q2
, которая
расходуется целиком на работу менее
эффективной машины в обратном направлении,
можно добиться перехода теплоты от
менее нагретого тела (холодильника) к
более нагретому (нагревателю) без
компенсации. Т.к. в рассматриваемом
случае
![]() ,
то из неравенства (12.2) следует, что
количество теплоты
,
то из неравенства (12.2) следует, что
количество теплоты
![]() ,
сообщаемое менее эффективной машиной
нагревателю, будет больше количества
теплоты Q1,
отбираемой у нагревателя более эффективной
машиной. Значит и количество теплоты
,
сообщаемое менее эффективной машиной
нагревателю, будет больше количества
теплоты Q1,
отбираемой у нагревателя более эффективной
машиной. Значит и количество теплоты
![]() ,
отбираемое менее эффективной машиной
у холодильника, будет больше количества
теплоты Q2
, сообщаемого
холодильнику более эффективной машиной.
В итоге тепло будет отбираться у
холодильника и сообщаться нагревателю
без совершения работы со стороны
каких-либо внешних сил и без изменения
состояния тепловых машин. А это
противоречит второму началу термодинамики
в рассмотренной выше формулировке
Клаузиуса.
,
отбираемое менее эффективной машиной
у холодильника, будет больше количества
теплоты Q2
, сообщаемого
холодильнику более эффективной машиной.
В итоге тепло будет отбираться у
холодильника и сообщаться нагревателю
без совершения работы со стороны
каких-либо внешних сил и без изменения
состояния тепловых машин. А это
противоречит второму началу термодинамики
в рассмотренной выше формулировке
Клаузиуса.
Если же рассмотреть
другой случай, когда не вся работа,
производимая более эффективной тепловой
машиной, расходуется на работу менее
эффективной машины в обратном направлении,
мы придём к другому парадоксу. Пусть
эти две машины, из которых более
эффективная работает в прямом направлении,
а менее эффективная – в обратном,
работают таким образом, что количество
теплоты Q2
, сообщаемое холодильнику более
эффективной машиной, равно количеству
теплоты
![]() , отбираемому у холодильника менее
эффективной машиной. Неравенство (12.2),
переписанное в виде
, отбираемому у холодильника менее
эффективной машиной. Неравенство (12.2),
переписанное в виде
![]() или
или
![]() ,
,
с учётом равенства
![]() приводит к неравенству
приводит к неравенству
![]() и, соответственно,
и, соответственно,
![]() .
То есть в этом случае количество тепла
Q1
, отбираемое
у нагревателя более эффективной машиной,
оказывается больше, чем сообщаемое
нагревателю менее эффективной машиной
тепло
.
То есть в этом случае количество тепла
Q1
, отбираемое
у нагревателя более эффективной машиной,
оказывается больше, чем сообщаемое
нагревателю менее эффективной машиной
тепло
![]() ,
а работа Q1
– Q2
, производимая
более эффективной машиной, – больше
работы
,
а работа Q1
– Q2
, производимая
более эффективной машиной, – больше
работы
![]() ,
потребляемой менее эффективной машиной.
В итоге при неизменном состоянии
холодильника рассмотренная связка двух
тепловых машин будет способна совершать
полезную работу
,
потребляемой менее эффективной машиной.
В итоге при неизменном состоянии
холодильника рассмотренная связка двух
тепловых машин будет способна совершать
полезную работу
![]() лишь за счёт тепла, отбираемого у
нагревателя.
лишь за счёт тепла, отбираемого у
нагревателя.
Поэтому свой второй принцип Томсон обосновывает следующей аксиомой: «Невозможно … получить от какой-либо массы вещества механическую работу путём охлаждения её ниже температуры самого холодного из окружающих предметов».
К этой формулировке, которую называют томсоновской формулировкой второго начала термодинамики, Томсон делает следующее примечание: «Если бы мы не признали эту аксиому действительной при всех температурах, нам пришлось бы допустить, что можно ввести в действие автоматическую машину и получать путём охлаждения моря или земли механическую работу в любом количестве, вплоть до исчерпания всей теплоты суши и моря или, в конце концов, всего материального мира». Описанную здесь «автоматическую машину» с подобными свойствами стали называть «perpetuum mobile 2-го рода», а формулировку Томсона второго начала термодинамики трактовать, как принцип невозможности вечного двигателя 2-го рода.
Первое и второе начала термодинамики были окончательно сформулированы в работах Клаузиуса. Он первый заговорил об эквивалентности тепла и работы как о первом начале теории тепла и в своей «Механической теории тепла» в 1850 году дал аналитическое выражение первого начала. Для этого надо было прежде всего сформулировать простое утверждение: всякое тело имеет внутреннюю энергию, которую можно увеличить двумя путями – производя над телом работу и подводя к телу тепло.
Однако Клаузиус не сразу пришел к пониманию этого факта. Первоначально уравнение первого начала термодинамики у него записывалось в виде
![]()
![]()
где Q – бесконечно малое количество теплоты, сообщенное телу, в результате чего количество теплоты, имеющееся в теле, изменяется на величину H и тело совершает внутреннюю I и внешнюю W работу.
Но Клаузиус быстро осознал, что внутренняя теплота и внутренняя работа «играют совершенно одинаковую роль», так что надо признать, что не существует величины, которую можно было бы назвать внутренней теплотой тела H, как нет внутри тела и величины, которую можно назвать работой I. Поэтому Клаузиус объединил H и I в одну функцию U = H + I и уравнение первого начала записал в виде
![]() (12.3)
(12.3)
Величину U он назвал, следуя Томсону, энергией тела. К состоянию с одной и той же энергией U можно прийти разными способами, по разному выбирая количество сообщаемой теплоты и производимой работы, оставляя неизменной лишь их сумму. В этом и заключалась главная «хитрость» природы, путь к пониманию которой оказался столь трудным и долгим.
В 1854 году Клаузиус дал математическое выражение второго начала термодинамики для обратимых процессов; в 1862 году он сделал это и для необратимых процессов. При этом он ввел в физику одну из самых удивительных величин – энтропию.
Энтропия была введена в физику чисто теоретическим путем, т.к. не существует прибора, которым можно было бы ее измерять. Клаузиус пришел к понятию энтропии, анализируя переходы тепла и изменение температуры в обратимом цикле Карно. Мы уже упоминали, что количества теплоты, отбираемое у нагревателя Q1 и сообщаемое холодильнику Q2 , связаны с температурами T1 и T2 нагревателя и холодильника соотношением (12.1):
![]()
Если условиться, что Q1 > 0 (тепло сообщается рабочему телу), а Q2 < 0 (тепло отбирается у рабочего тела), то последнее соотношение можно переписать в виде
![]() (12.4)
(12.4)
Клаузиус показал, что для любого обратимого кругового процесса выполняется равенство нулю контурного интеграла
![]() (12.5)
(12.5)
Это соотношение,
по Клаузиусу, и является математическим
выражением второго начала. Из него
следовало, что в некруговом обратимом
процессе интеграл
![]() не зависит от пути интегрирования, а
зависит лишь от начального и конечного
состояний. Из последнего обстоятельства
следовало существование некоторой
величины S
, которая является, как и энергия, функцией
состояния: S
= S(P,V)
и имеет в состоянии a
значение
S(a),
а в состоянии
b
– значение S(b),
так что
не зависит от пути интегрирования, а
зависит лишь от начального и конечного
состояний. Из последнего обстоятельства
следовало существование некоторой
величины S
, которая является, как и энергия, функцией
состояния: S
= S(P,V)
и имеет в состоянии a
значение
S(a),
а в состоянии
b
– значение S(b),
так что
![]() (12.6)
(12.6)
Эту функцию Клаузиус ввел в 1865 году и назвал ее энтропией (от греческого entropia – поворот, превращение). Определяющей формулой для энтропии стала
![]() (12.7)
(12.7)
Формулы (12.6) и (12.7), вообще говоря, определяют не саму энтропию, а разность энтропий двух состояний. Поэтому значение энтропии при абсолютном нуле температуры было принято за нуль, а энтропия любого другого состояния вычисляется относительно этого реперного состояния:
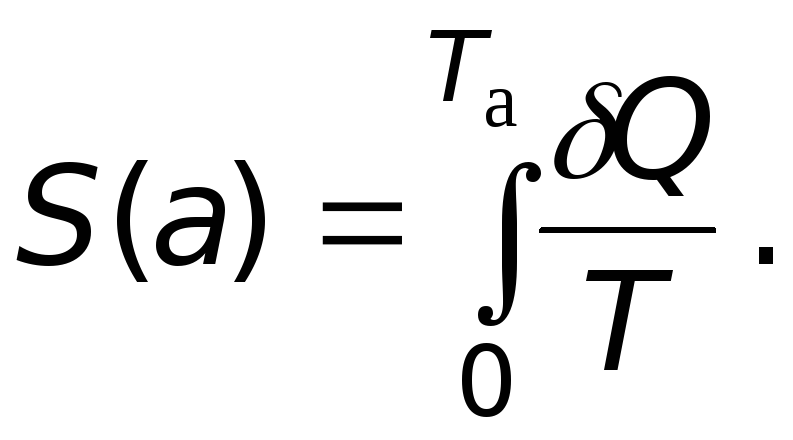 (12.8)
(12.8)
Клаузиус показал, что в случае необратимых процессов приращение энтропии не определяется формулой (12.7), а выполняется неравенство
![]() (12.9)
(12.9)
Поскольку энтропия
есть функция состояния, то изменение
энтропии при необратимом переходе
системы из состояния 1 в состояние 2
должно равняться изменению энтропии
при обратимом переходе между этими же
состояниями. Соответственно,
для кругового процесса
![]() поэтому
поэтому
![]() .
(12.10)
.
(12.10)
Это так называемое неравенство Клаузиуса для необратимых процессов.
Из приведенных
соотношений следовало, что в случае
необратимого процесса в адиабатически
изолированной системе, когда
![]() dS
>
0, т.е. изолированная система может
переходить лишь в состояния с большей
энтропией.
dS
>
0, т.е. изолированная система может
переходить лишь в состояния с большей
энтропией.
