
Весна 16 курс 3 ОрТОР / Теория АД / Термодинамика и теплопередача Никифоров А.И.-1
.pdf71
Парциальное давление pi, которое создавал бы каждый i-й газ, определяется по формуле
pi = ri p, |
(2.49) |
где ri — объемная доля i-го компонента газа; |
|
p — значение общего давления смеси. |
|
Запишем уравнение Клапейрона (1.11) для 1 кг смеси: |
|
pсм υсм = Rсм Tсм |
(2.50) |
и n уравнений для каждого из ее компонентов |
|
pi υi = gi Ri Tсм , |
(2.51) |
где i изменяется от 1 до n. |
|
Просуммируем n уравнений (2.51) с учетом уравнения Дальтона (2.48): |
|
n |
|
pсм υсм = Tсм gi Ri . |
(2.52) |
1 |
|
Приравнивая правые части уравнений (2.50) и (2.52), получим искомую зависимость газовой постоянной смеси от массовых долей gi и газовых постоянных компонентов, то есть «чистых» газов:
|
n |
|
|
|
|
|
||
Rсм = |
giRi . |
|
(2.53) |
|||||
|
1 |
|
|
|
|
|
|
|
Используя уравнение (1.14) Ri = |
Ryн |
|
8314 |
, Дж/(кг·К) получим другой |
||||
μi |
μi |
|||||||
|
|
|||||||
вид этого уравнения: |
|
|
|
|
|
|
|
|
n |
|
|
gi |
|
|
|
|
|
Rсм = 8314 |
|
, Дж/(кг·К) . |
(2.54) |
|||||
|
|
|||||||
1 |
|
|
μi |
|
|
|
||
Таким образом, для определения газовой постоянной смеси Rсм
необходимо знать массовые доли компонентов газа gi в смеси и молекулярные массы одного киломоля μi каждого i-го газа в составе смеси.

72
Примеры решения задач
Задача 2.1
Выхлопные газы двигателя внутреннего сгорания имеют следующий объемный состав:
углекислого газа rCO2 — 14 %; кислорода rO2 — 5 %; азота rN2 — 79 %; окиси углерода
rCO — 2 %. Найти условную молекулярную массу, газовую постоянную плотность смеси при
500 °С и 720 мм рт. ст.
Решение
Определим условную молекулярную массу смеси газов μсм по формуле
n
μсм = ri i , i 1
где ri — объемные доли компонентов выхлопных газов;
μi — молекулярные массы компонентов выхлопных газов, кг/кмоль.
Таким образом, условная молекулярная масса смеси газов вычисляется следующим
образом:
n |
|
|
|
|
|
|
|
|
μсм = ri i |
= rCO2 |
CO2 + rO2 |
O 2 + rN2 N 2 + rCO CO = |
|||||
i 1 |
|
|
|
|
|
|
|
|
= 0,14·44 + 0,05·32 + 0,79·28 + 0,02·28 = 30,44 кг/кмоль. |
||||||||
Теперь, используя формулу (1.14), можно определить газовую постоянную смеси Rсм: |
||||||||
|
Rμ |
|
Rун |
8314 |
|
8314 |
|
|
Rсм = |
|
|
|
|
|
|
|
= 273 Дж/(кг·К). |
μсм |
μсм |
μсм |
30,44 |
|||||
Проверим правильность получения размерности газовой постоянной смеси:
Дж кг кмоль К : кмоль = Дж/(кг·К).
Определим плотность газов ρо при нормальных физических условиях [pо =101325 Па
(760 мм рт. ст.), То = 273,15 К], зная, что 1 киломоль газа в этих условиях занимает объем,
равный Vμ = 22,41 м3/кмоль.
Тогда
ρо = см 30,44 = 1,36 кг/см3.
V 22,41
Проверим правильность получения размерности плотности газа:

73
кг |
: |
м3 |
|
кг |
||
кмоль |
|
кмоль |
|
м |
3 |
. |
|
|
|
|
|||
Для определения плотности смеси газов ρсм по условиям задачи при Т = 773 К (500 °С)
и p = 720 мм рт. ст. запишем уравнение состояния газов для этого состояния и уравнение состояния при нормальных физических условиях:
1
pυсм = p ρсм = RT — уравнение для заданных условий (Т = 773 К и р = 720 мм рт. ст.);
1
poυo = po ρо = RTo — уравнение для нормальных физических условий (Тo = 273,15 К и
рo = 760 мм рт. ст.).
Откуда имеем
|
pTo |
1,36 |
720 |
273 |
3 |
|
|
ρcм = ρо |
|
|
|
|
= 0,455 кг/м |
. |
|
p T |
760 |
773 |
|||||
|
o |
|
|
|
|
|
|
Проверим правильность полученной размерности плотности смеси газов:
кг |
|
мм рт.ст. К |
|
кг |
|
|
|
|
. |
||
м3 |
мм рт.ст. К |
м3 |
|||
Таким образом, выхлопные газы при 500 °С и 720 мм рт. ст. имеют условную молекулярную массу μсм = 30,44 кг/кмоль; газовую постоянную Rсм = 273 Дж/(кг ·К) и
плотность ρсм = 0,455 кг/м3.
Задача 2.2
Определить состав генераторного газа в массовых процентах и парциальные давления компонентов при общем давлении смеси 760 мм рт. ст., если газ имеет следующий состав в объемных процентах: водород Н2 — 15 %; окись углерода СО — 27 %; углекислый газ СО2
— 8 %; азот N2 — 50 %.
Решение
По атомным массам элементов определим молекулярные массы газов, входящих в смесь (округленно): H2 = 2·1 = 2, CO = 12 + 16 = 28;
CO2 = 12 + 2·16 = 44, N2 = 2·14 = 28.
Условную молекулярную массу смеси μсм определим по формуле (см. задачу 2.1)
n |
|
|
|
|
|
|
|
|
|
|
μсм = ri |
i = rH |
2 |
H |
+ rCO |
CO + rCO |
2 |
CO |
+ rN |
N |
= |
i 1 |
|
|
2 |
|
|
2 |
2 |
2 |
||
|
|
|
|
|
|
|
|
|
|

74
= 0,15·2 + 0,27·28 + 0,08·44 + 0,50·28 = 25,37 кг/кмоль.
Массовые доли компонентов газа gi находятся по формуле
gi = ri i ;
см
gH |
|
|
0,15 2 |
= 0,012; |
||||||
2 |
25,37 |
|||||||||
|
|
|
|
|
|
|||||
gCO |
|
|
0,27 28 |
= 0,298; |
||||||
25,37 |
|
|||||||||
|
|
|
|
|
|
|||||
gCO |
|
0,08 44 |
= 0,138; |
|||||||
|
|
|||||||||
|
|
2 |
25,37 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
gN |
|
|
0,50 28 |
= 0,552 . |
||||||
2 |
25,37 |
|
||||||||
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
||
Проверим правильность полученных значений массовых долей компонентов. Сумма
n
полученных значений должна быть равна единице,то есть gi = 1:
i 1
n
gi = gH2 + gCO + gCO2 + g N2 = 0,012 + 0,298 + 0,138 + 0,552 = 1,000.
i 1
Следовательно, массовый состав газа в процентах будет следующим: водород Н2 —
1,2 %; окись углерода — 29,8 %; углекислый газ СО2 = 13,8 %; азот N2 — 55,2 %.
Парциальное давление рi, которое создавал бы каждый i-й газ, определяется по формуле (2.49)
pi = ri p,
где ri — объемная доля i-го компонента газа;
р — значение общего давления смеси.
pH2 = rH2 р = 0,15 · 760 = 114 мм рт. ст.;
pCO = rCO р = 0,27 · 760 = 205,2 мм рт. ст.;
pCO2 = rCO2 р = 0,08 · 760 = 60,8 мм рт. ст.;
pN2 = rN2 р = 0,5 · 760 = 380 мм рт. ст.
Проверим правильность полученных значений парциальных давлений компонентов газа. Сумма парциальных давлений компонентов газа должна быть равна значению общего давления смеси, по условиям задачи — 760 мм рт. ст.:

75
pi = pH2 + pCO + pCO2 + pN2 = 114 + 205,2 + 60,8 + 380 = 760 мм рт. ст.
Задача 2.3
Сжатый воздух при давлении 180 · 105 Па и температуре 273 К находится в баллоне объемом 2 · 10-3 м3. Температура окружающей среды повысилась до 290 К. Определить количество воспринятого тепла сжатым воздухом и его конечное давление.
Решение
Сжатый воздух в результате повышения температуры окружающей среды воспринимает энергию в виде теплоты q и переходит из одного состояния с параметрами
р1, V1, T1 в другое состояние с параметрами р2, V2, T2 , причем по условию задачи V1 = V2,
так как сжатый воздух находится в замкнутом баллоне.
Напишем уравнение Клапейрона (1.10) для каждого состояния в виде:
р1 V1 = mRT1 — для начального состояния;
р2 V2 = mRT2 — для конечного состояния.
Поделив почленно первое уравнение на второе и имея в виду, что V1 = V2, получим искомое значение конечного давления сжатого воздуха:
|
p T |
|
180 105 290 |
|
|
|
p2 = |
1 2 |
|
= 191,2 · 105 |
Па. |
||
T1 |
273 |
|||||
|
|
|
|
Для определения воспринятого количества теплоты воспользуемся уравнением (2.40)
первого закона термодинамики:
q = U + L.
Так как по условию задачи V1 = V2, газ не совершает работы, поэтому L = 0, значит,
количество воспринятого тепла сжатым воздухом равно изменению внутренней энергии сжатого воздуха, то есть
q = U = Cυ(T2 – T1) = 0,720(290 – 273) = 12,24 кДж/кг.
Проверим правильность получения размерности количества теплоты:
кДж К кДж/кг . кг К
Таким образом, в результате повышения температуры окружающей среды от 273 К до
290 К каждый килограмм сжатого воздуха воспринимает 12,24 кДж/кг тепла, при этом давление воздуха в баллоне повысится от 180 · 105 Па до 191 · 105 Па.
76
Задача 2.4
В начальном состоянии воздух имел удельный объем 0,5 м3/кг и начальную температуру 320 К. После подвода тепла при постоянном давлении температура воздуха повысилась на 150 К. Определить давление воздуха, конечный удельный объѐм и количество подведѐнного тепла.
Решение
Параметры воздуха в результате подведенного тепла q при постоянном давлении p = соnst (р1 = р2) изменяются от υ1 = 0,5 м3/кг и Т1 = 320 К до υ2 и Т2 = Т1 + Т = 320 К + +150 К = 470 К .
Для начального и конечного состояния воздуха напишем уравнения состояния для 1 кг
газа (1.11):
р1 υ1 = R·Т1;
р2 υ2 = R·Т2.
Из первого уравнения определим значение давления воздуха:
p1 = p2 = |
RT1 |
|
287 320 |
= 183 680 Па. |
υ |
|
0,5 |
||
|
1 |
|
|
|
Проверим правильность полученной размерности давления:
Дж/(кг К) К |
|
Н м |
|
|
|
= Па. |
|
м3 / кг |
м2 м |
||
Из второго уравнения определим значение конечного удельного объема
|
RT |
|
287 470 |
|
υ2 = |
2 |
|
= 0,73 м3/кг. |
|
p |
183680 |
|||
|
2 |
|
|
|
Проверим правильность получения размерности удельного объема
Дж/(кг К) К |
|
Н м м2 |
|
м3 |
|
|
|
|
. |
||
Н/м2 |
Н кг |
кг |
|||
Для определения подведенного количества теплоты воспользуемся уравнением (2.40)
первого закона термодинамики
q = U + L,
где U = Сυ Т;
L = р (υ1 – υ2) = R (Т1 – Т2) = R Т .
Таким образом,
q = Сυ Т + R Т = (Сυ + R) Т = Ср Т;
77
q = 1,005 · 150 = 150,75 кДж/кг.
Проверим правильность получения размерности подведенного количества теплоты
кДж/(кг·К)·К = кДж/кг.
Таким образом, при повышении температуры воздуха на 150 К при постоянном давлении к каждому килограмму воздуха подводится тепло q = 150,75 кДж/кг, в результате параметры воздуха примут следующие значения: υ2 = 0,73 м3/кг; р1 = р2 = 183,68 кПа;
Т2 = 410 К.
Задача 2.5
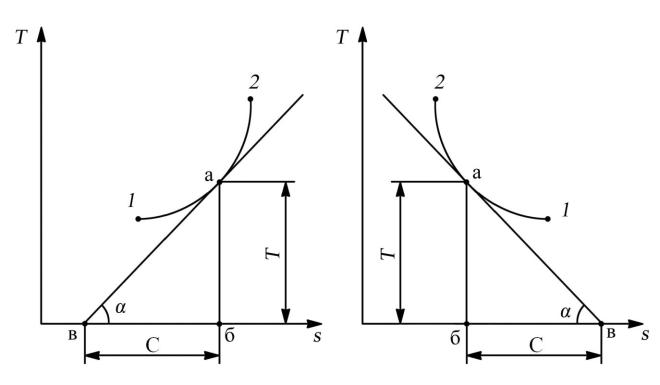
Определение истинной теплоемкости в произвольной точке термодинамического процесса с использованием «T–s» диаграммы (рис. 2.8,а и 2.8,б).
Рис. 2.8. К графическому определению истинной теплоемкости процесса при температуре T

78
Решение
На рис. 2.8, а представлена «T–s» диаграмма процесса 1–2, протекающего с увеличением энтропии. В точке а, где рабочее тело имеет температуру T, проведем касательную, которая образует с осью энтропии (абсцисс) угол α. В прямоугольном треугольнике абв катет аб по величине определяет температуру рабочего тела Т, то есть аб = Т, а угловой коэффициент
dT
tgα = ds .
Для любого процесса можно написать две зависимости для определения теплоты,
участвующей в процессе через энтропию и теплоемкость: dq = Tds;
dq = CdT.
Приравнивая правые части этих зависимостей, определим значение теплоемкости процесса
ds
С = T dT .
Учитывая формулу углового коэффициента, находим:
T T T
С = tg , или tgα = С = вб .
Из последнего равенства С = вб. Таким образом, отрезок вб, представляющий собой подкасательную кривой процесса в точке а, определяет истинную теплоемкость процесса при температуре Т.
Положительному значению tgα будет соответствовать положительное значение теплоемкости (рис. 2.8, а), а отрицательному значению tgα — отрицательное (рис. 2.8, б).
79
Проверьте, как вы усвоили материал
1.Напишите формулу для определения величины изменения внутренней энергии.
2.Какой параметр в точности определяет величину внутренней энергии идеального газа?
3.Какие способы изменения внутренней энергии рабочего тела вы знаете?
4.Каким образом характер протекания термодинамического процесса влияет на изменение внутренней энергии?
5.Приведите примеры изменения внутренней энергии рабочего тела при сообщении ему энергии в форме теплоты.
6.Приведите примеры изменения внутренней энергии рабочего тела при совершении им механической работы.
7.Напишите формулу для определения элементарного количества теплоты через параметры состояния.
8.Какая работа в термодинамике считается положительной?
9.Напишите формулу для определения элементарного количества теплоты через параметры состояния.
10.Дайте определение физической величины энтропия и напишите выражение для определения изменения энтропии.
11.Можно ли графически изобразить работу и теплоту?
12.Какая физическая величина называется удельной теплоемкостью?
13.Назовите основные факторы, определяющие величину теплоемкости рабочего тела.
14.Есть ли разница между удельными теплоемкостями при постоянном объеме и давлении?
15.Напишите уравнение Майера, определите из уравнения физический смысл газовой постоянной.
16.Дайте определение энтальпии и напишите выражение для определения величины энтальпии.
17.Какие из величин Т, р, U, L, Q, s, i являются функциями состояния и какие зависят от характера процесса?
18.Напишите выражение для определения технической работы (работы движущегося газа).
19.Изобразите на графике работу движущегося газа. Как определяется знак технической работы?
20.Сформулируйте первый закон термодинамики. Приведите математическую запись первого закона термодинамики.
21.Что означает, что первый закон термодинамики можно рассматривать как принцип запрета perpetuum mobile?
22.Напишите выражение первого закона термодинамики через энтропию для закрытых и открытых термодинамических систем.
23.Что называется парциальным давлением газа в смеси? Что необходимо знать для определения величины газовой постоянной смеси газов?
80
Глава 3. Термодинамические процессы
3.1. Последовательность и объем расчета термодинамических процессов
В тепловых двигателях при их работе протекают разнообразные термодинамические процессы. Целью изучения термодинамических процессов является установление закономерностей изменения параметров состояния ТДС
и особенностей преобразования энергии в этих процессах.
Знание указанных закономерностей имеет большое значение для
понимания процессов, протекающих в элементах ГТД и ДВС.
Анализ (или расчет) термодинамических процессов производится обычно в
следующей последовательности.
1. Определяют уравнение процесса: исходя из условий протекания
процессов и используя уравнение состояния идеального газа, находят уравнения процесса в виде зависимостей
p = f (υ); T = f (υ); T = f (p).
2. Определяют закон изменения параметров на основании уравнения
процесса и уравнения состояния, используя известные по условиям задачи значения параметров состояния в начале процесса (p1, υ1, T1), в конце процесса
(p2, υ2, T2), а если требуется, то и в промежуточных состояниях.
3. |
Осуществляют графическое построение процесса в рабочей «p–υ» |
|
диаграмме и тепловой «T–s» диаграмме. |
||
4. |
Определяют величины, входящие в первый закон термодинамики. |
|
|
|
q = ∆U + L; T∆s = ∆U + pdυ. |
|
2 |
T2 |
а) |
q = dq CdT ; |
|
|
1 |
T1 |
|
2 |
T2 |
б) ∆U = dU CυdT ; |
||
|
1 |
T1 |
