
Весна 16 курс 3 ОрТОР / Теория АД / Термодинамика и теплопередача Никифоров А.И.-1
.pdf
51
Таким образом,
Теплота и работа представляют собой две единственно возможные формы передачи энергии от одного тела к другому.
Разница состоит в том, что:
теплота является формой передачи энергии неупорядоченного движения частиц;
работа — форма передачи энергии упорядоченного организованного движения.
Работа и теплота не содержатся ни в какой-либо части термодинамической системы, ни в источниках теплоты или работы, ни в рабочем теле. Работа и теплота появляются только тогда, когда осуществляется передача энергии или ее преобразование из одного вида в другой. Поэтому
Теплота и работа являются функциями термодинамического процесса, но не являются параметрами состояния.
2.4. Энтропия. Энтропийная «T–s» диаграмма
Долгое время признаком наличия теплообмена считали изменение температуры. Однако оказалось, что это не так. Достаточно вспомнить, что,
например, при кипении воды к ней подводится большое количество теплоты,
однако температура остается постоянной. При затвердевании жидкостей теплота отводится, но это не приводит к снижению температуры до тех пор,
пока вся жидкость не превратится в кристаллы. В этих примерах теплообмен не приводит к изменению температуры. Наоборот, при сжатии газа в цилиндре температура газа растет, хотя теплота может даже отводиться, если стенки

52
цилиндра холодные. В этом примере изменение температуры вызвано не теплообменом, а механической работой.
Физическая величина, изменение которой действительно является признаком теплообмена, была указана только в 1852 г. немецким физиком Р. Клаузиусом после глубокого научного анализа изменений, наблюдаемых в системе при обмене тепловой энергией. Позднее эта физическая величина получила название энтропии.
Энтропией называется физическая величина, изменение которой является
признаком наличия обмена энергией в форме теплоты, обозначается буквой «s»
и имеет размерность Дж/К для произвольной массы газа, а отнесенная к 1 кг рабочего тела — Дж/(кг·К) (удельная энтропия).
Основная особенность энтропии как термодинамической величины состоит в том, что она обязательно изменяется при наличии теплообмена. При подводе теплоты к термодинамической системе энтропия системы возрастает, при отводе уменьшается.
Кроме теплообмена, никакие другие воздействия на систему не могут изменить значения энтропии.
Главная трудность в понимании физического смысла энтропии состоит в том, что энтропия не оказывает воздействия на измерительные приборы, и
поэтому ее нельзя измерить, как это делают, например, с давлением или объемом. Впоследствии будет показано, что можно лишь вычислить изменение энтропии по изменению тех параметров, которые доступны для непосредственного измерения в системе (давления, температуры, объема).
Следовательно,
Энтропия является функцией состояния термодинамической системы.

53
Связь между количеством теплоты и изменением энтропии такая же, как
связь между количеством работы и изменением объема системы.
Элементарное количество теплоты равно произведению абсолютной
температуры системы на изменение энтропии системы: |
|
|
dq = Tds. |
(2.18) |
|
Полное количество теплоты в каком-либо процессе определяется в виде |
||
интеграла: |
|
|
2 |
S2 |
|
Q1-2 = dq Tds . |
(2.19) |
|
1 |
S1 |
|
Рис. 2.3. Изображение теплоты в «T–s» диаграмме
54
Так же как и в случае работы, для аналитического вычисления количества теплоты по выражению (2.19) требуется знать уравнение, связывающее значения температуры и энтропии в каждой точке данного процесса, то есть уравнение
Т = f (s).
Будучи уравнением, связывающим между собой два параметра в процессе, оно также является уравнением процесса. Графическое изображение уравнения T=f(s) представляет собой так называемую энтропийную диаграмму (или тепловую диаграмму) процесса 1–2 (рис. 2.3). В «T–s» диаграмме количество теплоты выражается точно так же, как и количество работы в «p–υ»
диаграмме, а именно в виде площади под линией процесса (пл. а12б).
Определить, подводится теплота к системе или отводится от нее (то есть определить знак количества теплоты), можно по изменению энтропии.
Уравнение (2.18) показывает, что при подводе теплоты к системе (dq > 0)
энтропия увеличивается (ds > 0), и, наоборот, при отводе теплоты от системы
(dq < 0) энтропия уменьшается (ds < 0).
В связи с тем, что энтропия не может быть измерена никаким прибором,
выражения (2.18) и (2.19) используются в основном для графического определения количества теплоты и для теоретического анализа изменений,
происходящих в термодинамических системах при взаимодействии их с окружающей средой. В частности, именно на основе уравнения (2.18), как мы увидим дальше, можно найти связь между изменением энтропии и другими параметрами состояния.
Для изолированной термодинамической системы энтропия не меняется,
если в ней совершаются обратимые процессы, то есть s=const, следовательно, ds = 0.

55
2.5. Зависимость количества работы и теплоты от характера термодинамического процесса
Имея выражение для количества работы и теплоты через параметры состояния системы и их графическое представление в «p–υ» и «T–s»
диаграммах, легко показать, что количества работы и теплоты зависят от характера процесса. Вне процесса понятия теплоты и работы не имеют смысла,
так как обозначают не запас энергии, а лишь количества энергии, передаваемые в ходе процесса. Физически характер процесса зависит от соотношения между количествами работы и теплоты, которыми система обменивается с окружающей средой, изменяя свое состояние. Аналитически различие в характере процессов выражается различием между уравнениями разных процессов.
В соответствии с формулами (2.15) и (2.19) для определения количества работы и теплоты (взятие интеграла) необходимо иметь характеристики процесса в виде уравнений p = f (υ) и T = f (s). Следовательно,
Количества работы и теплоты зависят от характера процесса.
Графически различие в характерах процессов выражается тем, что разные процессы изображаются различными кривыми в диаграммах состояния. А так как количество работы в «p–υ» диаграмме и количество теплоты в «T–s»
диаграмме представляются в виде площадей под линиями процессов, то в этих диаграммах зависимость количеств работы и теплоты от характера процесса наиболее наглядна.
В самом деле, если система рассматривается в двух определенных состояниях, характеризующихся определенными значениями параметров и функций состояния, то на диаграммах (рис. 2.4, а и 2.5, а) эти состояния изображаются точками 1 и 2. При этом на диаграмме нет никакой линии,
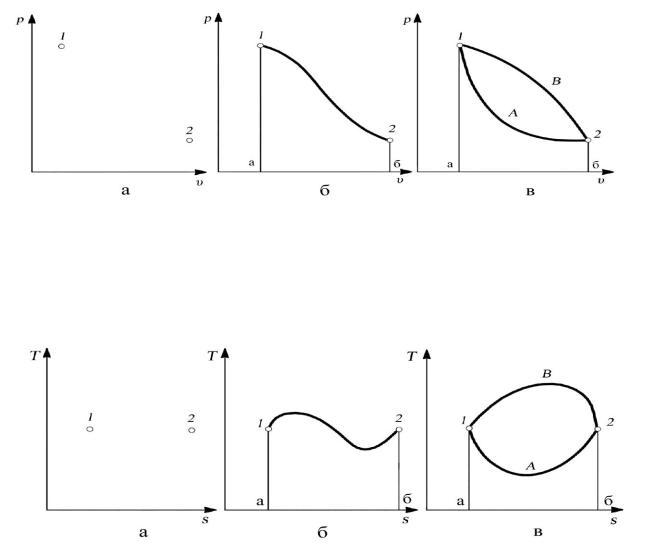
56
связывающей точки 1 и 2, а следовательно, и площади под ней — работы
(и соответственно в «T–s» диаграмме — теплоты).
Если система, обмениваясь теплотой и работой с окружающей средой, переходит из состояния 1 в состояние 2, то это изменение выражается линией на диаграмме состояния, например линией 1–2 (см. рис. 2.4, б и 2.5, б). В этом случае количества работы и теплоты выражаются в виде площадей соответственно на «p–υ» и «T–s» диаграммах, например, площадь а12б на рис. 2.4, б определяет работу в процессе 1–2, а площадь а12б на рис. 2.5, б — теплоту в том же процессе.
Рис. 2.4. Зависимость работы от характера процесса: а — знания начального и конечного состояний недостаточно для вычисления работы; б — при задании линии процесса работа выражается площадью под линией; в — при одинаковых начальных и конечных состояниях работа различна в различных процессах
Рис. 2.5. Зависимость теплоты от характера процесса: а — знания начального и конечного состояний недостаточно для вычисления теплоты; б — при задании линии
процесса теплота выражается площадью под линией; в — при одинаковых начальных и конечных состояниях теплота различна в различных процессах
57
Однако характер изменения состояния системы между точками 1–2 может быть разным (линии 1А2 и 1В2 на рис. 2.4, в и 2.5, в), что, как уже отмечалось,
зависит от соотношения между работой и теплотой при изменении состояния.
Площади под линиями 1A2 и 1В2 оказываются различными, следовательно,
различными будут и количества работы и теплоты в этих двух процессах.
В примере, представленном на рис. 2.4, в,
L1A2 = pdυ < L1B2 = |
pdυ . |
1 A2 |
1 B 2 |
|
В примере, представленном на рис. 2.5, в,
q1A2 = Tds q1B2 = Tds .
1 A2 |
1 B 2 |
2.6. Теплоемкость газа. Уравнение Майера. Показатель адиабаты
Теплоемкость характеризует одно из свойств какого-либо рабочего тела и представляет собой количество подводимой или отводимой теплоты соответственно при нагреве или охлаждении рабочего тела на 1 Кельвин. При данных исходных параметрах состояния (Т, р или Т) теплоемкость 1 кг рабочего тела определяется в бесконечно малом интервале температур dT:
C = lim |
Q |
|
|
|
dQ |
, Дж/(кг·К). |
(2.20) |
|
T |
dT |
|||||||
|
|
|
|
|||||
T |
0 |
|
|
|
|
|||
Эта теплоемкость, в основном применяемая при расчетах, является удельной массовой, которую для краткости будем называть просто теплоемкостью (заметим, что существуют и другие удельные теплоемкости — единицы объема или одного моля, но они используются редко).
Теплоемкость зависит от трех основных факторов. Прежде всего, от
природы вещества. Газ, жидкость, твердое тело имеют свое определенное и
58
конкретное значение теплоемкости, характерное только для данного вещества.
Например, теплоемкость воды в 4 раза больше, чем теплоемкость воздуха;
теплоемкость водорода в 14,5 раз больше, чем теплоемкость воздуха и в 3,5 раза больше, чем теплоемкость воды, и т. д.
Второй фактор — это исходные параметры состояния, при которых теплоемкость определяется. Теплоемкость газов (рабочих тел ГТД и ДВС)
зависит практически только от температуры С = f(T). Заметим, что у идеальных газов теплоемкость от температуры не зависит. Но у рабочих тел ГТД и ДВС,
хотя и близких к идеальным газам, влияние температуры заметно. Так, в
характерных для ГТД диапазонах изменения температуры воздуха от ~ 250 до
800 К и продуктов сгорания от 700 до 1 600 К теплоемкости возрастают соответственно примерно на 10 % и на 15 %. Условие С = const принимают лишь при весьма приближенных расчетах, поэтому будет учитываться зависимость от температуры и теплоемкости и также других, связанных с ней и рассматриваемых ниже параметров. Но влияние давления и удельного объема при не очень высоких давлениях до ~ (70·105—100·105 Па) ничтожно мало.
Сучетом зависимости С от Т конечное количество теплоты Q, подводимой
кединице массы рабочего тела при его нагреве (или отводимой при охлаждении) в конечном интервале температур Т, определяется из уравнения
(2.20)
T2 |
|
Q1-2 = СdT = Ccр(T2 – T1), |
(2.21) |
T1 |
|
где индексами 1 и 2 обозначены начальное и конечное состояния рабочего тела;
Сср — среднее значение теплоемкости в интервале температур Т1—Т2.
С достаточной точностью (хотя и приближенно) Сср может быть определена как среднее арифметическое теплоемкостей (иногда их называют истинными в
отличие от средней) при температурах Т1 и Т2: |
|
Ccp = 0,5[C (T1) + C (T2)] . |
(2.22) |

59
Значения С = С(Т) приводятся в справочниках в виде таблиц или графиков.
Третий фактор, влияющий на теплоемкость, относится к сжимаемым рабочим телам — газам. Рассмотрим, в чем проявляется влияние этого фактора.
Предположим, имеется жесткая закрытая термодинамическая система неизменного объема (рис. 2.6, а) в виде цилиндра, закрытого неподвижным поршнем. В цилиндре содержится 1 кг рабочего тела. Поэтому не изменяется так же удельный объем υ Vm , но давление изменяется: например, при подводе теплоты возрастает.
Таким образом, осуществляется только один вид энергообмена — теплообмен. Истинная теплоемкость при постоянном объеме определяется уравнением (2.20), в котором для данного случая соответствующие величины снабжены индексом υ:
С υ = |
dqυ |
. |
(2.23) |
|
|||
|
dT |
|
|
Сохраняются и уравнения (2.21) и (2.22) также с индексами υ, то есть qυ1-2
и Cυ ср.
Теперь пусть система на рис. 2.4, б, оставаясь закрытой, станет нежесткой:
поршень в цилиндре может свободно перемещаться в обе стороны. Тогда,
например, при подводе теплоты (dq > 0) и нагреве рабочего тела давление
Рис. 2.6. К определению теплоемкости рабочего тела: а —
при υ = const; б — при p = const
60
остается постоянным, но газ расширяется, и его удельный объем возрастет на величину dυ = Fdx, где F — площадь поршня. Осуществляются оба вида энергообмена — теплообмен и работа изменения объема, определяемая уравнением (2.14) при бесконечно малом перемещении поршня и (2.15) при конечном перемещении, причем при р = const Lυ = р (υ2 – υ1).
В результате подводимая к термодинамической системе теплота затрачивается и на нагрев газа, и на работу термодинамической системы над окружающей средой (при отводе теплоты все описанные явления происходят в обратном направлении также при р = const). Обозначим бесконечно малую теплоту, отводимую термодинамической системе в процессе р = const с
индексом р, dqр . По аналогии с уравнением (2.23) истинная теплоемкость при постоянном давлении
|
dq p |
|
|
Ср = |
|
. |
(2.24) |
dT |
|||
Поскольку dqp > dqυ из-за наличия работ изменения объема dLυ , то Ср > Cυ. |
|||
В уравнениях (2.21) и (2.22) соответствующие величины также снабжаются индексом р, то есть qp1-2 и Cp cp.
При теплообмене параметры состояния газа р и υ изменяются по-разному в жесткой и нежесткой термодинамических системах, соответственно υ = const,
р = var и р = const, υ = var. Однако на количество поглощаемой
непосредственно только газом теплоты (или отводимой от газа) это не влияет,
поскольку, как отмечалось ранее, теплоемкость газов практически не зависит от параметров состояния р и υ, а только от температуры Т. Поэтому в жесткой
(υ = const) и нежесткой (р = const) термодинамических системах при
одинаковых изменениях температуры (в данном случае бесконечно малых dT)
газ поглощает (или отдает) одинаковое количество теплоты dqυ. С учетом уравнения (2.14) количество теплоты, подводимой к нежесткой термодинамической системе (а не только), определяется суммой
dqp = dqυ + pdυ. |
(2.25) |
