
- •1.Критерии аналитической надежности лабораторных исследований
- •6.Устройство, основные характеристики и правила настройки микроскопа. Основные микроскопические технологии.
- •7.Приготовление цитологического мазка, правила фиксации и окраски. Теория цитологических окрасок.
- •9.Основные этапы созревания гранулоцитов и моноцитов, опишите морфологические и цитохимические признаки клеток миелопоэза. Клиническое значение цитологического исследования клеток миелопоэза.
- •20.2.5.1. Фрагмент общей схемы
- •20.2.5.2. Антигеннезависимая дифференцировка
- •20.2.5.3. Антигензависимая дифференцировка
- •II. Проплазмоцит и плазмоцит
- •III. Активированные т-лимфоциты
- •14.Хронические миелопролиферативные заболевания. Патогенез, диагностика. Современные возможности лечения.
- •16.Острый миелолейкоз. Методы цитохимического анализа миелобластов.
- •18.Современные методы клинического исследования крови. Сравнительная характеристика и клиническое значение микроскопии мазка и исследования крови в гематологическом анализаторе.
- •20.Цитологические характеристики и клиническое значение исследования бластов в крови и препарате костного мозга.
- •25.Анемия хронических заболеваний. Этиология, патогенез, диагностика.
- •31.Стадии созревания мегакариоцитов, морфологические и иммунофенотипические характеристики. Структура и функция рецепторов тромбоцитов, роль арахидоновой кислоты, простациклин, тромбоксан.
- •33.Клиническое исследование мочи. Возможности визуальной колориметрии мочи в сравнении со стандартным клиническим исследованием.
- •3. Анализ мочи по Нечипоренко Процедура анализа :
- •4.1. Активированное парциальное (частичное) тромбопластиновое время (аптв)
- •4.2. Протромбиновое время
- •4.3. Тромбиновое время
- •51 . Ионометрия. Ионоселективные электроды. Кислотность среды и ее измерение. Индикаторы.
- •53.Нарушения обмена калия. Причины, методы диагностики. Гипокалиемия.
- •Диагностика
- •63.Диагностика сахарного диабета. Значение определения гликозилированного гемоглобина.
- •Лабораторные исследования : 1.Исследование уровня глюкозы в крови натощак Нормальным считается уровень глюкозы в пределах 3,5-5,5 ммоль/л.
- •6.Исследование гликированного гемоглобина
- •7.Исследование уровня фруктозамина в крови
- •8.Исследование липидов в крови
- •9.Исследование креатинина и мочевины
- •10 .Определение белка в моче
- •11.Исследование на кетоновые тела
- •Изменения фракции α2-глобулинов.
- •Изменения фракции β-глобулинов.
- •Изменения фракции γ-глобулинов.
- •Метод – колориметрический электрофорез Показания к назначению анализа - белковые фракции:
- •Лабораторная диагностика
- •2.Функциональная геномика
- •3.Сравнительная геномика
- •1.Обнаружение биомаркеров биологических процессов
- •2.Применения в медицине
- •3.Уточнение аннотации генома
- •4.Сравнительная протеомика
- •Основные методы Масс-спектрометрия
Лабораторная диагностика
КФ (клубочковая фильтрация) менее 20 мл/мин на 1,73 м² (проба Реберга)
креатинин сыворотки более 0,132 ммоль/л
мочевина более 8,3 ммоль/л
определение максимальной относительной плотности мочи (по Зимницкому)
Клиническое значение определения креатинина в крови Методы : 1.Колориметрические 1) Реакция Яффе В щелочной среде пикриновая кислота взаимодействует с креатинином с образованием оранжево-красной окраски (реакция Яффе-образование таутомера пикрата креатинина), которую измеряют фотометрически.
Определение в сыворотке крови проводят после депротеинизирования, в моче — после разведения водой. Определение не совсем специфично, интерферируют вещества с активной метиленовой группой и некоторые восстанавливающие вещества, например глюкоза, ацетон, ацетоуксусная и пировиноградная кислоты.
Содержание креатинина сыворотки крови:
мужчины — 61—115 мкмоль/л или 0,061—0,115 ммоль/л;
женщины — 53—97 мкмоль/л или 0,053—0,097 ммоль/л.
Мочу перед анализом разводят дистиллированной водой в соотношении 1:100 (результат умножают на 50).
2) основанные на реакции креатинина с 3,5‑динитробензойной кислотой — окраска мало стабильна и метод применяется редко. 3) с ортонитробензальдегидом, базируется на превращении креатинина в метил‑гуанидин. Метод весьма специфичен, но трудоемок и длителен в исполнении. 4)с α‑нафтолом — в основе лежит реакция Сакагучи на аргинин: гуанидиновая группировка аргинина окисляется гипобромитом и аминокислота конденсируется с α‑нафтолом. 2. Ферментативные 1) с ферментом креатинкиназой — точен, но требует специальной аппаратуры.
2)c использованием ферментов пируваткиназы, лактатдегидрогеназы — эти методы неспецифичны и дорогостоящи. Креатинин выводится из крови почками и относится к так называемым «беспороговым» веществам. В почечных клубочках он свободно фильтруется и, не подвергаясь обратному всасыванию или дополнительной секреции в канальцах, полностью выводится из организма с мочой. Поэтому увеличение уровня креатинина в сыворотке крови указывает на уменьшение уровня почечной фильтрации (снижении функции почек). Подготовка к исследованию: Взятие крови натощак. Материал для исследования "Креатинин в крови": Сыворотка крови. Повышение значений креатинина
Острые или хронические нарушения функции почек любой этиологии (заболевание собственно почек, нарушение перфузии почек, обтурация мочевых путей).
Причины фотометрической оценки уровня креатинина по «конечной точке».
 Реакция,
сопровождающаяся изменением
фотометрического сигнала, развивается
за некоторый период времени и достигает
определенного конечного состояния, так
называемой конечной точки. Изменение
сигнала как функция времени показано
на рисунке. При измерении по конечной
точке уровень сигнала соответствует
количеству продуктов реакции в
инкубационной среде после фиксированного
времени инкубации. Поглощение измеряется
после окончании реакции при стабильном
уровне сигнала.
Реакция,
сопровождающаяся изменением
фотометрического сигнала, развивается
за некоторый период времени и достигает
определенного конечного состояния, так
называемой конечной точки. Изменение
сигнала как функция времени показано
на рисунке. При измерении по конечной
точке уровень сигнала соответствует
количеству продуктов реакции в
инкубационной среде после фиксированного
времени инкубации. Поглощение измеряется
после окончании реакции при стабильном
уровне сигнала.
При работе с одноканальным фотометром измерение сопровождается значительной систематической ошибкой, связанной с влиянием на конечный результат рабочего реактива, отражением света от стенок кюветы и др. Для исключения влияния этих факторов используют измерение относительно бланка (холостой пробы). Как правило, бланк определяется по рабочему реактиву, т.е. готовому к работе реактиву перед измерением пробы. Оптическая плотность пробы рассчитывается: Dпробы=Dк.точки-Dбланка
66.Нарушения обмена пуринов. Подагра, хронический уратный интерстициальный нефрит Пуриновый обмен — совокупность процессов синтеза и распада пуриновых нуклеотидов. Нарушения обмена пуринов и пиримидинов, связанно со многими наследственными заболеваниями, например, синдром Леша-Найхана и подагра . Обмен пуринов и пиримидинов в организме состоит из трех основных путей – синтеза, катаболизма и взаимопревращений нуклеозидов и нуклеотидов. Генетически обусловленные дефекты ферментов, принимающих участие в этих процессах, могут приводить к развитию заболеваний. Патогенез данных состояний связан с накоплением в клетках и биологических жидкостях избыточного количества азотистых оснований и их метаболитов, которые могут быть токсичными и способными повреждать генетический материал и функцию клеток. Основные лабораторные признаки данных заболеваний – это изменение содержания пуринов и пиримидинов в биологических жидкостях. Подагра моногенное по происхождению заболевание, которое характеризуется отложением в различных тканях организма кристаллов уратов в формемоноурата натрия или мочевой кислоты. В основе возникновения лежит накопление мочевой кислоты и уменьшение её выведения почками, что приводит к повышению концентрации последней в крови (гиперурикемия). Клинически подагра проявляется рецидивирующим острым артритом и образованием подагрических узлов — тофусов. Чаще заболевание встречается у мужчин, однако в последнее время возрастает распространённость заболевания среди женщин, с возрастом распространённость подагры увеличивается. Для лечения используются препараты, воздействующие на патогенетический механизм заболевания, а также препараты для симптоматического лечения. Этиология : повышенное поступление в организм пуриновых оснований, например, при употреблении большого количества красного мяса (особенно субпродуктов увеличение катаболизма пуриновых нуклеотидов (например, при противоопухолевой терапии; массивном апоптозе у людей с аутоиммунными болезнями);
торможение выведения мочевой кислоты с мочой (например, при почечной недостаточности);
повышенный синтез мочевой кислоты при одновременном снижении выведения её из организма (например, при злоупотреблении алкоголем, шоковых состояниях, гликогенозе с недостаточностью глюкозо-6-фосфатазы); Патогенез В основе патогенеза заболевания находится повышение уровня мочевой кислоты в крови. Выделяют минимум три основных элемента возникновения подагры:
накопление мочекислых соединений в организме;
отложение данных соединений в органах и тканях;
развитие острых приступов воспаления в данных местах поражения, образования подагрических гранулем и подагрических «шишек» — тофусов, обычно вокруг суставов.
Течение заболевания : Полная естественная эволюция подагры проходит четыре стадии:
бессимптомная гиперурикемия;
острый подагрический артрит;
межкритический период;
хронические подагрические отложения в суставах.
Нефролитиаз может развиться в любой стадии, кроме первой. Наблюдается постоянно повышенная концентрация мочевой кислоты в плазме крови и в моче; воспаление суставов по типу моноартритов, что сопровождается сильной болью и лихорадкой; уролитиаз и рецидивирующие пиелонефриты, завершающиеся нефросклерозом и почечной недостаточностью. Диагностика I. Наличие характерных кристаллических уратов в суставной жидкости.
II. Наличие тофусов (доказанных), содержащих кристаллические ураты, подтвержденные химически или поляризационной микроскопией.
III. Наличие как минимум 6 из 12 ниже представленных признаков:
более чем одна острая атака артрита в анамнезе;
максимум воспаления сустава уже в первые сутки;
моноартикулярный характер артрита;
гиперемия кожи над пораженным суставом;
припухание или боль, локализованные в I плюсне-фаланговом суставе;
одностороннее поражение суставов свода стопы;
узелковые образования, напоминающие тофусы;
гиперурикемия;
одностороннее поражение I плюснефалангового сустава;
асимметричное припухание пораженного сустава;
обнаружение на рентгенограммах субкортикальных кист без эрозий;
отсутствие флоры в суставной жидкости.
Лабораторная диагностика : 1. Определение сывороточного уровня мочевой кислоты 2. Биохимичиский анализ крови с пределением липидного спектра, печёночных ферментов, креатинина, мочевины и исследование в плазме крови глюкозы. 3. Исследование синовиальной жидкости на обнаружение кристаллов моноурата натрия 4. анализ мочи по Зимницкому (суточное выделение мочи) 5. анализ мочи, показывающий повышенное содержание солей мочевой кислоты в осадке 6. определение СКФ (скорости клубочковой фильтрации) для уточнения функциональной способности почек Лечение : соблюдение диеты;
противовоспалительные препараты;
противоподагрические препараты;
местное лечение; народные средства. Хронический уратный интерстициальный нефрит хроническое поражение тубуло - интерстициальной ткани почек, обусловленное воздействием инфекционных, метаболических, иммунных, токсических факторов, в клинической картине которого доминирует нарушение канальцевых функций. Классификация по патогенезу : •• Первичный ХИН — первично возникающий в почке •• Вторичный ХИН — нефрит выступает одним из проявлений общего или системного заболевания По этиологическим факторам выделяют следующие нозологические виды болезни: 1.Уратная; 2.Хроническая тубулоинтерстициальная; 3.Острая мочекислая; 4.Бактериальная; 5.Идиопатическая. Этиология • ЛС (бета-лактамы, сульфаниламиды , тиазиды ) • Метаболические нарушения: гиперурикемия, гиперкальциемия • Иммунные нарушения: СКВ, синдром Шёгрена, хронический активный гепатит, тиреоидит, отторжение почечного трансплантата • Тяжёлые металлы: золото, свинец, ртуть, литий и др. • Инфекции, например хронический пиелонефрит • Злокачественные новообразования: миеломная болезнь, болезнь лёгких цепей • Амилоидоз • Дисплазии почек: поликистоз, синдром Олпорта и др. • Обструкции мочевых путей. Диагностика : • В крови — анемия, ацидоз, повышение СОЭ (чаще при иммунном или инфекционном генезе), повышенное содержание креатинина, мочевины • В моче — увеличение объёма (полиурия), гипостенурия, водно - электролитные нарушения, щелочная реакция мочи, тубулярная протеинурия, глюкозурия, эритроцитурия, лейкоцитурия • Гиперурикемия (при подагрической нефропатии). С диагностической целью очень важно обнаружить в моче элементы некротизированных почечных сосочков после приступов почечной колики. Важное диагностическое значение имеет наличие рентгенологических признаков папиллярного некроза. Понятие подагрическая нефропатия включает различные формы поражения почек, вызванные нарушениями пуринового обмена и другими метаболическими и сосудистыми изменениями, свойственными подагре. Подагрическая нефропатия делится на следующие клинические формы: 1.уратный нефролитиаз; 2.хронический тубулоинтерстициальный нефрит; 3.острую мочекислую нефропатию. Уратный нефрит развивается на фоне нарушения обмена мочевой кислоты. Для патологии характерно двухстороннее поражение почек, образование камней мочевыводящего тракта. Лечение • Отмена или снижение дозы ЛС, замена альтернативным препаратом • В большинстве случаев диета, ощелачивающая мочу • Достаточный объём жидкости для достижения полиурии • При иммунном ХИН — ГК • Коррекция водно - электролитных нарушений и КЩР • Лечение артериальной гипертензии • Лечение анемии • Лечение ОПН. 67.Нефелометрический и турбидиметрический анализ в клинической практике. Отличие от других методов фотометрии. Нефелометрия – это метод количественного анализа вещества, который базируется на измерении интенсивности светового потока, рассеянного взвешенными частицами мутной среды. Данный метод применяется не только в медицине, но и в геологии, минералогии.
В медицинских целях нефелометрия применяется для проведения анализа воды, некоторых продуктов питания, форменных элементов крови, тканей глаза и др. Очень широко данный метод используется в фармацевтике – для анализа суспензий, эмульсий, экстрактов, растворов.
Для проведения нефелометрии используют специальные приборы – нефелометры. Суть метода нефелометрии состоит в том, что с помощью прибора перпендикулярно световому потоку, который проходит через исследуемое вещество, наблюдают рассеивание света. При этом интенсивность пучка света, проходящего через исследуемую мутную среду, снижается за счет рассеивания и поглощения света взвешенными частицами. Иногда требуется удержать твердые частиц во взвешенном состоянии, это достигается при помощи различным веществ-стабилизаторов, самый простой из них – желатин. Есть и другой метод, работающий по тому же принципу – турбидиметрия – измеряется ослабление интенсивности потока света при его прохождении через мутную жидкость (суспензию, взвесь, эмульсию). Основным достоинством нефелометрических и турбидиметрических методов является их высокая чувствительность, что особенно ценно по отношению к элементам или ионам, для которых отсутствуют цветные реакции. В практике широко применяется, например, нефелометрическое определение хлорида и сульфата в природных водах и аналогичных объектах. По точности турбидиметрия и нефелометрия уступают фотометрическим методам, что связано, главным образом, с трудностями получения суспензий, обладающих одинаковыми размерами частиц, стабильностью во времени и т. д. К обычным сравнительно небольшим погрешностям фотометрического определения добавляются ошибки, связанные с недостаточной воспроизводимостью химико-аналитических свойств суспензий. Нефелометрический метод : 1. Подсчет эритроцитов 2. Определение специфических белков в сыворотке крови Турбидиметрические методы : К турбидиметрическим методам относятся: 1.определение белка с сульфосалициловой кислотой (ССК), 2.определение белка с трихлоруксусной кислотой (ТХУ), 3.определение белка с бензетоний хлоридом. 4. анализ иммуноглобулинов А , G , М
Турбидиметрические методы основаны на снижении растворимости белков мочи вследствие образования суспензии взвешенных частиц под воздействием преципитирующих агентов. О содержании белка в исследуемой пробе судят либо по интенсивности светорассеяния, определяемого числом светорассеивающих частиц (нефелометрический метод анализа), либо по ослаблению светового потока образовавшейся суспензией (турбидиметрический метод анализа).
Величина светорассеяния в преципитационных методах обнаружения белка в моче зависит от множества факторов: скорости смешивания реактивов, температуры реакционной смеси, значения pH среды, присутствия посторонних соединений, способов фотометрии. Тщательное соблюдение условий реакции способствует образованию стабильной суспензии с постоянным размером взвешенных частиц и получению относительно воспроизводимых результатов.
Некоторые лекарственные препараты влияют на результаты турбидиметрических методов определения белка в моче, приводя к так называемым "ложноположительным", либо "ложноотрицательным" результатам. К ним относятся некоторые антибиотики (бензилпенициллин, клоксациллин и др.), рентгеноконтрастирующие йодсодержащие вещества, сульфаниламидные препараты.
68.Иммунологические методы диагностики. Физико-химические закономерности взаимодействия антиген-антитело. Принципы и методы иммуноферментного анализа. Получение иммунных антисывороток. Метки в иммуноанализе. Иммунологические методы исследования — диагностические методы исследования, основанные на специфическом взаимодействии антигенов и антител. Широко используются для лабораторной диагностикиинфекционных и паразитарных болезней, определения групп крови, тканевых и опухолевых антигенов,видовой принадлежности белка, распознавания аллергии и аутоиммунных болезней, беременности,гормональных нарушений, а также в научно-исследовательской работе. Они включают серологические реакции, к которым относят обычно реакции прямого воздействияантигенов и антител сыворотки крови in vitro. Условно все методы можно разделить на две большие группы: прямые методы выявления патогена, когда лаборатория стремится выделить фрагмент возбудителя (наследственный материал или антигены) или с помощью культурального посева обнаружить патогены на искусственных питательных средах, и непрямые. К прямым методам диагностики следует отнести бактериологический анализ, микроскопию и иммунофлуоресценцию и различные методы ДНК-диагностики (в первую очередь — амплификационные и гибридизационные технологии). К непрямым методам относятся гистология, инструментальный анализ и, конечно, серологический анализ, то есть анализ гуморального ответа организма на присутствие патогена. Серологические реакции :
1.Реакция агглютинации (РА) -Реакция прямой агглютинации
-Реакция непрямой (пассивной) агглютинации
2.Реакция связывания комплемента (РСК) 3.Реакция лизиса
4.Реакция иммунофлюоресценции 5.Иммуноферментный анализ (ИФА) 6.Радиоиммунологический анализ 7.Иммуноблотинг 8.Гибридизационный анализ (ГА) 9.Полимеразная цепная реакция (ПЦР) Серологические методы исследования основаны на обнаружение феномена взаимодействия АГ с АТ . Их применяют для поиска АТ в сыворотке крови больного или определения их нарастания в динамике , а так же для изучения антигенной структуры микроорганизмов и их идентификации .
Физико-химические закономерности взаимодействия антиген-антитело Антитела, образуемые в ответ на введение в организм антигенов, специфически взаимодействуют с этими антигенами. В основе первичного взаимодействия лежат общие принципы любой бимолекулярной реакции. Так как в данном случае продуктом реакции является комплекс антиген-антитело, иммунная реакция является обратимой и описывается теми же кинетическими и термодинамическими параметрами, что и любой процесс комплексообразования. Степень соответствия между антигенной детерминантой и антигенсвязывающей областью активного центра антитела (иммунологическая специфичность) определяется химической и пространственной комплементарностью, которая обусловлена, с одной стороны, взаимодействием электронных облаков реагирующих химических групп, с другой – стерическими силами отталкивания. С количественной стороны специфичность взаимодействия антиген-антитело характеризуется через аффинность антител или равновесную константу образования иммунокомплекса (Ка, размерность л/моль) или его распада (Кд = 1/Ka, размерность моль/л). Обычный диапазон изменения аффинности антител (Ка) составляет 105 – 1011 М-1. максимальные значения констант связывания характерны для антигенов, обладающих ярко выраженными гидрофобными свойствами или же взаимодействующих с активным центром антитела достаточно большой областью молекулы. Так как молекула антитела имеет два и более антигенсвязывающих центров, и кроме того, способна взаимодействовать с несколькими антигенными детерминантами молекулы антигена, реально существующий процесс взаимодействия поливалентного антитела с поливалентным антигеном является более сложным и характеризуется функциональной аффинностью или авидностью. С количественной точки зрения бивалентные взаимодействия являются почти на три порядка более прочными, чем моновалентные.
Аг
+ Ат АгАт
Образование
комплекса антиген-антитело является
обратимым процессом, т.е. равно- весная
константа связывания (аффинности)
данного комплекса определяется отношением
константы скорости ассоциации k1 к
константе скорости диссоциации комплекса
k-1.
Принципы
и методы иммуноферментного
анализа
 Основной
принцып ИФА.
Основной
принцып ИФА.
1) Для выявления антигенов. 2) Для выявления антител.
Метод основан на специфическом связывании антитела с антигеном, при этом один из компонентов конъюгирован с ферментом, в результатереакции с соответствующим хромогенным субстратом образовывается окрашенный продукт, количество которого можно определить спектрофотометрически Любой вариант ИФА содержит 3 обязательные стадии:
1. стадия узнавания тестируемого соединения специфическим к нему антителом, что ведет к образованию иммунного комплекса;
2. стадия формирования связи конъюгата с иммунным комплексом или со свободными местами связывания;
3. стадия превращения ферментной метки в регистрируемый сигнал.
Классификация ИФА.
В основу классификации методов ИФА положено несколько подходов:
1. По типу реагентов, присутствующих на первой стадии ИФА, различают конкурентный и неконкурентный методы.
А) В конкурентном ИФА на первой стадии в системе присутствуют одновременно анализируемое соединение и его аналог, меченный ферментном и конкурирующий за центры специфического связывания с ним.
Б) Для неконкурентных методов характерно присутствие в системе на первой стадии только анализируемого соединения и специфичных к нему центров связывания.
2. Все методы ИФА делются на гомогенные и гетерогенные.
Если все три стадии ИФА проходят в растворе и между основными стадиями нет дополнительных этапов разделения образовавшихся иммунных комплексов от непрореагировавших компонентов, метод относится к группе гомогенных.
В основе гомогенного ИФА, применяемого, как правило, для определения низкомолекулярных субстанций, лежит ингибирования активности фермента при его соединении с антигеном или антителом. Активность фермента восстанавливается в результате реакции антиген-антитело.
При связывании антитела с антигеном, содержащим ферментную метку, происходит ингибирование активности фермента на 95% по отношению к высокомолекулярному субстрату, что обусловлено стерическим исключением субстрата из активного центра фермента. По мере увеличения концентрации антигена связывается все больше антител и сохраняется все больше свободных конъюгатов антиген-фермент, способных гидролизовать высокомолекулярный субстрат. Анализ проводят очень быстро, для одного определения требуется 1 минута. Чувствительность метода достаточно высока. С его помощью можно определить вещество на уровне пикомолей.
Для гетерогенных методом характерно проведение анализа в двухфазной системе с участием твердой фазы – носителя, и обязательная стадия разделения иммунных комплексов от непрореагировавших компонентов (отмывка), которые находятся в разных фазах (образовавшиеся иммунные комплексы находятся на твердой фазе, а непрореагировавшие комплексы – в растворе). Гетерогенные методы, в которых формирование иммунных комплексов на первой стадии протекает на твердой фазе, называют твердофазными методами.
Методы относятся к гомогенно- гетерогенным, если 1 стадия – образование специфических комплексов происходит в растворе, а затем для разделения компонентов используют твердую фазу с иммобилизированным реагентом. В настоящее время разработаны различные варианты твердофазного иммуноферментного анализа: 1. “Сэндвич”-метод. Общая схема проведения метода заключается в следующем. На твердой фазе адсорбированы антитела к исследуемому антигену. После инкубации исследуемого материала и образования комплекса «антитело — антиген» проводится удаление несвязавшихся компонентов, добавляется конъюгат, т.е. антитела к искомо- му антигену, меченые ферментом. По завершении инкубации, с последующим удале- нием непрореагировавшего коньюгата промывкой, образуется комплекс, в котором антиген как бы заключен между двумя слоями антител. Наличие меченных ферментом антител определяется при помощи соответствующего субстрата. “Сэндвич”-метод ис- пользуется для выявления HBsAg, HBeAg, антигена вируса гепатита А 2. Непрямой ИФА. На твердой фазе иммобилизуют антиген, после инкубации исследу- емого материала и удаления несвязавшихся компонентов добавляют меченые фермен- том антитела к иммуноглобулинам человека класса IgG, которые взаимодействуют с Fc-фрагментом к IgG. После проведения субстрат-ферментативной реакции проводят учет полученных результатов. При наличии антител уровень оптической плотности прошедшей реакции превосходит показатели отрицательных образцов. Этот метод применяется для определения антител к вирусу гепатита С 3. Конкурентный метод. К антигену, иммобилизованному на твердой фазе одновре- менно добавляют исследуемый материал и конъюгат. При проведении реакции мече-ные и исследуемые антитела конкурируют за активные центры антигена, иммобилизо- ванного на твердой фазе. После завершения инкубации и удаления не прореагировав- ших компонентов проводится ферментативная реакция, результаты которой обратно пропорциональны количеству антител в исследуемом образце. 4. Ингибирующий ИФА. На полистироловом шарике адсорбирован стандартный АГ , после инкубации с исследуемым материалом и удаления непрореагировавших компо- нентов добавляется АГ, меченный ферментом, который взаимодействует со свобод- ными центрами связывания антител , провзаимодействовавшими с антигеном, сорби- рованным на твердой фазе. При наличии антител в исследуемой пробе уровень опти- ческой плотности прошедшей реакции превосходит показатели отрицательных кон- трольных образцов. 5. Прямой ИФА. На первом этапе реакции исследуемый образец фиксируют на твердой фазе. Затем к нему добавляют конъюгат. После удаления непрореагировавших компо- нентов реакции проводится ферментативная реакция, интенсивность которой прямо пропорциональна содержанию исследуемых антигенов в образце и вообще говорит об их наличии в исследуемом материале
Получение иммунных антисывороток
Для получения иммунной антисыворотки для начала выделяют нужный АГ и подсаживаю животному . По окончанию иммунизации животного у него берут кровь и получают из нее после свертывания сыворотку. С этой целью кровь, собранную в стерильную посуду, сначала помещают в термостат при 37° на 4—6 часов, для ускорения свертывания, затем в ледник на сутки. Полученную прозрачную сыворотку осторожно отсасывают в стерильную посуду, прибавляют к ней для консервирования 0,5% хлороформа или других веществ. Лечебные сыворотки выдерживают на леднике в течение 4—6 месяцев. За это время происходит просветление сыворотки вследствие выпадения нестойких белков, снижаются ее токсические для человека свойства и устанавливается более или менее устойчивый титр антител. Затем сыворотки титруются на содержание антител, проверяются на стерильность и на безвредность для животных и расфасовываются по ампулам. Сыворотки сохраняются на холоду и в темноте; срок годности их считается 1 год; сыворотки помутневшие не допускаются к употреблению.
Адъюванты - это соединения, которые при введении в организм вызывают неспецифическое усиление иммунного ответа и тем самым повышают способность организма реагировать на любой иммуноген. Адъювантными свойствами обладают масла, липосомы, клетки бактерий, полимеры и др. Адъюванты, введенные в организм вместе с иммуногеном, выполняют две функции. Во-первых, они способствуют более медленному освобождению иммуногена из участков инъекции, что замедляет его поступление в кровоток, в результате чего увеличивается вероятность встречи иммуногена с иммунокомпетентными клетками, а также резко снижается его токсичность. Во-вторых, адъюванты вызывают сильное воспаление в месте введения иммуногена, при этом активируется фагоцитоз и стимулируется местная циркуляция лимфоцитов, происходит неспецифическая стимуляция иммунокомпетентных клеток. Для усиления такой неспецифической иммуностимуляции в состав адъюваитов дополнительно включают препарат бактериальных клеток рода Bacillus pertussium. Использование в иммунизации адъюванта снижает возможность появления толерантности, позволяет расширить диапазон вводимого иммуногена от 50 до 200 мкг на одну инъекцию. В настоящее время для целей иммунизации широко применяется коммерческий препарат полного адъюванта Фрейнда, в состав которого входят смесь минеральных масел, эмульгатор и убитые микобактерии. Препарат адъюванта можно приготовить в лабораторных условиях, тщательно смешав три части минерального масла, одну часть безводного ланолина, четыре части 0,15 M К-фосфатного буфера и препарат микобактерии до конечной концентрации 10 мг/мл так, чтобы частички микобактерии равномерно распределились по всему объему. Адъювант смешивают с водным раствором иммуногена в отношении 2: 1 до образования нерасслаивающейся эмульсии, в которой водный раствор иммуногена находится в мицеллах. Метки в иммуноанализе 1. Радионуклид используется при радиоиммунном анализе (РИА). 2. Ферменты, катализирующие превращение бесцветного субстрата в цветной или флюоресцирующий продукт. В данном случае исследование называют иммуноферментным анализом (ИФА), его разновидность - анализ иммуноферментно-флюоресцентный. - Пероксидаза из корней хрена - β-Галактозидаза -Щелочная фосфатаза -Уреаза 3. Флюоресцирующие, люминесцирующие вещества и др.
69.Методы лабораторной диагностики воспаления. Клетки, вовлеченные в воспалительные процессы (нейтрофилы, моноциты, макрофаги, эндотелиальные клетки). Цитокины. Аутовоспалительные заболевания. Помимо общепринятых клинических методов диагностики (клинический анилиз крови и др.), для лабораторной диагностики воспалительного процесса используется широкий спектр разнообразных методов: бактериоскопический, бактериологический, реакция иммунофлуоресценции (РИФ), молекулярно-биологические методы (полимеразная цепная реакция — ПЦР), иммунофер-ментный анализ (ИФА).
Следует помнить, что методы бывают скрининговыми и диагностическими. Скрининговые методы позволяют только предположить наличие инфекционного процесса, но для установления окончательного диагноза необходимо проведение диагностического теста. К скриниговым методам относятся: ИФА, определяющий концентрацию специфических антител или ИЛ воспаления, и в некоторых случаях (хламидийная или вирусная инфекция) — бактериоскопический метод. К диагностическим методам относятся: бактериологический метод и в некоторых случаях — бактериоскопический (для определения острой гонореи, кандидоза, трихомоноза, БВ), РИФ, ПЦР (для определения хлами-диоза, гонореи, вирусной инфекции), ИФА, позволяющий выявить непосредственно антиген возбудителя.
1. Бактериоскопическое исследование Приготовление мазка и его окрашивание . Часто используеться в гинекологии для выявления восполительных процессов , инфекционных заболеваний и ЗППП. 2. Бактериологические методы Бактериологический метод по-прежнему является «золотым стандартом» в диагностике. С этим методом сравнивают специфичность и чувствительность всех других методов лабораторной диагностики. Он основан на способности микроорганизмов размножаться на искусственных средах и позволяет не только выявить возбудитель, определить его концентрацию, но и выяснить чувствительность данного штамма к антибактериальным препаратам. Чувствительность к антибиотикам определяется методом диффузионных дисков. Для этого предполагаемый инфекционный агент, выделенный в чистую культуру, засевают газоном на чашку с питательной средой и накладывают поверх посева диски, пропитанные соответствующими антибиотиками. 3. Реакция иммунофлюоресценции РИФ нашла широкое применение для выявления хламидий и вируса простого герпеса. Однако этот метод пригоден только для обнаружения активных форм вируса и острого хламидиоза. При персистирующем хроническом хлами-диозе или при неактивном вирусе анализ, сделанный этим методом, не информативен. Существуют два типа РИФ - прямая (ПИФ) и непрямая (НИФ) иммунолюминесценция. В первом случае индикаторная метка, которой служит чаще всего изотиоционат флюоресцеина (ФИТЦ), пришивается к антителам против антигена клеточной стенки (липополисахарида — ЛИС или белка) возбудителя, во втором реакция идет «сэндвич-методом». При использовании НИФ на исследуемый материал наслаивают антитела против возбудителя, полученные в основном путем иммунизации животных, а затем обрабатывают антителами, меченными ФИТЦ, против соответствующего вида животных. После проведения реакции антиген—антитело инфекционный агент выявляется с помощью люминесцентной микроскопии. ФИТЦ обеспечивает инфекционному агенту яркое яблочно-зеленое свечение под микроскопом. Для контрастирования в набор входит синька Эванса или родамин, окрашивающий эпителиальные клетки и лейкоциты в красный цвет. 4.ПЦР ПЦР - это метод умножения числа копий нуклеиновых кислот (амплификация) in vitro. Перед проведением реакции из биологического материала выделяют ДНК или РНК возбудителя инфекционного заболевания или ДНК генома клеток человека. Полимеразная цепная реакция проводится с использованием двух или более олигонуклеотидных праймеров («затравки»), фланкирующих участок ДНК (РНК), специфический для определяемого участка генома. Процесс амплификации заключается в повторяющихся циклах температурной денатурации ДНК, отжига праймеров с комплементарными последовательностями и последующей достройки полинуклеотидных цепей с этих праймеров ДНК-полимеразой. Праймеры ориентированы таким образом, что синтез с помощью полимеразы протекает только между ними, удваивая количество копий этого участка ДНК в каждом последующем цикле. Как правило, проводится не менее 30 последовательных циклов реакции. Амплифицированный учасок именуют «ампликоном». В результате реакции происходит экспоненциальное увеличение количества копий специфического фрагмента. 5. ИФА ИФА основан на взаимодействии специфического антигена с антителом с последующим выявлением образовавшихся в результате этой реакции комплексов с помощью цветной биохимической реакции. В качестве выявляющей метки используют пероксидазу хрена или З-З'-диаминобензидинтетрагидро-хлорид. Для учета результатов лаборатория должна быть оснащена специальным прибором — ридером.
ИФА может быть диагностическим (с выявлением антигена) или скринин-говым (определение специфических антител). Диагностические ИФА разработаны только для выявления Chlamydia trachomatis. Выявление специфических антител проводится при вирусных и хламидийной инфекциях.
Выявление антигена хламидий проводят чаще методом твердофазного ИФА. Материал для этого исследования забирают тампоном в специальные транспортные пробирки, которые поставляются производителями наборов, и доставляют в лабораторию. Клетки восполения
В воспалительном процессе участвуют все клетки крови (нейтрофилы, базофилы, эозинофилы, моноциты, тромбоциты и даже эритроциты), эндотелиальные клетки, клетки соединительной ткани (лаброциты, макрофаги, фибробласты), вследствие чего образуется та или иная клеточная кооперация, элементы которой взаимодействуют друг с другом. Основными источниками клеточных медиаторов являются:
1. Нейтрофилы, которые выделяют катионные белки, стимулируют высвобождение биогенных аминов из тромбоцитов и тучных клеток, содержат ингибитор высвобождения гистамина и гистаминазу. Протеазы нейтрофилов участвуют в образовании кининов и активных фрагментов комплемента (С3а, С3Ь). Нейтрофилы образуют простагландин (PG) E2 и другие эйкозаноиды. Ферменты нейтрофилов активируют как свертывание крови, так и фибринолиз.
2. Макрофаги выделяют ангиотензин-конвертазу, которая инактивирует брадикинин, превращает ангиотензин-I в ангиотензин-П. Они синтезируют PGE2, а также тромбоксаны и лейкотриены (LT). Поскольку PGE2 препятствует высвобождению клеточных медиаторов воспаления и подавляет агрегацию тромбоцитов, макрофаги, помимо провоспалительной, обладают и противовоспалительной функцией. Макрофаги синтезируют различные компоненты комплемента, обладают свертывающей и фибринолитической активностью.
3. Эозинофилы служат отрицательными модуляторами воспаления. Они содержат гистаминазу, кининазу, ферменты, расщепляющие лейкотриены С и D (лизофосфалипазу, арилсульфатазу В, фосфолипазу D), главный щелочной белок, осуществляющий цитотоксическую функцию и нейтрализующий гепарин. Таким образом, ферменты эозинофилов нейтрализуют продукты тучных клеток, способствуют уничтожению клеточных остатков. Эозинофилы фагоцитируют секретируемые тучными клетками гранулы и подавляют высвобождение гистамина. Особый интерес представляет присутствие в эозинофилах лизофосфолипазы. Ее субстратом являются частично деградированные фосфолипиды, содержащиеся в мембранах погибших клеток. Высвобождая из фосфолипидов свободные жирные кислоты, лизофосфолипаза способствует образованию арахидоновой кислоты.
|
|
4. Тучные клетки и базофилы выделяют гистамин и серотонин, гепарин, факторы хемотаксиса нейтрофилов и эозинофилов, фактор активации тромбоцитов, протеолитические ферменты, они продуцируют пероксидазу, супероксид и пероксид водорода, а также протеазу, превращающую кининоген в кинин.
5. Тромбоциты секретируют факторы роста и свертывания, вазоактивные амины и липиды, нейтральные и кислые гидролазы.
Производные комплемента (рис. 10-5) являются наиболее важными из гуморальных медиаторов воспаления. Среди почти 20 различных белков, образующихся при активации комплемента, непосредственное отношение к воспалению имеют его фрагменты С5а, С3а, С3Ь и комплекс С5Ь-С9:
• С5а и С3а являются медиаторами острого воспаления и анафилатоксинами (т.е. либераторами гистамина из тучных клеток), таким образом, они повышают проницаемость капилляров как прямо, так и опосредованно через гистамин (рис. 10-6);
• С5а des Arg и С3а образуются из С5а в плазме и тканевой жидкости под влиянием карбоксипептидазы N и повышают проницаемость посткапиллярных венул. Эффект С5а des Arg
6.Кинины - вазоактивные пептиды, образующиеся из кининогенов (а2-глобулинов) под влиянием калликреинов в плазме (брадикинин) и в тканевой жидкости (каллидин). Пусковым фактором активации калликреин-кининовой системы является активация при повреждении ткани фактора Хагемана (XII), превращающего прекалликреины в калликреины. Фактор XII присутствует в крови и имеет сродство к отрицательно заряженным поверхностям. В жидкой фазе крови он спонтанно диссоциирует на два фрагмента: ХПа - ферментативно активный фрагмент и ХПб. ХIIa адсорбируется на поверхности чужеродного агента (флогогена), где стабилизируется . Активация фактора Хагемана запускает не только процесс кининообразования, но и свертывания крови и фибринолиза. При этом образуются такие медиаторы, как фибринопептиды и продукты деградации фибрина, которые являются мощными хематтрактантами.
7.Цитокины при
воспалении продуцируются главным
образом стимулированными моноцитами
и макрофагами (монокины), а также
нейтрофилами, лимфоцитами, эндотелиальными
и другими клетками. Цитокины повышают
сосудистую проницаемость (нейтрофилзависимым
путем), адгезию и эмиграцию лейкоцитов.
Наряду с провоспалительными свойствами
цитокины важны и для непосредственной
защиты организма, поскольку стимулируют
нейтрофилы и моноциты к умерщвлению,
поглощению и перевариванию внедрившихся
микроорганизмов, а также усиливают
фагоцитоз путем опсонизации патогенного
агента. Стимулируя раневое очищение,
пролиферацию и дифференцировку клеток,
цитокины усиливают репаративные
процессы. Наряду с этим они могут
опосредовать тканевую деструкцию
(деградацию хрящевого матрикса и
резорбцию кости) и, таким образом, играть
роль в патогенезе заболеваний
соединительной ткани, в частности
ревматоидного артрита. Действие цитокинов
вызывает также ряд метаболических
эффектов, лежащих в основе общих
проявлений воспаления - лихорадки,
сонливости, анорексии, изменения обмена
веществ, стимуляции гепатоцитов к
усиленному синтезу белков острой фазы,
активации системы крови и т.д. Цитокины
взаимодействуют между собой, с
простагландинами, нейропептидами и
другими медиаторами.
Аутовосполительные
заболевания
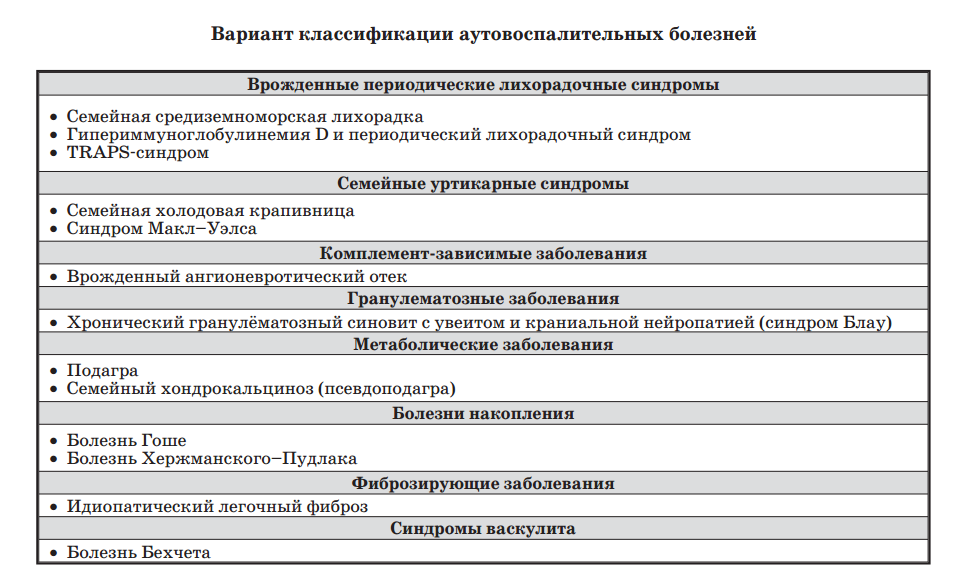
|
|
Семейная средиземноморская лихорадка это наследственное заболевание, характеризующееся рецидивирующими эпизодами лихорадки и перитонита, иногда с плевритом, кожными поражениями, артритом и очень редко перикардитом. Может развиться амилоидоз почек, который может вести к почечной недостаточности. ГиперIgD-синдром – синдром дефицита мевалонат киназы то редкое врожденное (возникшее внутриутробно и передающееся от родителей к детям) заболевание, характеризующееся периодическими приступами лихорадки (подъемом температуры тела до высоких цифр), не связанной с инфекционным процессом. Заболевание, как правило, манифестирует (начинается) на 1-ом году жизни. Приступ лихорадки длится от 3 до 7 дней, затем пациента может ничего не беспокоить в течение 4-6 недель. Эпизоды лихорадки сопровождаются симптомами воспаления: лимфоаденопатией (увеличением и болезненностью лимфатических узлов), кожными высыпаниями (макулами – пятнами, эритемой – сильно покрасневшей кожей, высыпаниями по типу крапивницы (высыпания похожи на волдыри, оставшиеся от ожога крапивой)), артритом (воспалением суставов), жалобами со стороны желудочно-кишечного тракта (тошнота, рвота, диарея (частый жидкий стул)). TRAPS-синдром – это врожденное (возникшее внутриутробно) заболевание, характеризующееся периодическими подъемами температуры тела до значительных цифр, болями в животе и миалгиями (болями в мышцах). Эти клинические симптомы обусловлены наличием генетической мутации (нарушения) в гене, который кодирует (записывает) рецепторы к фактору некроза (смерти) опухолей, а он, в свою очередь, вызывает воспаление в организме. Тип наследования TRAPS-синдрома – аутосомно-доминантный, то есть генетический дефект может быть унаследован от одного из родителей. Синдромом могут страдать как мужчины, так и женщины. Семейная холодовая крапивница редкая форма крапивницы, наследуемая по аутосомно-доминантному типу. Характерны пятнисто-папулезная сыпь и жжение, возникающие через 0,5 – 3 часа после действия холода. Возможны системные проявления лихорадка, озноб, боли в суставах, лейкоцитоз. Описана редкая форма заболевания, при которой крапивница возникает спустя 20 – 30 часов после действия холода. Поскольку высыпания при этом сопровождаются зудом и жжением, нередко ошибочно ставится диагноз хронической идиопатической крапивницы; Синдром Макс –Уелса это мутация в гене CIAS1 с развитием холодового аутовоспалительного синдрома. Является редким аутовоспалительным заболеванием наследственного характера Наследственный ангионевротический отёк (НАО) — редкое заболевание, связанное с количественной недостаточностью (тип НАО - 1) или недостаточной активностью (тип НАО - 2) C1-ингибитора (англ.)русск. системы комплемента человека, что приводит к неконтролируемым внутренним реакциям в крови и проявляется в виде отеков на теле. Чаще всего отеки возникают на руках, ногах, лице, в брюшной полости, а также в гортани. Пода́гра -это моногенное по происхождению заболевание, которое характеризуется отложением в различных тканях организма кристаллов уратов в форме моноурата натрия или мочевой кислоты. Псевдоподагра — острое воспалительное заболевание суставов, возникающее вследствие отложения кристаллов пирофосфата кальция (КПФК) в суставных тканях. Болезнь Гоше́ — наследственное заболевание, является самой распространённой излизосомных болезней накопления. Развивается в результате недостаточности фермента глюкоцереброзидазы, которая приводит к накоплению глюкоцереброзида во многих тканях, включая селезёнку, печень, почки, лёгкие, мозг и костный мозг. Болезнь Хержманского — Пудлака
— наследственное заболевание, характеризующееся нарушением структуры и функции тромбоцитов, а также альбинизмом (как правило, кожи и глаз) и отложением цероидоподобного пигмента в костном мозге Идиопатический легочный фиброз — заболевание, характеризующееся диффузным поражением лёгочного интерстиция с последующим развитием пневмосклероза и дыхательной недостаточности, гипертензии малого круга кровообращения и лёгочного сердца. Встречается относительно редко (ок. 7 — 10 случаев на 100 тыс. населения), в развитии этой формы большое значение имеют аутоиммунные нарушения (гиперчувствительность III-го типа, реакции иммунных комплексов). Характерны серозно-фибринозное пропитывание альвеолярных перегородок, накопление в альвеолах экссудата, богатого фибрином, макрофагами и особенно нейтрофилами, выраженное разрастание соединительной ткани и еёсклерозирование, гиалиновые мембраны в альвеолах. Лёгкие плотны, красно-бурого цвета с сетью сероватых полосок и очагами буллезной эмфиземы Болезнь Бехчета — системный васкулит неустановленной этиологии, характеризующийся преимущественным поражением слизистой оболочки глаз, полости рта, кожи и половых органов. Болезнь Бехчета в 2-3 раза чаще встречается у мужчин в возрасте 20-30 лет, хотя наблюдается и у детей.
70.Ревматоидный артрит . Клиническая картина, диагностика, лечение. Клиническое значение определения ревматоидного фактора. Антитела к циклическому цитруллинированному пептиду. Серонегативные полиартриты. Классификация. Клиническая картина, диагностика, лечение. Ревматоидный артрит— это системное заболевание соединительной ткани с преимущественным поражением мелких суставов по типу эрозивно-деструктивного полиартрита неясной этиологии со сложным аутоиммунным патогенезом. Этиология : Как и для большинства аутоиммунных заболеваний, здесь можно выделить 3 основных фактора (ревматологическая триада):
1. Генетическая предрасположенность
Наследственная склонность к аутоиммунным реакциям.
Чаще встречается у носителей определенного антигена класса MHC II: HLA — DR1, DR4
2. Инфекционный фактор Гипотетические триггеры ревматических заболеваний
Стрептококковая инфекция (возбудитель – бета-гемолический стрептококк)
3. Пусковой фактор (переохлаждение, гиперинсоляция, интоксикации, мутагенные медикаменты, эндокринопатии, стрессы и т. д.). Для женщин длительность кормления грудью снижает вероятность развития РА. Кормление грудью в течение 24 месяцев и дольше понижает риск развития РА вдвое Стадии : 1.Первая стадия характеризуется синовитом (выпот в сустав), который может быть острым, хроническим и под-острым.
2.Во второй стадии развивается продуктивно-деструктивный артрит, проходящий в своем формировании три фазы: экссудативно-пролиферативную, пролиферативно-деструктивную и деструктивно-склеротическую.
Возникают характерные изменения в суставе в виде выпота, утолщения синовиальной оболочки и разрастания соединительной ткани в суставе и вокруг него. 3.В третьей стадии происходит анкилозирование (сращение суставных концов костей между собой), которое начинается с фиброзного анкилоза — между суставными концами образуются соединительные перемычки, переходящие в костный анкилоз — перемычки из костной ткани, делающие невозможным движение в суставе. Течение ревматоидного артрита волнообразное: значительные улучшения через некоторое время могут сменяться обострениями. Симптомы : Скованность: уменьшается объем движений в суставах, как правило, это заметно после пробуждения и проходит позже в тот же день;
Воспаление: суставы теплые на ощупь, гиперемированы (покраснение), болезненны при пальпации;
Отеки: область вокруг пораженного сустава опухает и становится одутловатой;
Узелки: появляются на или около сустава. Они часто находятся вблизи локтей. Наиболее заметны в той части, которая выступает при сгибании в суставе;
Боль: Боль при ревматоидном артрите имеет несколько источников. Боль может быть из-за воспаления или от работы, даже если это не сложная работа, которую человек выполнял с легкостью до болезни. Эти боли ограничивают людей в выполнении даже самых элементарных действий, в которые вовлечены пораженные суставы (мытье посуды, утренний туалет). Интенсивность болей варьирует у разных людей. Диагностика 1.сбор анамнеза 2. Определение ревматоидного фактора 3. Антитела к АЦЦП 4.Антитела к анти-MCV 5. Определение титра IgM 6. Диагностически важными клиническими особенностями являются отсутствие изменений цвета кожи над воспалёнными суставами, развитие тендосиновитов сгибателей или разгибателей пальцев кистей и формирование амиотрофий, типичных деформаций кистей, так называемая «ревматоидная кисть». 7.Лабораторные данные Общий анализ крови : Для ревматоидного артрита характерна анемия, лейкопения, тромбоцитопения. Маркеры воспаления: Скорость оседания эритроцитов (СОЭ) и С-реактивный белок (CRP). Эти показатели, как правило, повышены в активной фазе ревматоидного артрита и могут быть хорошими индикаторами степени активности заболевания. Другие анализы крови: БАК (биохимический анализ крови) — уровень электролитов (таких как кальций, магний и калий ) и белков. Также проверяют печеночные ферменты на предмет поражения печени медикаментами; Иммунологические тесты: Определение уровня ревматоидного фактора (РФ), антинуклеарных антител (ANA) и других антител (анти-цитруллин антитела или анти-CCP ). Большинство людей имеют положительный результат РФ в активной фазе. Положительный результат ANA может указывать на необычайную активность иммунной системы. У 40% людей с ревматоидным артритом результат ANA положительный. В первые несколько месяцев после начала заболевания, эти иммунологические тесты могут быть отрицательными, а в некоторых случаях, они всегда отрицательны. Анализ синовиальной жидкости: поверхность сустава производит жидкость, которая смазывает и защищает сустав. Как и в крови, в синовиальной жидкости может быть изменение качественного и количественного состава. Тест позволяет выявить лейкоциты, которые характерны для воспалительного процесса. Для забора анализа производится пункция сустава (чаще коленного) в асептических условиях. Рентгенологические данные: в начале заболевания рентгенологическая картина может оставаться без патологии. Позже на снимках можно увидеть эрозии костной ткани (эрозии обнаруживаются у 80% примерно через год у больных, не получавших адекватной терапии не леченных пациентов); рентген, а иногда и другие исследования изображений часто используются для обнаружения повреждения суставов. Изменения костной ткани отличаются от картины, присущей остеопорозу. МРТ: магнитно-резонансная томография (МРТ) позволяет выявить изменения в костной ткани задолго до появления видимых изменений на рентгенограмме; УЗИ: Ультразвук использует высокочастотные звуковые волны для получения изображения структур внутри тела. Он может быть использован для выявления скопления жидкости внутри сустава. Радиоизотопное исследование: Принцип заключается во введении в кровь больного специального вещества содержащего радиоактивные изотопы. Здоровая и пораженная ткань по разному накапливает эти изотопы и можно сделать соответствующие выводы о наличии ли отсутствии поражения. Костная денситометрия: позволяет обнаружить уменьшение толщины костей, что может указывать на остеопороз. Остеопороз чаще встречается у пациентов с ревматоидным артритом. Артроскопия: основана на введении в сустав тонкой трубки с камерой на конце изображение с которой выводится на экран и позволяет исследовать внутреннюю часть сустава. Артроскопия не является обязательным исследованием. Лечение Лечение больных ревматоидным артритом должно быть комплексным и направлено на подавление активности и прогрессирования процесса, профилактику обострений, предупреждение ранней инвалидизации и восстановление функции суставов. Патогенетическая медикаментозная терапия ревматоидного артрита включает два вида препаратов: противовоспалительные и базисные (модифицирующие течение болезни) препараты. К первой группе относятся НПВП, действие которых основано на подавлении активности ЦОГ - основного фермента метаболизма арахидоновой кислоты. К настоящему времени в лечении ревматоидного артрита отдают предпочтение диклофенак-натрию, ибупрофену, напроксену, а также индометацину и пироксикаму. Быстрым противовоспалительным действием обладают также ГКС. Наиболее часто используют преднизолон, метилпреднизолон и дексаметазон. Средняя суточная доза преднизолона при ревматоидном артрите составляет 10 мг, метилпреднизолона и триамцинолона - 8 мг. ГКС назначают, однако, только при высокой активности ревматоидного артрита, наличии поражения внутренних органов либо при недостаточной эффективности НПВП. При генерализованном ревматоидном васкулите, синдроме Фелти, при ССВ суточная доза преднизолона может достигать 30-40 мг. При агрессивном течении артрита, наличии внесуставных проявлений предпочтение отдается цитотоксическим иммунодепрессантам. В ранней стадии болезни при преимущественно суставной форме и умеренной активности ревматоидного артрита лечение начинают с применения аминохинолиновых препаратов (делагил, плаквенил). Их назначают по 1-2 таблетки в сутки. При длительном их приеме могут развиться лейкопения, дерматит, а также ретинопатия. В случае отсутствия эффекта в течение полугода приема этих препаратов дальнейшее их использование нецелесообразно и следует перейти к другим базисным средствам. В тех случаях, когда лечение указанными БП неэффективно либо заведомо невозможно, плохо переносится, а также при наличии системных проявлений и особо агрессивных формах ревматоидного артрита (васкулит, синдром Фелти) используют цитотоксические ИД. Для лечения ревматоидного артрита чаще всего применяют азатиоприн, метотрексат, циклофосфамид, хлорамбуцил, а также циклоспорин А. В нашей стране широкое применение при лечении ревматоидного артрита нашла схема этапного лечения. Первый этап включает лечение НПВП, аминохинолиновыми препаратами, внутрисуставное введение ГКС, физическое воздействие, консервативную ортопедию. На втором этапе подключают БП: соли золота, D-пеницилламин, сульфасалазин или салазопиридазин. При недостаточной эффективности вышеуказанными методами переходят к третьему этапу с использованием ИД: метотрексата, азатиоприна или циклофосфана. При особо агрессивных формах ревматоидного артрита используют четвертый этап: пульс-терапия метилпреднизолоном и/или экстракорпоральная терапия в сочетании с БП или ИД. В последнюю очередь (пятый этап) следует прибегать к моноклональным антителам (ФНО-альфа), рекомбинантным препаратам интерферона, внутривенному введению иммуноглобулина, ионизирующему облучению. Клиническое значение определения ревматоидного фактора Ревматоидный фактор – не специфичен для РА Ревматоидный фактор выявляется часто при ревматоидном артрите. Величина титра коррелирует с активностью процесса. В то же время отсутствие ревматоидного фактора в сыворотке не может служить основанием для изменения клинического предположения. Существуют серонегативные формы ревматоидного артрита. «Ревматоидная активность» фактора может быть секвестрирована в иммунных комплексах и быть выявлена после их диссоциации.
Ревматоидный фактор (факторы) может быть выявлен и при других заболеваниях. В высоких титрах он встречается при хроническом активном гепатите, болезни Шегрена, в 30 % случаев подострого бактериального эндокардита, при системных заболеваниях соединительной ткани. Наличие ревматоидного фактора даже в низких титрах может быть информативным при диагностике латентных форм ревматического процесса. Антитела к циклическому цитруллинированному пептиду Антитела к циклическому цитруллинсодержащему пептиду, IgG, – в настоящее время один из самых информативных маркеров раннего ревматоидного артрита. АЦЦП относятся преимущественно к классу IgG и обнаруживаются в крови на самых ранних стадиях заболевания ревматоидным артритом (за 1-2 года до появления первых симптомов). Для исследования берут кровь из вены. Желательно не принимать пищу за 4 часа, не курить за 30 минут до процедуры. Исследование доступно в современных иммунологических лабораториях, ревматологических центрах. Время ожидания результата – около 5 дней Преимущества и недостатки метода С помощью анализа на определение АЦЦП можно диагностировать ревматоидный артрит ещё до появления первых симптомов заболевания (иногда даже за 1,5–2 года). Если у пациента имеется наследственная предрасположенность к РА, и в анализе обнаружено повышение уровня АЦЦП, врач обязательно назначит дополнительное обследование, а при необходимости и раннее лечение. Эти меры позволяют добиться существенного улучшения качества жизни больного и уменьшения вероятности развития осложнений заболевания. Недостатком является то, что АЦЦП не имеют тенденции к снижению в крови даже при успешном лечении заболевания, поэтому анализ не может быть использован как показатель качества проводимой терапии. Серонегативные полиартриты Полиартрит – болезнь, поражающая любые суставы. При этом воспаляться могут сразу несколько суставов, например, полиартрит ног поражает все крупные суставы обеих конечностей. В других случаях характерна летучесть патологического процесса – полиартрит стопы может перейти на другой сустав. серонегативный полиартрит является одной из форм ревматоидного артрита. Его основной особенностью является отсутствие в сыворотке крови ревматоидного фактора, группы аутоантител, являющихся показателем возникновения заболевания. Классификация Существует множество разновидностей серонегативных артритов, которые разделяют на 4 категории: 1.первая категория — серонегативный ревматоидный артрит; 2.вторая категория — серонегативный спондилоартрит (болезнь Бехтерева, псориатический артрит, болезнь Рейтера, болезни, связанные с воспалением кишечника); 3.третья категория — реактивный артрит (стрептококковый, иерсиниозный, шигеллезный и сальмонеллезный артрит); 4.четвертая категория — артриты, не связанные с ревматизмом (гинекологические, онкологические и эндокринные системные заболевания). Клиника Основные клинические признаки серонегативного РА:
острое начало суставного синдрома, «однобокая» локализация (коленный, лучезапястный суставы);
постепенное развитие симметричного полиартрита в течение года;
редкая (слабо выраженная) утренняя скованность суставов;
быстрое прогрессирование заболевания, частое рецидивирование, раннее нарушение функций суставов, но при этом поражения межфаланговых, плюснефаланговых, пястно-фаланговых редко и мало выражены;
фиброзные изменения преобладают над экссудативными. Часто возникают контрактуры;
поражение тазобедренного сустава, которое заканчивается (чаще всего) развитием асептическим некрозом головки бедренной кости.
Отличия суставного синдрома серонегативного ревматоидного артрита выявляют, прежде всего, на рентгене. Устанавливают:
преобладание анкилозирования над эрозивным процессом;
на 2-3 стадиях явная диссоциация между тяжелым поражением суставов запястья и незначительными изменениями пястно-фаланговых и межфаланговых суставов кисти;
незначительные изменения в суставах стоп;
менее выраженный остеопороз.
Диагностика Основной отличительной чертой серонегативного полиартрита является то, что реакция Ваалера-Роуза не выявляет ревматоидного фактора. Отсутствует значительное повышение СОЭ и других показателей воспалительного процесса. Характерен более высокий уровень IgA в сравнении с серо позитивным ревматоидным артритом. Асимметрия эрозивных поражений выявляется с помощью рентгенографии. С помощью этого исследования можно выявить несоответствие тяжелых поражений запястных суставов и не сильно выраженных изменений мелких суставов кисти. Лечение 1.НПВП - имизируют воспалительные процессы и уменьшают болевые ощущения. 2.ГКС – в острые периоды 3.постельный режим 4.соблюдение всех рекомендаций врача
71.Системная красная волчанка, классификация, критерии диагностики. LE-клеточный феномен, антинуклеарные антитела и их разновидности. Приниципы лечения. Системная склеродермия, клиническая картина, диагностика, принципы лечения. Системная красная волчанка (СКВ, болезнь Либмана-Сакса)— диффузное заболевание соединительной ткани, характеризующееся системным иммунокомплексным поражением соединительной ткани и её производных, с поражением сосудов микроциркуляторного русла. Клиническая классификация
Характер течения болезни:
острый;
подострый;
хронический;
рецидивирующий полиартрит;
синдром дискоидной волчанки;
синдром Рейно;
синдром Верльгофа;
синдром Шегрена;
антифосфолипидный синдром.
Степень активности процесса:
0 - отсутствует;
I - минимальная;
II - умеренная;
III - высокая.
Классификация СКВ по тяжести клинических проявлениях
Легкий СКВ: эритематозная сыпь, дискоидная сыпь, феномен Рейно, алопеция, фотосенсибилизация, язвы слизистой оболочки рта, носоглотки, лихорадка, слабость, головная боль, артриты/артралгии, миалгии, лимфаденопатия, «сухой» перикардит или плеврит, перикардит и/или плеврит с небольшим количеством экссудата, неактивный волчаночный ГН (IIкл.).
Тяжелый СКВ: миокардит, перикардит и/или плеврит с массивным количеством экссудата, активный волчаночный ГН (III, IV, V кл.) - Клинически нефротический или нефритический синдром, пневмонит или легочные кровотечения, тромбоцитопеническая пурпура, гемолитическая анемия, волчаночный васкулит, антифосфолипидный синдром, поражения ЦНС. Диагностика Критерии диагностики :
Эритема - «бабочка»: фиксированная эритема на скулах с тенденцией к распространению на назолабиальные складки.
Дискоидной сыпь: эритематозные пятна, поднимающиеся с плотно прилегающими роговыми чешуйками и закупоренные волосяные фолликулы; впоследствии на месте высыпаний может формироваться рубцовая атрофия.
Фотосенсибилизация: появление кожной сыпи как следствие необычной реакции на солнечный свет (по данным анамнеза или наблюдения врача).
Язвы в ротовой полости: ульцерация ротовой, носовой полостей.
Артрит: неэрозивный артрит, поражающего 2 или более периферические суставы, проявляется болезненностью, отеком и выпотом.
Серозит: плеврит (плевральная боль, или шум трения плевры, или наличие ПВ) или перикардит (подтвержденный с помощью ЭхоКГ или выслушиванием шума трения перикарда).
Поражение почек: персистирующая протеинурия > 0,5 г. на сутки или цилиндрурия (эритроцитарная, гемоглобиновых, зернистая или смешанная).
Поражение ЦНС: судороги или психоз.
Гематологические нарушения: гемолитическая пневмония с ретикулоцитозом, или лейкопения < 4,0х109/л. (зарегистрировано два или более), или тромбоцитопения < 100x109/л..
Иммунологические нарушения:
анти-ДНК - антитела к нативной ДНК в высоком титре;
или анти-Sm - присутствие антител до Sm ядерного антигена;
или выявления антифосфолипидных антител на основании:
высокого уровня lg антикардиолипиновых антител;
выявление волчаночного антикоагулянта с использованием стандартной методики;
ложноположительная серологическая реакция на сифилис в течение не менее 6 мес., подтверждена реакцией иммунобласттрансформации или реакцией иммунофлюоресценции.
Антинуклеарные антитела: повышение титров антинуклеарного фактора (без лекарств, способных вызвать медикаментозную красную волчанку).
Диагноз СКВ устанавливается с выявлением 4 или более из 11 вышеперечисленных критериев.
Лабораторные исследования
Общий анализ крови: часто увеличение СОЭ, но данный признак плохо коррелирует с активностью заболевания; лейкопения (обычно лимфопения) ассоциируется с активностью заболевания; гипохромная анемия связана с хроническим воспалением, скрытой кровотечением, употреблением некоторых лекарственных средств; тромбоцитопению чаще выявляют у пациентов с антифосфолипидным синдромом, очень редко развивается аутоиммунная тромбоцитопения, которая связана с синтезом антител к тромбоцитам, увеличение СРБ не характерно, как при наличии сопутствующей инфекции.
Общий анализ мочи: выявляют протеинурию, гематурию, лейкоцитурию, выраженность которых зависит от клинико-морфологического варианта волчаночного нефрита.
LE-клеточный феномен При СКВ возникает LE-клеточный феномен, для которого характерно появление LE-клеток (клеток красной волчанки), — нейтрофильных лейкоцитов, содержащих фагоцитированные фрагменты ядер других клеток (для СКВ характерно распознавание собственных клеток как чужеродных и образование против них аутоантител, разрушение таких клеток и фагоцитоз). Антинуклеарные АТ и их разновидности показатель системных заболеваний соединительной ткани.
Антинуклеарные антитела выявляются более чем у 95% больных СКВ, и их определение служит прекрасной отборочной пробой. Однако они неспецифичны для СКВ, поскольку обнаруживаются при других аутоиммунных болезнях (например, при рассеянном склерозе), хронических инфекциях, некоторых новообразованиях, хроническом гепатите и циррозе печени, пневмосклерозе, гипергаммаглобулинемии и других болезнях. Выделяют четыре основных типа окрашивания ядер, по которым можно судить о происхождении антинуклеарных антител. 1.Диффузное (гомогенное) окрашивание, при котором наблюдается свечение всего ядра, - неспецифическая реакция, вызванная антителами к дезоксирибонуклеопротеиду (комплексу ДНК с гистонами). 2.Пятнистое окрашивание обусловлено антителами к экстрагируемым ядерным антигенам: Sm (от Smith), рибонуклеопротеиду, Ro/SS-A и La/SS-B. Антитела к Sm-антигену весьма специфичны для СКВ, но их обнаруживают лишь у 20-30% больных. Антитела к рибонуклеопротеиду неспецифичны; их высокий титр характерен для смешанного заболевания соединительной ткани. Антитела к Ro/SS-A и La/SS-B появляются при синдроме Шегрена, однако специфичность этого теста также низка. 3.Периферическое окрашивание (в виде ободка по внешней части ядра) дают антитела к нативной (двухцепочечной) ДНК; они специфичны для СКВ. 4.Нуклеолярное окрашивание (свечение ядрышек) чаще всего наблюдается при системной склеродермии. Принципы лечения СКВ
Для лечения поражения почек, ЦНС, легких и гематологических нарушений используют глюкокортикоиды или комбинацию глюкокортикоидов с цитостатическими препаратами.
Лечение СКВ
|
Наименование группы |
Препарат |
|
1. Глюкокортико- стероиды |
Преднизолон: 1) 1 мг/кг в день, в начале болезни; 2) затем однократно в утренние часы в течение 4-6 недель с постепенным снижением дозы до поддерживающей (не более 5 мг в неделю); 3) при неэффективности предшествующей терапии – пульс терапия (метилпреднизолон 1 г в/в капельно в течение не менее 30 мин. 3 дня подряд) |
|
2. Цитостатики |
1. Азатиоприн (1-4 мг/кг/день) (per os); 2. Циклофосфамид (1-4 мг/кг/день) (per os) или в/венно 0,5 - 1,0 г/м/кг; 3. Хлорбутин - 0,1 - 0,2 мг/кг/день (per os). |
|
3. Аминохинолиновые производные |
1. Плаквенил – 400 мг/день - 200 мг 3 раза в неделю. 2. Хлорохин (делагил) 250 мг/день - 250 мг 2 раза в неделю. |
|
4. НПВП |
|
Системная склеродермия Системная склеродермия(ССД) - это системное заболевание соединительной ткани и мелких сосудов, характеризующееся фиброзно-склеротическими изменениями кожи, стромы внутренних органов и симптоматикой облитерирующего эндартериита в форме распространенного синдрома Рейно. Классификация ССД
|
№ |
Критерий |
Определение |
|
1. |
Течение |
1. Острое 2. Подострое 3. Хроническое |
|
|
|
|
|
2. |
Стадии развития Болезни |
I - начальных проявлений II - генерализации процесса III - далеко зашедших изменений |
|
|
|
|
|
3. |
Степень активности процесса |
I - минимальная II - умеренная III - высокая |
|
|
|
|
Этиология 1. Генетические факторы (семейные случаи ССД, наличие иммунных сдвигов у родственников пробандов.
2. Внешние факторы (инфекции, охлаждение, влияние лекарственных веществ, промышленных веществ).
3. Значение системы HLA (накопление А9, В8, В27, В40, DR. Патогенез 1. Способность фибробластов к усиленному коллагено-
и фиброзообразованию.
2. Нарушение гуморального и клеточного иммунитета
(снижение Т-лимфоцитов при нормальном уровне В-лимфоцитов; дисбаланс хелперной и супрессорной активности Т-лимфоцитов; увеличение антинуклеарных антител, циркулирующих иммунных комплексов.
3. Установлены антигенные свойства коллагеновых белков.
4. Нарушения микроциркуляции, обусловленные как поражением сосудистой стенки, так и изменениями свойств компонентов крови. Клиника 1. Синдром Рейно(Результат генерализованного поражения микрососудов.) 2. Суставной синдром (Арталгии , Артриты, чаще мелких суставов кистей рук.) 3.Кожно-мышечные проявления (В I стадии – бледность, гиперемия или цианоз, отечность.Во II стадии – кожные покровы плотные, холодные, сухие, не собираются в складку . В III стадии - истончение кожи, пергаментность. Преимущественное поражение на кистях и лице. Лицо маскообразное, клювовидный нос, “кисет” вокруг рта, губы сухие, заеды на слизистой губ. Выпадение волос на голове, ломкость ногтей., Мышечные атрофии, выраженная мышечная слабость) 4. Нарушение кальцевого обмена (Лизис концевых фаланг пальцев рук.Остеопароз ) 5. Висцеральная патология - Поражение сердца – кардиосклероз, реже миокардит, поражение эндокарда с формированием митральной недостаточности, сухой или экссудативный перикардит. - Легочные проявления - пневмосклероз; частые бронхиты, пневмонии.
- Патология органов пищеварения (дисфагия, поперхивание при глотании твердой пищи;при ФГДС - слизистая желудка и пищевода атрофична, эрозивные изменения слизистой; двигательные нарушения тонкого и толстого кишечника (поносы, запоры, атоническая кишечная непроходимость, язвенно-некротические поражения)) - Патология почек: склеродермическая почка - (поражение сосудов почек ишемия почек активация ренин - ангиотензин - альдостероновой системы злокачественная гипертония ОПН ретино- и энцефалопатия) нефропатия (в основе лежит мембранозный гломерулонефрит, нефросклероз), клинически - гематурия, протеинурия. 6. CREST – синдром (1. Кальциноз.2. Синдром Рейно.3. Склеродактилия.4. Расширение пищевода.5. Телеангиэктазии.) 7. Синдром Шегрена. 8. Поражение щитовидной железы (тиреоидит Хашимото или фиброзная атрофия, ведущие к развитию гипотиреоза). 9. Первичный билиарный цирроз. 10. Лабораторные критерии
1) Умеренное ускорение СОЭ.
2) Гипергаммаглобулинемия и РФ.
3) АНФ.
4) Склеродермические антитела:
- антитела ScL - 70;
- антитела к центромере;
- нуклеолярные антитела;
- Ки – антитела;
- миозит - специфические антитела;
- антитела к центриоле. Диагностика 1.Основные (большие) критерии: 1)Склеродермическое поражение кожи, проходящее последовательно стадии "плотного" отека, индурации и атрофии с преимущественной локализацией на лице (маскообразность) и в области кистей (склеродактилия), возможно тотальное поражение. Обычно кожный синдром сочетается с пигментацией. 2)Синдром Рейно. 3)Суставно-мышечный синдром с развитием стойких контрактур, в основе которого - ревматоидноподобный артрит, периартикулярные изменения и фиброзирующий миозит. 4)Остеолиз ногтевых, а иногда средних и основных фаланг пальцев рук, реже - ног, что проявляется укорочением и деформацией пальцев. 5)Синдром Тибьержа - Вейссенбаха - отложение солей кальция преимущественно в области пальцев рук и периартикулярно - вокруг локтевых, плечевых и тазобедренных суставов, в подкожной клетчатке, иногда по ходу фасций и сухожилий мышц. 6)Поражение пищеварительного тракта (склеродермический эзофагит с дисфагией, дилатация пищевода, гастрит, дуоденит, нарушение моторики кишечника вплоть до кишечной непроходимости, развитие синдрома мальабсорбции). 7)Поражение сердца по типу первичного крупноочагового кардиосклероза. 8)Поражение легких по типу базального пневмосклероза, кистозыого легкого (на рентгенограмме - медовые соты). 9)Истинная склеродермическая почка, диагностируется клинически на основании внезапного повышения артериального давления и развития острой почечной недостаточности. 2.Дополнительные (малые) критерии: 1)Периферические: гиперпигментация кожи, телеангиэктазии, трофические нарушения, синдром Шегрена, полиартралгии, полимиалгии, полимиозит. 2)Висцеральные: лимфаденопатия, полисерозит (чаще адгезивный), диффузный и очаговый нефрит, полиневрит, поражение ЦНС. 3)Общие: потеря массы (более 10 кг), лихорадка (чаще субфебрильная). 4)Лабораторные: увеличение СОЭ (более 20 мм/ч), гиперпротеинемия (более 85 г/л), гипергаммаглобулинемия (более 23 %), антитела к ДНК или АНФ, РФ, увеличение уровня оксипролина плазмы и мочи. 3. Лабораторные данные: OAK: в некоторых случаях признаки гипохромной анемии, лейкопения, несколько чаще лейкоцитоз, увеличение СОЭ. Анализ мочи - повышение уровня оксипролина. БАК: в зависимости от активности процесса - гиперпротеинемия, увеличение уровня альфа2- и гаммаглобулинов, фибрина, серомукоида, СРП, гаптоглобина, оксипролина (нарушение метаболизма коллагена). ИИ крови: у 40-50 % больных - РФ, у 30-90 % - антинуклеарные антитела, у 2-7 % - волчаночные клетки, характерны антитела к эндотелию, антинуклеарные антитела к антигену Scleroderma -70, снижение количества Т-лимфоцитов, в частности Т-супрессоров, гипер- и дисиммуноглобулинемия. 4.Инструментальные исследования: Рентгенологическое исследование: участки кальциноза в подкожной клетчатке, преимущественно концевых отделов пальцев рук, реже - стоп, области локтевых, коленных и других суставов. Остеолиз в ногтевых фалангах пальцев кистей, стоп, дистальных отделах лучевой и локтевой костей, задних отделов ребер. Околосуставной остеопороз, сужение суставных щелей, иногда единичные эрозии на поверхности суставного хряща, костные анкилозы. Снижение тонуса и ослабление перистальтики желудочно-кишечного тракта, что приводит к расширению пищевода, двенадцатиперстной и тощей кишки. Диффузный и кистозный пневмосклероз в базальных отделах и увеличение размеров сердца. ЭКГ - диффузные изменения миокарда, иногда блокада ножек пучка Гиса и атриовентрикулярная. Исследование биоптата кожно-мышечного лоскута: фиброзная трансформация тканей, патология сосудов. 5.Программа обследования: ОА крови и мочи, экскреция с мочой оксипролина. БАК: общий белок, белковые фракции, серомукоид, фибрин, сиаловые кислоты, оксипролин, кальций, креатинин, мочевина, амино-рансферазы, альдолазы, билирубин, щелочная фосфатаза. ИИ крови: иммуноглобулины, В- и Т-лимфоциты и их субпопуляции, РФ, LE-клетки. Рентгенологическое исследование пищевода, желудка, легких, костно-суставной системы. Принцип лечения
|
Показания |
Препарат |
| |
|
1. |
Синдром Рейно |
1. Антагонисты кальция – нифедипин (30-60 мг/с) 2. Простагландины – илопрост 3. Трентал - (800-1200 мг/с) 4. Дипиридамол (335 мг/с) 5. Низкомолекулярный декстран (400 мл в/в) 6. Тиклид (250 мг 2 раза в день) 7. Альфа-блокаторы (сермион 30-60 мг/с, празозин 1-2 мг 3 раза в день 8. Компламин, солкосерил, продектин 9. Анаболические стероиды 10. Плазмаферез | |
|
2. |
Активный прогрессирующий процесс |
1. Д-пеницилламин (250-500 мг/с) 2. Колхицин - 5-10 мг/неделю 3. Глюкокортикоиды - 40-60 мг/с | |
|
3. |
Поражение желудочно-кишечного тракта |
1. Антациды 2. Блокаторы Н2- гистаминовых рецепторов (квамател 40 мг/с) | |
|
4. |
Поражение легких |
1. Д-пеницилламин 2. Глюкокортикоиды (40-60 мг/с) | |
|
5. |
Поражение сердца |
1. Глюкокортикоиды 2. Лечение сердечной недостаточности (сердечные гликозиды, мочегонные) | |
|
6. |
Артериальная гипертензия |
1. ИАПФ, бета-блокаторы | |
|
7. |
Поражение суставов и мышц |
1. НПВП 2. Низкие дозы глюкокортикоидов | |
|
8. |
Кальцификация |
1. Колхицин - 0,5 мг х 2 раза /с | |
|
|
|
| |
72.Системные васкулиты. Клиническая характеристика, проблемы классификации. ANCA-феномен. Системные васкулиты (СВ) - гетерогенная группа заболеваний различной этиологии, в основе которых лежит генерализованное поражение сосудов различного калибра с иммунным воспалением, некрозом сосудистой стенки и вторичным вовлечением в патологический процесс различных органов и систем. Клинические признаки зависят от типа, размера и локализации пораженных сосудов, а также от активности системного воспаления. Воспалительное поражение сосудистой стенки артерий или вен различного калибра часто приводит к развитию окклюзии сосуда, нарушению микроциркуляции и последующей ишемией органов и тканей вплоть до возникновения инфарктов и некрозов.
Различают первичные и вторичные СВ:
• первичные СВ - генерализованные поражения сосудов, служащие самостоятельными нозологическими формами;
• вторичные
СВ - поражения сосудов чаще всего
локального характера, развивающиеся
при других заболеваниях (например, при
ИЭ, диффузных заболеваниях соединительной
ткани, РА и др.), а также при опухолях,
инфекционных поражениях и лекарственной
болезни.
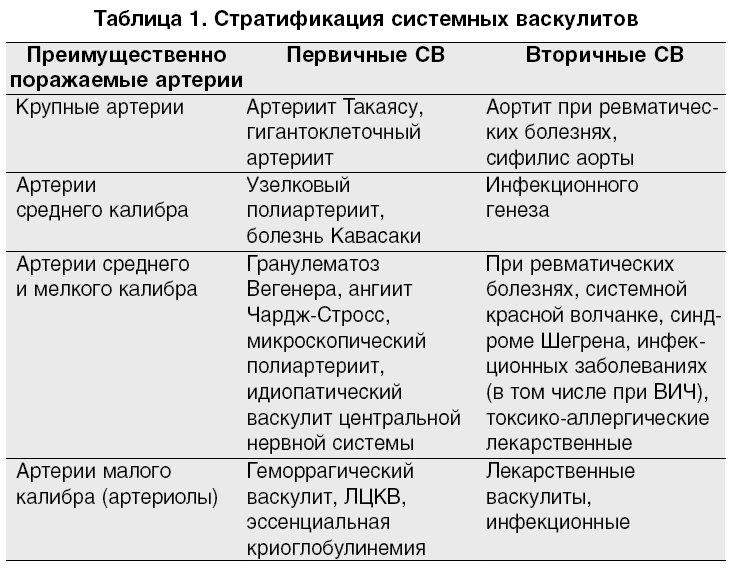
Проблемы классификации возникают изза множественности особенностей васкулитов и их обширной клинической картиной . Современная классификация СВ по прежнему распределяеться по преимущественному поражению артерий . ANCA-феномен АНЦА-ассоциированные васкулиты (ААВ) — разновидность васкулитов, при которых в крови определяются антинейтрофильные цитоплазматические антитела . Классификация : Выделяют три основных типа ААВ: 1. микроскопический полиангиит 2. гранулематоз Вегенера 3.синдром Чарга-Стросса (прежнее название — астматический вариантузелкового периартериита). Все эти виды васкулитов объединяет поражение мелких кровеносных сосудов. АНЦА иногда определяются в крови при узелковом периартериите, особенно когда имеет место поражение мелких сосудов. ААВ характеризуются быстрым злокачественным течением процесса, что особенно проявляется при поражении почек. Гломерулонефрит имеет быстропрогрессирующее течение и сопровождается быстро нарастающей почечной недостаточностью[4]. Выживаемость пациентов без лечения не превышает одного года. Принцип лечения : Основу терапии составляют иммунодепрессанты: цитостатики и глюкокортикоиды, значительно повышающие качество и продолжительность жизни пациентов. Определённая надежда возлагается на антицитокиновую терапию.
73.Криоглобулинемия,
причины, патогенез, клинические
проявления, методы диагностики.
Криоглобулинемия –
синдром, обусловленный присутствием в
сыворотке крови преципитатных белков
(криоглобулинов), способных к выпадению
в осадок при температуре ниже 37
°С.
Проявления криоглобулинемии могут
включать геморрагическую сыпь, синдром
Рейно, артралгию, периферическую
полинейропатию, гепатоспленомегалию,
гломерулонефрит и почечную
недостаточность.
Причины
:
1.
Развиваеться как сопутствующий процесс
при заболеваниях аутоиммунного,
лимфопролиферативного, инфекционного
генеза
2. Генетическая предрасположенность
к развитию криоглобулинемии у лиц с
изменениями локусов HLA-DR3, DR6, DR7 и
DR15.
Патогенез
В
патогенезе криоглобулинемии пусковая
роль принадлежит взаимодействию антигена
с иммунной системой. Активация B-лимфоцитов
стимулирует гиперпродукцию моно- или
поликлональных иммуноглобулинов,
приводит к образованию криопреципитирующих
иммунных комплексов и их отложению в
стенках мелких сосудов различных
органов. Активация системы комплемента
индуцирует повреждение сосудистой
стенки и развитие воспаления, а усиление
факторов свертывания крови способствует
формированию микротромбоза
капилляров.
Клинические
проявления
Наиболее
рано криоглобулинемия проявляется
кожными поражениями: пурпурой; петехиальной
сыпью с преимущественной локализацией
на ногах и ягодицах; в 50 % случаев
развивается синдром Рейно с явлениями
некроза, в 30 - артралгический синдром.
При криоглобулинемии возможны диатез
геморрагический, абдоминальные кризы,
легочные геморрагии, формирование
периферической нейропатии: парестезии,
мышечная слабость, атрофия мышц
конечностей.
Наибольшую опасность
при криоглобулинемии представляет
поражение почек (в 20 % случаев) в результате
отложения криопреципитатов в капиллярах
клубочков и последующего тромбоза. В
стенках капилляров обнаруживается
фиксация иммунных комплексов, содержащих
иммуноглобулин М, иммуноглобулин G и
компонент СЗ. Возможно развитие острой
почечной недостаточности, нефропатии,
подострого или хронического гломерулонефрита
мембранопролиферативного типа.
 Методы
диагностики
Диагностическими
тестами криоглобулинемии являются
анализы крови на сывороточный криоглобулин,
РФ, анти-HCV и др.; результаты биопсии кожи
или почки. Лечение криоглобулинемии
осуществляется с помощью глюкокортикоидов,
цитостатиков, противовирусных препаратов,
плазмафереза или криоафереза.
Лабораторная
диагностика. Кровь для исследования у
больных нужно брать при температуре 37
°С в предварительно подогретый меланжер,
сохраняться она должна в термостате.
Для получения криопреципитата сыворотку
оставляют при температуре 4 °С на 72 ч. У
50 % больных обнаруживается ревматоидный
фактор, в некоторых случаях возможен
перенос аллергии к холоду в РПКА. Уровень
иммуноглобулина в сыворотке обычно R
норме или умеренно повышен (ИГ М),
компонентов комплемента системы, как
правило, в пределах нормы или немного
снижен. При иммунофлюоресценции в
составе иммунных комплексов обнаруживаются
иммуноглобулин М, иммуноглобулин G,
компоненты Clg, СЗ, С4, антиген гепатита
В, ДНК. Для постановки диагноза необходимы
электрофорез белков сыворотки, мочи,
обнаружение белков Бенс-Джонса,
обследование функции печени, выявление
латентной аллергии микробной.
Методы
диагностики
Диагностическими
тестами криоглобулинемии являются
анализы крови на сывороточный криоглобулин,
РФ, анти-HCV и др.; результаты биопсии кожи
или почки. Лечение криоглобулинемии
осуществляется с помощью глюкокортикоидов,
цитостатиков, противовирусных препаратов,
плазмафереза или криоафереза.
Лабораторная
диагностика. Кровь для исследования у
больных нужно брать при температуре 37
°С в предварительно подогретый меланжер,
сохраняться она должна в термостате.
Для получения криопреципитата сыворотку
оставляют при температуре 4 °С на 72 ч. У
50 % больных обнаруживается ревматоидный
фактор, в некоторых случаях возможен
перенос аллергии к холоду в РПКА. Уровень
иммуноглобулина в сыворотке обычно R
норме или умеренно повышен (ИГ М),
компонентов комплемента системы, как
правило, в пределах нормы или немного
снижен. При иммунофлюоресценции в
составе иммунных комплексов обнаруживаются
иммуноглобулин М, иммуноглобулин G,
компоненты Clg, СЗ, С4, антиген гепатита
В, ДНК. Для постановки диагноза необходимы
электрофорез белков сыворотки, мочи,
обнаружение белков Бенс-Джонса,
обследование функции печени, выявление
латентной аллергии микробной.
74.Паранеопластический
синдром (дерматомиозит и другие
паранеопластические реакции), роль
иммунологических методов диагностики,
определение онкогенов.
Паранеопластический
синдром (ПНС) —
клинико-лабораторное проявление
злокачественной опухоли, обусловленное
не её локальным или метастатическим
ростом, а неспецифическими реакциями
со стороны различных органов и систем
или эктопической продукцией опухолью
биологически активных
веществ. Паранеопластические
синдромы распространены у пациентов
среднего и пожилого возраста, и наиболее
часто развиваются при раке лёгких,
молочной железы, яичников, а также
при лимфоме. Иногда
симптомы паранеопластического синдрома
манифестируют ещё до диагностики
злокачественной опухоли.
Паранеопластические
синдромы разделяются на 4 основные
категории :
-эндокринные ПНС
-неврологические
ПНС
-кожно-слизистые ПНС
- гематологические
ПНС
 В
настоящее время выделяют следующие
основные этиологические факторы и
патогенетические механизмы развития
паранеопластических синдромов:
1. Воздействие
секретированных опухолью биологически
активных белков или полипептидов,
факторов роста, интерлейкинов, цитокинов,
простагландинов, эмбриональных
(раково-эмбрионального антигена, или
альфа-фетопротеина) и других протеинов,
таких как иммуноглобулины, а так же
энзимов.
2. Образование
аутоиммунных и иммунных комплексов,
наличие иммунной супрессии.
3. Образование
эктопических рецепторов или конкурентное
блокирование действия нормальных
гормонов биологически неактивными
гормонами, продуцированными
опухолью.
4. «Запрещенный
контакт», при котором освобождаются
энзимы или другие продукты, в норме
отсутствующие в кровяном русле, но
циркулирующие в условиях патологической
васкуляризации опухоли или при разрушении
базальных мембран, что ведет к развитию
антигенных реакций, не соответствующих
нормальным физиологическим
функциям.
5. Другие
причины, в том числе генетически
обусловленная восприимчивость к развитию
аутоиммунных процессов.
Диагностика
1.
Развернутый общий анализ крови , мочи
, спинномозговой жидкости
В
общем анализе крови можно выявить
анемию, обусловленную различными видами
рака или доброкачественных заболеваний.
У пациентов с онкологическими и
инфекционными заболеваниями обычно
повышена СОЭ. Микроскопия лейкоцитов
помогает установить диагноз лейкоза
или лимфомы. У больных с ходжкинских
лимфомой часто бывает гиперэозинофилия.
У пациентов с подозрением на ДВС следует
определить количество тромбоцитов.
2.Проведение
КТ , МРТ
У
пациентов с эндокринными нарушениями,
связанными с наличием гормонсинтезирующих
опухолей, можно применить
сцинтиграфию.
Позитрон-эмиссионная
томография позволяет отдифференцировать
паранеопластические от непаранеопластичных
поражений нервной системы.
3. Определение
онкогенов
Все
паранеопластические антитела сегодня
в определенной степени могут рассматриваться
и как потенциальные маркеры раковых
заболеваний. Возможность
использования данных тестов для
диагностики рака стала реальной.
Большинство
ПННС опосредуются иммунными механизмами,
и лучшим доказательством этого процесса
является обнаружение антител в
спинномозговой жидкости (СМЖ) и в
сыворотке крови пациентов. Эти
антитела взаимодействуют с белками
нейронов, которые экспрессируются
опухолью у таких пациентов. Выявление
подобных аналогов и является основой
практических нейроонкологических
диагностических тестов
В
настоящее время выделяют следующие
основные этиологические факторы и
патогенетические механизмы развития
паранеопластических синдромов:
1. Воздействие
секретированных опухолью биологически
активных белков или полипептидов,
факторов роста, интерлейкинов, цитокинов,
простагландинов, эмбриональных
(раково-эмбрионального антигена, или
альфа-фетопротеина) и других протеинов,
таких как иммуноглобулины, а так же
энзимов.
2. Образование
аутоиммунных и иммунных комплексов,
наличие иммунной супрессии.
3. Образование
эктопических рецепторов или конкурентное
блокирование действия нормальных
гормонов биологически неактивными
гормонами, продуцированными
опухолью.
4. «Запрещенный
контакт», при котором освобождаются
энзимы или другие продукты, в норме
отсутствующие в кровяном русле, но
циркулирующие в условиях патологической
васкуляризации опухоли или при разрушении
базальных мембран, что ведет к развитию
антигенных реакций, не соответствующих
нормальным физиологическим
функциям.
5. Другие
причины, в том числе генетически
обусловленная восприимчивость к развитию
аутоиммунных процессов.
Диагностика
1.
Развернутый общий анализ крови , мочи
, спинномозговой жидкости
В
общем анализе крови можно выявить
анемию, обусловленную различными видами
рака или доброкачественных заболеваний.
У пациентов с онкологическими и
инфекционными заболеваниями обычно
повышена СОЭ. Микроскопия лейкоцитов
помогает установить диагноз лейкоза
или лимфомы. У больных с ходжкинских
лимфомой часто бывает гиперэозинофилия.
У пациентов с подозрением на ДВС следует
определить количество тромбоцитов.
2.Проведение
КТ , МРТ
У
пациентов с эндокринными нарушениями,
связанными с наличием гормонсинтезирующих
опухолей, можно применить
сцинтиграфию.
Позитрон-эмиссионная
томография позволяет отдифференцировать
паранеопластические от непаранеопластичных
поражений нервной системы.
3. Определение
онкогенов
Все
паранеопластические антитела сегодня
в определенной степени могут рассматриваться
и как потенциальные маркеры раковых
заболеваний. Возможность
использования данных тестов для
диагностики рака стала реальной.
Большинство
ПННС опосредуются иммунными механизмами,
и лучшим доказательством этого процесса
является обнаружение антител в
спинномозговой жидкости (СМЖ) и в
сыворотке крови пациентов. Эти
антитела взаимодействуют с белками
нейронов, которые экспрессируются
опухолью у таких пациентов. Выявление
подобных аналогов и является основой
практических нейроонкологических
диагностических тестов
 Лечение
Лечение
зависит от вида опухоли и органа - мишени
паранеопластического синдрома. Существуют
две стратегии:
Лечение
Лечение
зависит от вида опухоли и органа - мишени
паранеопластического синдрома. Существуют
две стратегии:
Лечение первичной опухоли. Терапия первой линии - оперативное вмешательство, облучение или химиотерапия (в режиме монотерапии или в комбинации). Применяют те же протоколы лечения, что и для опухолей без паранеопластического синдрома.
Лечение заподозренных иммунных расстройств. Второе направление лечения - иммуносупрессия (с помощью введения иммуноглобулинов, стероидов или других иммунодепрессантов или плазмафереза). Такое лечение показано только пациентам с выявленными в сыворотке крови антителами.
Роль иммунологических методов диагностики – определение АГ и маркреров к злокачественным новообразованиям 75.Иммуносерологические исследования. Биологические основы определения групп крови. Клиническое значение определения групп крови. Иммуносерологические исследования – это диагностические методы исследования, основанные на специфическом взаимодействии антигенов и антител. Порядок иммуносерологических исследований при переливании компонентов крови 2.1. Иммуносерологические исследования при переливании переносчиков газов крови 2.2. Иммуносерологические исследования при переливании корректоров гемостаза и фибринолиза, средств коррекции иммунитета 2.1. Иммуносерологические исследования при переливании переносчиков газов крови При переливании эритроцитов (плановом, экстренном) врач, выполняющий трансфузию, обязан: 2.1.1. Определить группу крови АВ0 и резус-принадлежность реципиента и донора (по эритроцитам в контейнере). 2.1.2. Провести пробу на индивидуальную совместимость крови реципиента и донора (см. ниже) одним из двух способов: - первый способ: двухэтапная проба в пробирках с антиглобулином; - второй способ: на плоскости при комнатной температуре и одна из трех проб (непрямая реакция Кумбса, реакция конглютинации с 10% желатином или реакция конглютинации с 33% полиглюкином). По жизненным показаниям, в случае, если группа крови и резус принадлежность реципиента неизвестны, врач, выполняющий трансфузию может перелить реципиенту переносчики газов крови (эритроцитная масса, взвесь) группы 0(I) резус отрицательная при обязательном проведении проб на индивидуальную совместимость и биологической пробы. При наличии у реципиента антиэритроцитарных, антилейкоцитарных или антитромбоцитарных антител, подбор компонентов крови производят в специализированной лаборатории. Если эритроцитная масса или взвесь подобраны реципиенту индивидуально в специализированной лаборатории, врач, выполняющий трансфузию перед переливанием определяет группу крови реципиента, донора и проводит только одну пробу на индивидуальную совместимость - на плоскости при комнатной температуре. 2.2. Иммуносерологические исследования при переливании корректоров гемостаза и фибринолиза, средств коррекции иммунитета При переливании корректоров гемостаза и фибринолиза, средств коррекции иммунитета врач, выполняющий трансфузию, обязан: 2.2.1. Определить группу крови АВ0 и резус-принадлежность реципиента. Групповую и резус-принадлежность донора врач, выполняющий трансфузию, устанавливает по этикетке на контейнере с трансфузионной средой, пробу на индивидуальную совместимость не проводит. 3. Техника иммуносерологических исследований 3.1. Определение группы крови АВ0 3.2. Определение резус-принадлежности Определение группы крови, резус-принадлежности, пробу на индивидуальную совместимость крови донора и реципиента проводят в соответствии с инструкциями по иммуносерологии. Руководствуются также инструкциями-вложениями, которые прилагаются к набору реагентов предприятием изготовителем. Используют эритроциты и сыворотку крови реципиента не более двухдневного срока хранения при температуре +2 - 8°С. Для метода агглютинации на плоскости и метода конглютинации в пробирках с 10% желатином или 33% полиглюкином берут осадок неотмытых эритроцитов. Для двухступенчатой пробы в пробирках с иммуноглобулином и непрямой пробы Кумбса эритроциты трижды отмывают физиологическим раствором. Отмывание эритроцитов производят обычным образом. 3.1. Определение группы крови АВ0 На пластинку в три точки под обозначениями анти-А, анти-В, анти-АВ помещают по 2 капли (0,1 мл) реагента и рядом по одной капле осадка эритроцитов (0,01 - 0,02 мл при использовании гемагглютинирующих сывороток; 0,02 - 0,03 мл при использовании цоликлонов). Сыворотку и эритроциты перемешивают стеклянной палочкой. Пластинку периодически покачивают, наблюдая за ходом реакции в течение 3-х мин при использовании цоликлонов; 5 мин при использовании гемагглютинирующих сывороток. По истечении 5 мин в реагирующую смесь можно добавить по 1 - 2 капли (0,05 - 0,1 мл) физиологического раствора для снятия возможной неспецифической агрегации эритроцитов. При наличии агглютинации со всеми тремя реагентами необходимо исключить неспецифическую агглютинацию исследуемых эритроцитов. Для этого к капле эритроцитов вместо цоликлонов добавляют каплю физиологического раствора, а вместо гемагглютинирующих сывороток сыворотку группы AB(IV). Кровь можно отнести к группе AB(IV) только при отсутствии агглютинации эритроцитов в физиологическом растворе или сыворотке AB(IV). 3.2. Определение резус-принадлежности 3.2.1. Реакция агглютинации на плоскости с помощью цоликлонов анти-D супер: Наносят большую каплю (около 0,1 мл) реагента на пластинку или планшет. Наносят рядом маленькую каплю (0,02-0,03 мл) исследуемых эритроцитов. Тщательно смешивают реагент с эритроцитами стеклянной палочкой. Через 10 - 20 с мягко покачивают пластинку. Несмотря на то, что четкая агглютинация наступает в первые 30 с, результаты реакции учитывают через 3 мин после смешивания. При наличии агглютинации исследуемая кровь маркируется как резус положительная, при отсутствии - как резус отрицательная. Для определения резус-принадлежности ускоренным методом на плоскости при комнатной температуре могут быть использованы поликлональные сыворотки анти-D с неполными антителами, приготовленные в комбинации с коллоидами (альбумином, полиглюкином). 3.2.2 Метод конглютинации с 10% желатином: Используют реагенты, содержащие неполные поликлональные антитела (сыворотки анти-D) или неполные моноклональные антитела (цоликлоны анти-D). В 2 пробирки вносят по 0,02 - 0,03 мл осадка эритроцитов, для чего выдавливают из пипетки небольшую каплю эритроцитов и касаются ею дна пробирки. Затем в первую пробирку добавляют 2 капли (0,1 мл) желатина и 2 капли (0,1 мл) реагента, во вторую (контрольную) пробирку добавляют 2 капли (0,1 мл) желатина и 2 капли (0,1 мл) физиологического раствора. Содержимое пробирок перемешивают встряхиванием, после чего их помещают в водяную баню на 15 мин или термостат на 30 мин при температуре +46 - 48°С. По истечении указанного времени в пробирки добавляют по 5 - 8 мл физиологического раствора и перемешивают содержимое путем 1 - 2-кратного переворачивания пробирок. Результат учитывают, просматривая пробирки на свет невооруженным глазом или через лупу. Агглютинация эритроцитов свидетельствует о том, что исследуемый образец крови резус положительный, отсутствие агглютинации - о том, что испытуемая кровь резус отрицательная. В контрольной пробирке агглютинация эритроцитов должна отсутствовать. Для определения резус-принадлежности ускоренным методом в пробирке при комнатной температуре может быть использован универсальный реагент, представляющий собой сыворотку анти-D с неполными антителами, разведенную 33% полиглюкином. Возможные ошибки Все ошибки можно разделить на три группы:
• низкое качество реагентов;
• технические ошибки; -плохая освещенность -повышенная температура в помещении замедляет агглютинацию -неправильное расположение сывороток -недобавление физиологического раствора
• особенности исследуемой крови. Клиническое значение системы АВО : 1. Определение групп крови для совместимости гемотрансфузий 2. Определение конфликта «мать-плод» при беременности 76.Полимеразная цепная реакция. Современные методы диагностики инфекций. Достижения в молекулярной диагностике наследственных заболеваний. Понятие о геномике и протеомике. ДНК-исследование (диагностика) — это еще один из самых современных высокотехнологичных методов диагностики. ДНК-анализы обширно применяются в определении инфекционных заболеваний, при этом позволяя обнаруживать даже наличие мельчайших микроорганизмов в организме самого человека.
ДНК-диагностика соединяет несколько методов исследования, один из распространенных — способ ПЦР - полимеразной цепной реакции.
ПЦР-исследование — это способ, один из методов идентификации инфекционных заболеваний в условия лаборатории, конкретнее, этот метод широко используется и для идентификации заболеваний, которые передаются половым путем — ЗППП. Материалом для осуществления данной диагностики могут быть:
скоб эпителия (соскоб цервикального канала, соскоб у мужчин из уретры и у женщин);
плазма, кровь, сыворотка из крови;
биологические жидкости (плевральная, околоплодная, спинномозговая, суставная жидкости, человеческая слюна, сок простаты.);
моча (используется первая порция утренней мочи);
мокрота;
биопаты двенадцатиперстной кишки и желудка;
слизистые выделения и др. биологические выделения.
С помощью ПЦР-анализа можно обнаружить : 1) ПЦР-анализ на комплекс исследований на заболевания, передающиеся половым путем (ЗППП) 2)ПЦР-анализ на хламидиоз 3)ПЦР-анализ на туберкулез 4)ПЦР-анализ на гепатит С 5)ПЦР-анализ на микоплазма гоминис 6)ПЦР-анализ на трихомониаз 7)ПЦР-анализ на гепатит В 8)ПЦР-анализ на уреаплазму 9)ПЦР-анализ на папиллому (ВПЧ с определением онкогенности) 10)ПЦР-анализ на гонорею 11)ПЦР-анализ на гепатит С количественный 12)ПЦР-анализ на микоплазму гениталиум 13)ПЦР-анализ на цитомегаловирус 14)ПЦР-анализ на вирус Эпштейн-Барра 15)ПЦР-анализ на вирус герпеса I-го и II-го типов 16)ПЦР-анализ на вирус герпеса 6-го типа 17)ПЦР-анализ на токсоплазму гондии 18)ПЦР-анализ на энтеровирус Преимущества метода ПЦР как метода диагностики инфекционных заболеваний : 1)Прямое определение наличия возбудителей (выявление специфического участка ДНК возбудителя методом ПЦР дает прямое указание на присутствие возбудителя инфекции) 2)Высокая специфичность (высокая специфичность метода ПЦР обусловлена тем, что в исследуемом материале выявляется уникальный, характерный только для данного возбудителя фрагмент ДНК. Специфичность задается нуклеотидной последовательностью праймеров, что исключает возможность получения ложных результатов, в отличие от иммунологических методов анализа, где нередки ошибки в связи с перекрестно-реагирующими антигенами) 3)Высокая чувствительность (метод ПЦР позволяет выявлять даже единичные клетки бактерий или вирусов. ПЦР- анализ обнаруживает наличие возбудителей инфекционных заболеваний в тех случаях, когда другими методами (иммунологическими, бактериологическими, микроскопическими) это сделать невозможно.) 4)Универсальность процедуры выявления различных возбудителей (материалом для исследования методом ПЦР служит ДНК возбудителя. Метод основан на выявлении фрагмента ДНК или РНК, являющегося специфичным для конкретного организма. Сходство химического состава всех нуклеиновых кислот позволяет применять унифицированные методы проведения лабораторных исследований. Это дает возможность диагностировать несколько возбудителей из одной биопробы. В качестве исследуемого материала могут использоваться различные биологические выделения (слизь, моча, мокрота), соскобы эпителиальных клеток, кровь, сыворотка. ) 5) Высокая скорость получения результата анализа (для проведения ПЦР-анализа не требуется выделение и выращивание культуры возбудителя, что занимает большое количество времени.Унифицированный метод обработки биоматериала и детекции продуктов реакции и автоматизация процесса амплификации дают возможность провести полный анализ за 4-5 часов.) 6) Возможность диагностики не только острых, но и латентных инфекций (особенно эффективен метод ПЦР для диагностики трудно культивируемых, некультивируемых и персистирующих форм микроорганизмов, с которыми часто приходится сталкиваться при латентных и хронических инфекциях, поскольку этот метод позволяет избежать сложностей, связанных с выращиванием таких микроорганизмов в лабораторных условиях. Применение ПЦР-диагностики также очень эффективно в отношении возбудителей с высокой антигенной изменчивостью и внутриклеточных паразитов.) Ограничения метода ПЦР : 1)Амплифицируется ДНК как живого, так и погибшего микроорганизма (это налагает определенные требования при использовании ПЦР для контроля эффективности лечения. В общем случае подобный контроль должен проводиться спустя промежуток времени, в течение которого происходит полная элиминация возбудителя. Обычно этот интервал составляет 4-8 недель. ) 2) Возможность перекрестной реакции 3) Изменчивость микроорганизмов Современные методы иммунодиагностики инфекционных болезней : 1. Радиоиммунологический анализ (РИА 2. Иммуноферментный анализ(ИФА 3. ЭФ иммуноэлектрофорез; 4.МА моноклональные антитела; 5.МФА метод флюоресцирующих антител; 6.НЦМ нитроцеллюлозный мембранный фильтр; 7.РА реакция агглютинации; 8.РДП реакция диффузионной преципитации; 9.РИА радиоиммунологический анализ; 10.РНГА реакция непрямой гемагглютинации; 11.РСК реакция связывания комплемента; 12.СИ степень йодирования; 13.СФБ буферный раствор с NaCl; 14.ФБР фосфатно-буферный раствор. Геномика Геномика — это один из разделов молекулярной генетики, который изучает взаимодействие генов. Разделы геномики
1.Структурная геномика
Структурная геномика — содержание и организация геномной информации. Имеет целью изучение генов с известной структурой для понимания их функции, а также определение пространственного строения максимального числа «ключевых» белковых молекул и его влияния на взаимодействия[1][2].
