
- •1.Критерии аналитической надежности лабораторных исследований
- •6.Устройство, основные характеристики и правила настройки микроскопа. Основные микроскопические технологии.
- •7.Приготовление цитологического мазка, правила фиксации и окраски. Теория цитологических окрасок.
- •9.Основные этапы созревания гранулоцитов и моноцитов, опишите морфологические и цитохимические признаки клеток миелопоэза. Клиническое значение цитологического исследования клеток миелопоэза.
- •20.2.5.1. Фрагмент общей схемы
- •20.2.5.2. Антигеннезависимая дифференцировка
- •20.2.5.3. Антигензависимая дифференцировка
- •II. Проплазмоцит и плазмоцит
- •III. Активированные т-лимфоциты
- •14.Хронические миелопролиферативные заболевания. Патогенез, диагностика. Современные возможности лечения.
- •16.Острый миелолейкоз. Методы цитохимического анализа миелобластов.
- •18.Современные методы клинического исследования крови. Сравнительная характеристика и клиническое значение микроскопии мазка и исследования крови в гематологическом анализаторе.
- •20.Цитологические характеристики и клиническое значение исследования бластов в крови и препарате костного мозга.
- •25.Анемия хронических заболеваний. Этиология, патогенез, диагностика.
- •31.Стадии созревания мегакариоцитов, морфологические и иммунофенотипические характеристики. Структура и функция рецепторов тромбоцитов, роль арахидоновой кислоты, простациклин, тромбоксан.
- •33.Клиническое исследование мочи. Возможности визуальной колориметрии мочи в сравнении со стандартным клиническим исследованием.
- •3. Анализ мочи по Нечипоренко Процедура анализа :
- •4.1. Активированное парциальное (частичное) тромбопластиновое время (аптв)
- •4.2. Протромбиновое время
- •4.3. Тромбиновое время
- •51 . Ионометрия. Ионоселективные электроды. Кислотность среды и ее измерение. Индикаторы.
- •53.Нарушения обмена калия. Причины, методы диагностики. Гипокалиемия.
- •Диагностика
- •63.Диагностика сахарного диабета. Значение определения гликозилированного гемоглобина.
- •Лабораторные исследования : 1.Исследование уровня глюкозы в крови натощак Нормальным считается уровень глюкозы в пределах 3,5-5,5 ммоль/л.
- •6.Исследование гликированного гемоглобина
- •7.Исследование уровня фруктозамина в крови
- •8.Исследование липидов в крови
- •9.Исследование креатинина и мочевины
- •10 .Определение белка в моче
- •11.Исследование на кетоновые тела
- •Изменения фракции α2-глобулинов.
- •Изменения фракции β-глобулинов.
- •Изменения фракции γ-глобулинов.
- •Метод – колориметрический электрофорез Показания к назначению анализа - белковые фракции:
- •Лабораторная диагностика
- •2.Функциональная геномика
- •3.Сравнительная геномика
- •1.Обнаружение биомаркеров биологических процессов
- •2.Применения в медицине
- •3.Уточнение аннотации генома
- •4.Сравнительная протеомика
- •Основные методы Масс-спектрометрия
Диагностика
Лабораторные исследования Для этого берется анализ крови, с помощью его можно измерять общий холестерин, который нужно брать в любое время суток. Чтобы измерять содержание холестерина, лучше всего сдавать анализ крови натощак, после того как наступит 12 часов голодания.
С помощью биохимии крови можно проверит о липопротеинах высокой плотности, об окисленных липопротеинах низкой плотности, об липопротеинах низкой плотности. Специальные исследования • Определение концентрации холестерина в ЛПВП — обратная зависимость с количеством ТГ • Определение содержания аполипопротеина В (помогает выделить группу больных с умеренной гипертриглицеридемией и высоким риском ИБС) • КТ поджелудочной железы для диагностики панкреатита • Допплеровское исследование и ангиография для диагностики атеросклероза. Алгоритм определения липопротеидов в крови 1. Определяю уровень общего холестерина и триглицеридов 2. После преципитации липопротеидов , содержащих апо-В в супернатанте определяют холестерин ЛПВП 3. Общий холестерин = ЛПОНПхол + ЛПНПхол + ЛПВПхол 4. Для ориентировочной оценки холестиринв ЛПОНП используют величину ТГ(мг/дл)/5 или ТГ(ммоль/л)/2,2 5.При концентрации ТГ более 400 мг/дл расчет по этим формулам приводит к завышению холестерина ЛПОНП и занижению холестерина ЛПНП Методы определения содержания триглицеридов в крови 1)химические а) Триглицериды экстрагируются из сыворотки крови. Освобожденный в результате щелочного гидролиза глицерин окисляют до формальдегида с помощью метаперйодата натрия. Образовавшийся формальдегид образует с ацетилацетоном в слабом уксусном растворе 3,5-диацетил-1,4-дигидролютидин, интенсивность окраски которого пропорциональна содержанию триглицеридов. 2) ферментативные а) Ферментативные методы гораздо более удобны, хотя и они довольно сложны, так как включают в себя, по крайней мере, четыре отдельные реакции: 1) превращение триглицеридов в глицерин и в свободные жирные кислоты под действием липазы; 2) превращение глицерина и АТФ в глицерол-З-фосфат и АДФ с помощью глицеролкиназы; 3) окисление глицерол-З-фосфата до диоксиацетонфосфата с образованием перекиси водорода при участии глицеролфосфатоксидазы, 4) катализируемое пероксидазой превращение перекиси водорода, высвобождающейся в реакции 3, в хинонимин, концентрация которого измеряется фотометрически, как и при ферментативном определении холестерина Методы определения холестерина в крови 1)химические -прямые а) реакция Либермана-Бурхарда, в которой холестерин взаимодействует со смесью серной и уксусной кислот, а также уксусного ангидрида. Реакция протекает в сильнокислой безводной среде. В ходе реакции молекула холестерина последовательно окисляется и образуется окрашенное соединение холестагексаен - серная кислота с максимумами абсорбции при 410 и 610 нм. Развивающаяся окраска неустойчива, поэтому следует точно выдерживать время фотометрирования. б) реакция Киллиани-Зака - другой распространенный метод определения холестерина (реакция холестерина с солями железа, уксусной и серной кислотами). Эта химическая реакция протекает в присутствии ионов трехвалентного железа с последовательным формированием в молекуле холестерина двух, трех и четырех двойных сопряженных связей, при этом максимум поглощения образовавшихся соединений меняется от 420 до 563 нм. В реакции Киллиани-Зака свободный холестерин и его эфиры дают сходные цветные комплексы. -непрямые а) К непрямым методам относят приемы, когда липиды из сыворотки крови вначале экстрагируют органическими растворителями, а после упаривания проводят реакцию Либермана- Бурхарда. Такой метод более воспроизводим и точен, поскольку удается убрать интерферирующие вещества, остающиеся в водной фазе. Для экстракции используют системы этанолдиэтиловый эфир, этанол-ацетон, метанол-хлороформ; наиболее часто применяют гексан и изопропиловый спирт. Включение этапа экстракции повышает специфичность метода; результаты определения холестерина на 7% ниже, чем при прямом методе. 2)ферментативные а) Преимущества ферментативного определения: проведение реакции в водной фазе; удобство автоматизации; высокая чувствительность и специфичность.
Ферментативное определение холестерина также включает несколько этапов: 1.ферментативный гидролиз эфиров холестерина при действии холестеролэстеразы с образованием свободного холестерина и свободных жирных кислот; 2. окисление холестерина кислородом, растворенным в реакционной среде при действии холестеролоксидазы с образованием холест-4-ен-3-ола и Н2О2. В наиболее широко используемых методах образующаяся перекись водорода окисляет некоторые соединения с образованием хромогенов, которые могут быть измерены фотометрически.
Липидные
фракции и их свойства
1.
Альфа-ЛП – ЛПВП образуються в печени и
тонкой кишке , или в результате катаболизма
ХМ и ЛПОНП , необходимы для обратного
транспорта холнстерина
2. Бетта-ЛП –
ЛПНП образуються в результате катаболизма
ЛПОНП через ЛППП , необходимы для
транспорта холестерина
3.пребетта-ЛП
– ЛПОНП образуються в печени . необходимы
для транспорта энгогенных ТГц
4.флотирующие
бета-ЛП – ЛППП образуються в результате
катаболизма ЛПОНП , являються
прешественниками ЛПНП
5.ХМ – хиломикроны
образуються в тонкой кишке , транспортируют
экзогенные ТГц
Ультрацентрифугирование
липопротеинов крови
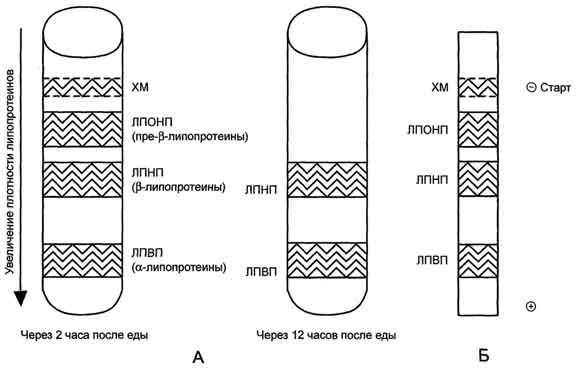 Рис.
8-19. Разделение липопротеинов сыворотки
крови
А
- метод ультрацентрифугирования. Б -
метод электрофореза в полиакриламидном
геле через 2 ч после еды.
Ультрацентрифугирование
липопротеинов крови в соответствии с
классификацией гиперлипидемий :
1 –
увеличение ХМ
2а – увеличение ЛПНП
2б
– увеличение ЛПНП и ЛПОНП
3
– остатки ХМ и увеличение ЛППП и ЛПОНП
4
– увеличение ЛПОНП
5 – увеличение ХМ
и ЛПОНП
Лечение
гиперлипидемии
Рис.
8-19. Разделение липопротеинов сыворотки
крови
А
- метод ультрацентрифугирования. Б -
метод электрофореза в полиакриламидном
геле через 2 ч после еды.
Ультрацентрифугирование
липопротеинов крови в соответствии с
классификацией гиперлипидемий :
1 –
увеличение ХМ
2а – увеличение ЛПНП
2б
– увеличение ЛПНП и ЛПОНП
3
– остатки ХМ и увеличение ЛППП и ЛПОНП
4
– увеличение ЛПОНП
5 – увеличение ХМ
и ЛПОНП
Лечение
гиперлипидемии
Диета должна содержать низкий уровень холестерина, для этого нужно уменьшить употребление продуктов, в состав которых входят насыщенные жиры.
Справится с высоким уровнем холестерина помогут физические упражнения. Помните о том, что в данной ситуации нужно отказаться от употребления алкоголя, потому что он влияет на показатель ЛПВП.
Чтобы избавится от гиперлипидемии, нужно избавиться от лишнего веса, для этого нужно забыть о вредных привычках – алкоголе, курении, заниматься спортом, пить специальные медикаментозные средства. Если в крови содержится слишком много жира и обычное лечение не помогает, нужно дополнительно обследоваться, сдать специальные анализы, для того, чтобы узнать о причине и специфическом лечении.
59.Фотометрические методы исследования. Корпускулярно-волновая природа света. Классификация фотометрических методов анализа. Колориметры и фотометры. Спектрофотометры. Характеристики и примеры абсорбциометрических приборов. Принципы и клиническое применение флюориметрического анализа. Хемилюминесцентный анализ. Фотометрия – раздел физической оптики и измерительной техники, посвященный методам исследования энергетических характеристик оптического излучения в процессе его испускания, распространения в различных средах и взаимодействия с телами. Фотометрию проводят в диапазонах инфракрасного (длины волн – 10 –3…7·10 –7 м), видимого (7·10 –7…4·10 –7 м) и ультрафиолетового (4·10 –7…10 –8 м) оптических излучений. Методы : 1. Концентрационная колориметрия Колориметрия (лат. сolor – цвет) – это физико-химический метод исследования состава биосред по степени окраски их растворов. Основан на визуальных и фотометрических измерениях. Известно , что количественной характеристикой цвета является концентрация красящего вещества в растворе.
2. Оксигемометрия Оксигемометрия (лат. oxygenium – кислород, греч. haima - кровь) – метод определения степени насыщения крови человека кислородом для оценки эффективности функции внешнего дыхания. Основан на различиях спектров поглощения у оксигемоглобина и восстановленного гемоглобина. Восстановленный гемоглобин в растворах поглощает проходящий красный цвет (λкр = 620…680 нм) во много раз сильнее, чем раствор оксигемоглобина
3. Поляриметрия Это метод определения концентрации вещества по углу поворота плоскости поляризации монохроматического плоскополяризованного излучения оптического диапазона при прохождении его через оптически активные среды. Концентрацию оптически активных веществ можно найти, регист-рируя вращение плоскости поляризации.
4. Нефелометрия Нефелометрия (греч. nephele – облако) – оптические методы определения концентрации, размеров и формы частиц в дисперсных средах
В лабораторных и клинических исследованиях методы нефелометрии применяют для определения концентрации белка в растворах, регистрации компонентов в сыворотке крови, оценки качества питьевой воды, определения концентрации пыли в воздухе. 5. Другие методы медицинской фотометрии Люминесцентный анализ – метод исследования биосред , основанный на наблюдении их люминесценции. Используют фото и био химиолюминесценцию. Фотолюминесценция возникает через ~10-8 c после первичного облучения биосреды ультрафиолетовым излучением. Спектр люминесценции смещен в область больших длин волн (закон Стокса).
Метод первичной люминесценции – это предварительное облучение исследуемой области биоструктуры ультрафиолетовым излучением и наблюдение люминесценции в видимом спектре. Таким образом можно определить подкожные кровоизлияния, аномалии пигментации кожи, раннюю стадию гепатита и даже кариес зубов, а также наличие некоторых биоорганизмов. Метод вторичной люминесценции предполагает введение в орга-низм малых концентраций вещества, обладающих свойствами люми-несценции. Люминесцентный анализ применяют для исследования качества продуктов питания, их загрязнения, в судебной медицинской экспертизе. Медицинская спектрофотометрия – это метод определения спектральных характеристик вещества на основе биопроб. В медико-биологических исследованиях применяется анализ атомных и молекулярных спектров поглощения. Для реализации метода используются специальные фотометры. Диафанография – это метод визуализации внутреннего строения мягких биотканей в видимом и инфракрасном диапазонах оптического излучения путем их просвечивания. Основан на различной оптической прозрачности биотканей. Преимущества метода – простота технической реализации (ис-точник света – осветительная электролампа накаливания) и безвредность. Недостаток – большая неточность (частота ложных заключений в три раза больше, чем при рентгеновских и ультразвуковых исследо-ваниях). Метод преимущественно используется для визуализации патологий у новорожденных. Физиологическая оптика – это совокупность методов для изучения процесса восприятия света глазом человека – офтальмометрия, рефрактометрия, адаптометрия, цветовосприятие. Медицинская фотография – это метод исследований, основанный на получении на светочувствительных материалах изображения объектов, отдельных органов и биоструктур в целях диагностики и отражения динамики патологических процессов, а также результатов лечения. Различают специальные методики: микрофотографию, полостную фотографию, фотографирование в инфракрасном и ультрафиолетовом диапазонах, полостную голографию.
Корпускулярно-волновая природа света : 1.свет – поток частиц ( квантов) 2.энергия каждого кванта определяеться длинной волны излучения 3. В основном энергетическом состоянии электроны в атоме занимают самые нижние электронные уровни 4.при поглощении кванта энергии электрон переходит в возбужденное состояние 5.переход элетрона из возбужденного в основное состояние сопровождаеться излучением энергии определенных длин волн Классификация фотометрических методов анализа Фотометрические методы анализа делятся на следующие: - абсорбционный (поглощение раствором световой энергии); - нефелометрический (рассеяние световой энергии дисперсной средой); - флуориметрический (излучение раствором световой энергии, вызванной световой энергией возбуждения); - рефлектометрия (измерение интенсивности энергии, отраженной от твердофазной среды); - турбидиметрический (сочетание поглощения и рассеяния световой энергии дисперсной средой); - хемилюминесцентный (излучение раствором световой энергии в результате химической реакции). А так же методы фотометрического анализа подразделяются на две группы:
1) спектрофотометрия - метод основан на измерении поглощения монохроматического излучения с определенной длиной волны (получают с помощью монохроматора);
2) фотоколориметрия - метод основан на измерении поглощения полихроматического излучения, т.е. пучка света с близкими длинами волн (получают с помощью светофильтров).
Спектрофотометрия является наиболее строгим и точным методом, фотоколориметрия применяется в основном для анализа окрашенных растворов. Основой количественного фотометрического анализа является основной закон светопоглощения Бугера-Ламберта-Беера (БЛБ), который связывает интенсивность поглощения с концентрацией вещества в анализируемом растворе (С) и толщиной поглощающего слоя (кюветы, l в см). В логарифмической форме этот закон имеет вид: А=k·С·l, где k - коэффициент поглощения, характерный для данного вещества при определенной длине волны. Если концентрация выражена в моль/л, то k называется молярным коэффициентом поглощения (e, моль-1·л·см-1), если в г/л - массовым (а, г-1·л·см-1). Фотометр - прибор для измерения каких-либо из фотометрических величин, чаще других - одной или нескольких световых величин. При использовании фотометра осуществляют определённое пространственное ограничение потока излучения и регистрацию его приёмником излучения с заданной спектральной чувствительностью. Освещённость измеряют люксметрами, яркость - яркомерами, световой поток и световую энергию - с помощью фотометра интегрирующего. Приборы для измерения цвета объекта называют колориметрами. Если в качестве приёмника используется глаз, фотометры называются визуальными, или зрительными, если же применяется какой-либо физический приёмник, фотометры называются физическими. Оптический блок фотометра, иногда называемый фотометрической головкой, содержит линзы, светорассеивающие пластинки, ослабители света, светофильтры, диафрагмы и приёмник излучения. Колориметр - прибор для измерения цвета в какой-либо цветовой шкале или для сравнения интенсивности окраски исследуемого раствора со стандартным. Используются как составная часть автомата для смешивания красок из нескольких основных цветов.
Спектрофотометр —
прибор, предназначенный для измерения
отношений двух потоков
оптического излучения,
один из которых — поток, падающий на
исследуемый образец, другой — поток,
испытавший то или иное взаимодействие
с образцом. Позволяет производить
измерения для различных длин
волн оптического
излучения,
соответственно в результате измерений
получается спектр отношений
потоков. Обычно используется для
измерения спектров пропускания или
спектров отражения излучения.
Спектрофотометр является основным
прибором, используемым
в спектрофотометрии
 Применяется
в колориметрии и спектральном
анализе.
Применяется
в колориметрии и спектральном
анализе.
Спектрофотометры могут работать в различных диапазонах длин волн — от ультрафиолетового до инфракрасного. В зависимости от этого приборы имеют разное назначение
Спектрофотометр.В медицине используется для измерения концентрации белков и нуклеиновых кислот; оценка кровоснабжения тканей на основе измерений степени оксигенации гемоглобина;определение концентрации различных лекарственных средств; отслеживание динамики размножения микроорганизмов по изменению оптической плотности среды. Абсорбциометрические приборы и их характеристика : Основное назначение современных абсорбциометрических приборов - определение концентрации образца с исследуемым веществом посредством сравнения величин поглощения или пропускания световой энергии исследуемого образца и образца известной концентрации. В настоящее время в практических лабораториях можно встретить самые различные по конструкции и характеристикам колориметры, фотометры и спектрофотометры. Каждый из используемых в лабораториях фотометров имеет следующие характеристики: 1) спектральный диапазон — длины волн, в которых работает прибор. В большинстве случаев фотометры работают в спектральном диапазоне 340—700 нм; 2) динамический диапазон измерения. Обычно диапазону оптических плотностей от 0 до 2 соответствует диапазон по светопропусканию от 100 до 1%; 3) максимальный и минимальный объем фотометрируемого раствора. Эти объемы определяются объемами измерительных кювет, при этом минимальный допустимый объем раствора — объем, при котором возможно получение гарантированных результатов измерений. На современных фотометрах можно работать в диапазоне 10—500 мкл; 4) метрологические характеристики фотометрических приборов; 5) градуировка прибора — процесс построения калибровочной кривой, по которому в дальнейшем проводится градуировка прибора. Приборы высокого класса имеют энергонезависимое запоминающее устройство, позволяющее сохранять градуировочные характеристики в течение длительного времени; 6) способы отображения и регистрации информации. В приборах используются стрелочные, цифровые и алфавитно-цифровые индикаторы, принтеры самых разных конструкций. В клинико-диагностических лабораториях в настоящее время используются самые разные виды фотометров. Это обычные фотометры типа КФК-2, КФК-3, ФЭК, программируемые фотометры типа МИНИЛАБ 501 (программируемый фотометр для биохимических исследований по конечной точке в моно- и бихроматическом режиме). В памяти фотометра хранится до 50 программ, он имеет встроенный термостат, объем кюветы 1 мл; МИНИЛАБ 502 — кинетический программируемый фотометр для исследования активности ферментов и определения концентрации метаболитов кинетическими методами с встроенным термостатом. Принципы и клиническое применение флюориметрического анализа Флюориметрические и другие современные методы определения общего белка (например, поляриграфический микрометод или атомно-абсорбционный анализ) обладают высокой чувствительностью и специфичностью, однако необходимость ввода специальной аппаратуры, а иногда и специальной квалификации аналитика наряду с достаточно высокой стоимостью определения делает этот метод достоянием научно-исследовательских учреждений и значительно ограничивает его использование в клинической лаборатории. Люминесцентный (флуориметрический) анализ основан на измерении излучения (интенсивности или суммы света), возникающего в результате выделения избыточной энергии возбужденными молекуламианализируемого вещества. В основе разнообразных химических и физико-химических методов анализа лежат, как правило, реакции трех типов кислотноосновные,окислительно-восстановительные и комплексообразования. Значение их в практике анализа примерно одинаково, но научные исследованиясосредоточены преимущественно вокруг реакций двух последних типов.Теория кислотно-основных взаимодействий неплохо разработана, здесь многое давно устоялось. Правда, в настоящее время внимание привлечено ккислотно-основным реакциям в неводных растворах. Окислительно-восстановительные реакции находят все новые применения в разнообразных физико-химических методах анализа, и поэтому их исследуют весьма интенсивно. Однако особенно большое значение имеетизучение процессов комплексообразования— для фотометрического и флуориметрического анализа с использованием органических реагентов,кинетических методов анализа, методов разделения элементов. Флуориметрический анализ лекарственных препаратов. Хинин является одним из представителей большого семейства лекарственных препаратов, которые можно определять с большой чувствительностью флуориметрически или фосфориметрически. Подобно хинину, некоторые из этих лекарственных и физиологически активных веществ флуоресцируют непосредственно иные могут образовывать люминесцирую-щие комплексы с другими органическими веществами. В качестве примера рассмотрим флуориметрическое определение диэтиламида лизергиновой кислоты (ЛСД), которая имеет следующую структурную формулу Хемилюминесцентный анализ
Хемилюминесценция – это процесс излучения фотонов при переходе электронно-возбужденных продуктов окислительных химических реакций в исходное энергетическое состояние. В таких реакциях выделяется значительное количество энергии и квантовый выход излучаемого света достаточно высок.
Из всех неизотопных методов хемилюминесценция обеспечивает наиболее высокую чувствительность. Для иммунометрических методов чувствительность хемилюминесценции на порядки превосходит чувствительность радиоиммуноанализа.
1. оценки эффективности терапии у пациентов с раком предстательной железы
2. определения прогрессирования рака после неадекватного лечения
3. определения развития метастазов после лечения первичной опухоли
4. скрининг мужчин старше 50 лет для раннего выявления опухоли предстательной железы
60.Методы и единицы измерения активности ферментов плазмы крови. Лабораторная диагностика заболеваний печени. Аланиновая и аспартатаминотрансферазы. γ-Глютамилтранспептидаза. Щелочная фосфатаза. Гепатоцитолиз. Холестаз. Чаще всего для определения активности ферментов в клинико-диагностических лабораториях используют плазму. Ферменты, выявляемые в плазме, условно делятся на три группы: - собственные ферменты плазмы, выполняющие свои функции только в сосудистом русле (ферменты свертывания крови, холинэстераза, церулоплазмин); - экскреторные ферменты, попавшие в плазму из секретов (дуоденального сока, слюны); -клеточные ферменты, попавшие в плазму из поврежденного органа. Появление, степень, длительность сдвига ферментативной активности ферментов в плазме или сыворотке крови обусловлены несколькими причинами: размерами и степенью повреждения клеток, величиной молекул фермента, его внутриклеточной локализацией, прочностью связей со структурными элементами клеток, влиянием разных факторов на активность и скорость деградации фермента в клетках. Каждый орган в организме имеет определенный спектр ферментов. Его характеристикой может быть более или менее типичная группа ферментов, типичная энзиматическая констелляция. Это позволяет с помощью определения группы органоспецифических ферментов получать сведения о функциях отдельных органов организма. Обычно ферментодиагностика — это определение ряда ферментов. Моноорганоспецифических ферментов практически не существует. Измеряемая в сыворотке крови активность ферментов — результат совместной и согласованной работы клеточных структур (процессов синтеза и распада ферментов), функции мембран, скорости инактивации. Кроме того, на активность ферментов в крови значительное влияние оказывает продолжительность жизнедеятельности. Для основного числа ферментов период полураспада составляет от 10 до 120 ч. При этом ферменты с коротким периодом полураспада лучше отражают процессы, протекающие в органе. Для определения ферментативной активности используют следующие методы: 1. Химический метод – количественное определение субстрата или продуктов с помощью химических реагентов (О-гликозилгидролазы – по образованию восстанавливающих сахаров). 2. Спектрофотометрический метод – измерение скорости ферментативной реакции по изменению поглощения субстрата при характеристической длине волны (лиазы – по образованию двойной связи). 3. Манометрический метод – определение количества газа, выделяющегося в процессе реакции (оксидазы – по поглощению О2, декарбоксилазы – по выделению СО2). 4. Поляриметрический метод – фиксируется изменение оптического вращения (β-фруктофуранозидаза). 5. Хроматографический – количественное определение субстрата или продуктов с помощью различных видов хроматографии: бумажной (анализ сахаров), тонкослойной (гликозидов со сложными агликонами), ВЭЖХ (аминокислотный анализ и др.). Определение активности ферментов наиболее широко используется при диагностике как первичных врожденных ферментопатий, так и вторичных, т.е. развивающихся в результате патологических нарушений на клеточном и субклеточном уровнях. Лабораторная диагностика заболеваний печени Методы диагностики
На начальном этапе специалист собирает жалобы пациента, оценивает симптомы и клиническую картину. Затем всем больным в обязательном порядке назначается общий анализ крови. На инфекционные и паразитарные заболевания печени указывает повышение уровня лейкоцитов. Алкогольные поражения печени часто сопровождаются увеличением уровня холестерина и концентрации глюкозы.
Лабораторное исследование плазмы на содержание альбуминов — один из важных этапов диагностики. Альбумины — белки крови — синтезируются печенью, поэтому резкое увеличение или уменьшение их объема говорит о заболеваниях органа. Кроме этого, кровь изучают на содержание таких веществ:
АЛТ,
билирубин общий и прямой,
АСТ,
ГГТТ,
щелочная фосфатаза,
холинэстераза.
Обязателен также тест на протромбиновый индекс.
При подозрениях на вирусный гепатит проводится лабораторное исследование крови на сывороточные белки (иммуноглобулины). Такой метод диагностики поможет подтвердить или опровергнуть наличие вируса. Для определения его типа требуется пройти тест на конкретные маркеры гепатита:
антитела,
антигены,
нуклеиновые кислоты.
^ Аспартатаминотрансфераза (ACT) ACT (сывороточная глутаматоксалоацетаттрансаминаза, СГОТ) широко распространена с высокими концентрациями в сердце, печени, скелетных мышцах, почках, эритроцитах. Поражение любой из этих тканей может привести к повышению концентрации ACT в сыворотке крови. Фермент АСТ синтезируется внутриклеточно, и в норме только малая часть его попадает в лимфу и кровь. При наличии повреждений печени (холангит, гепатит, первичный и метастазирующий рак печени) и сердца (инфаркт миокарда) в результате процесса разрушения клеток(цитолиза) АСТ попадает в системный кровоток, что можно выявить с помощью лабораторных методов.Аспартатаминотрансфераза
Повышение аспартатаминотрансферазы АСТ, которое превышает повышенный уровень аланинаминотрансферазы (АЛТ), наиболее характерно для повреждений сердечной мышцы; в случаях если показатель аланинаминотрансферазы превышает уровень АСТ, то это, как правило, говорит о процессах разрушения клеток печени.
Референтные величины (норма аспартатаминотрансферазы в сыворотке крови, то она составляет 10−30 МЕ/л. ^ Причины повышения активности ACT 1. Артефакты: гемолиз in vitro или замедленное отделение плазмы от клеток. 2. Физиологические: у новорожденных активность ACT приблизительно в 1,5 раза выше, чем у здоровых взрослых. 3. Значительное повышение (в 10—100 раз, по сравнению с нормой): а) инфаркт миокарда; б) вирусный гепатит; в) токсический некроз печени; г) недостаточность кровообращения с шоком и гипоксией. 4. Умеренное повышение: а) цирроз (до 2 раз по сравнению с нормой); б) обтурационная желтуха (до 10 раз по сравнению с нормой); в) злокачественная инфильтрация печени; г) заболевание скелетной мускулатуры; д) после травмы или хирургической операции (особенно операции на сердце); е) тяжелая гемолитическая анемия; ж) инфекционный мононуклеоз (поражение печени). ^ Аланинаминотрансфераза (АЛТ] АЛТ (сывороточная глутаматпируваттрансаминаза, СГПТ) содержится в высоких концентрациях в печени и в меньших количествах в скелетных мышцах, почках и сердце. АЛТ представляет собой особый эндогенный фермент. Его включают в группу трансфераз и подгруппу аминотрансфераз. Синтез данного фермента проходит внутриклеточно. В кровь поступает его ограниченное количество. Поэтому когда биохимический анализ показывает повышенное содержание АЛТ, это свидетельствует о наличии ряда отклонений в организме и развитии серьезных заболеваний. Часто они связаны с разрушением органов, которое и приводит к резкому выбросу в кровь фермента. В результате чего активность аланинаминотрансферазы также усиливается. Установить обширность некроза или степень поражения заболеванием тканей на основе этого трудно, так как для фермента не характерна органная специфичность.
Аланинаминотрансфераза содержится во многих органах человека: почках, сердечной мышце, печени и даже скелетной мускулатуре. Основная функция фермента заключается в обмене аминокислот. Он выступает в роли катализатора для обратимых переносов аланина из аминокислоты для альфа-кетоглутарата. В результате переноса амино-группы получается глутаминовая и пировиноградная кислоты. Аланин в тканях организма человека необходим, так как является аминокислотой, способной быстро превращаться в глюкозу. Таким образом возможно получение энергии для работы головного мозга и центральной нервной системы. Кроме того, среди важных функций аланина укрепление иммунной системы организма, выработка лимфоцитов, регуляция обмена кислот и сахаров. АЛТ может сопоставляться с АСТ для получения дополнительной информации о причинах повреждения печени. Осуществляется это, если количество ферментов значительно превышает норму. Отношение АСТ к АЛТ известно в медицине как коэффициент де Ритиса. Его нормальное значение колеблется от 0,91 до 1,75. Если данный показатель становится больше 2, то диагностируется поражение сердечной мышцы, протекающее с разрушением кардиомицитов. Возможен также инфаркт Миокарда. Коэффициент де Ритиса, не превышающий 1, свидетельствует о заболеваниях печени. Причем чем ниже оказывается значение показателя, тем больше риск неблагоприятного исхода.
У мужчин верхняя граница показателя составляет 40 Ед/л.У женщин – 30 Ед/л. АЛТ свидетельствует о восполительном процессе в организме , а так же он повышаеться у беременных .
^ Причины повышения активности АЛТ 1. Значительное повышение (в 10—100 раз по сравнению с нормой): а) вирусный гепатит; б) токсический некроз печени; в) недостаточность кровообращения с шоком и гипоксией. 2. Умеренное повышение: а) цирроз (до 2 раз по сравнению с нормой); б) обтурационная желтуха (до 10 раз по сравнению с нормой); в) отек печени как следствие сердечной недостаточности; г) инфекционный мононуклеоз (поражение печени); д) тяжелая травма и заболевание мышц (значительно меньшее повышение, чем в случае ACT). ^ Щелочная фосфатаза (ЩФ) Щелочные фосфатазы представляют собой группу ферментов, катализирующих гидролиз фосфатов при щелочных значениях рН. Рутинные методы анализа дают представление о суммарной активности нескольких изоферментов ЩФ. Их определяют в костях, печени, почках, стенке кишечника, лактирующих молочных железах и плаценте. В костной ткани ЩФ обнаруживают в остеобластах, где она, по-видимому, имеет важное значение при костеобразовании в норме. У взрослых свойственный норме уровень ЩФ обеспечивается преимущественно ее поступлением из печени. У детей, у которых активность остеобластов очень высока, дополнительным источником поступления ЩФ является костная ткань, чем у них объясняется более высокий уровень суммарной активности ЩФ. Усиленный рост в период полового созревания сопровождается еще большим нарастанием активности ЩФ. У пожилых возможно повторное небольшое повышение активности изоэнзима, характерного для костной ткани. Как у взрослых, так и у детей поступление ЩФ из кишечника вариабельно. При беременности нормальный уровень ЩФ повышается из-за образования в плаценте термостабильной ЩФ. Изоэнзим, подобный плацентарному (изоэнзим Ригена, названный по фамилии первого больного, у которого он был обнаружен), может образоваться в злокачественных опухолях, особенно бронхиальных. ^ Причины повышения активности ЩФ в плазме крови 1. Физиологические: а) у детей, не достигших половой зрелости, активность ЩФ в 2—2,5 раза выше, чем у здоровых взрослых; б) в период бурного роста, сопровождающего половое созревание, активность ЩФ может быть в 5—6 раз выше, чем у здоровых взрослых; в) беременность (во время последнего триместра). 2. Заболевания костной системы: а) остеомаляция и рахит; б) первичный гиперпаратиреоз с поражением костной ткани; в) болезнь Педжета костной системы (активность ЩФ может быть очень высока); г) вторичная карцинома костей; д) некоторые случаи остеогенной саркомы. 3. Заболевания печени: а) внутри или внепеченочный холестаз; б) патологические образования, занимающие пространство — опухоли, гранулемы, инфильтраты. 4. Злокачественные новообразования — поражение костей или печени, а также непосредственное образование ЩФ. Низкая активность ЩФ в плазме крови. 1. Остановка роста костей: а) ахондроплазия; б) кретинизм; в) недостаточность витамина С. 2. Гипофосфатазия. Изоферменты ТДФ.Наиболее распространенными причинами повышения активности ЩФ в плазмекрови являются заболевания костей (с повышением активности остеобластов) или печени (с поражением желчных протоков). Если на основании клинического обследования причина повышения активности ЩФ в плазме крови не становится ясной, может оказаться необходимым проведение дополнительных тестов. Методом электрофореза можно разделить изоэнзимы ЩФ, поступающие из костей, печени, кишечника и плаценты, но интерпретация полученных результатов может быть затруднена, особенно, если повышено содержание фракций, характерных как для костной ткани, так и для печени, или если суммарная активность ЩФ повышена лишь незначительно. Результаты повторного электрофоретического исследования, проведенного после прогревания плазмы, могут быть информативными. Печеночный изоэнзим более термостабилен, чем костный. Уменьшение содержания последнего изоэнзима может стать очевидным после сопоставления первой и второй электрофореграмм. Плацентарный изоэнзим еще более термостабилен, и методы термоинактивации можно использовать для выяснения вопроса о повышении содержания костной и/или печеночной фракций при беременности. ^ Глутамилтрансфераза (ГГТ) ГГТ - фермент, который можно обнаружить во многих паренхиматозных органах. Он участвует в обмене нуклеиновых кислот и «строительстве» молекул белка. Больше всего гамма-глутамилтранспептидазы содержат почки, печень и поджелудочная железа. Кроме того, фермент присутствует в мозге, кишечнике, селезёнке и скелетных мышцах, в предстательной железе. Внутри клетки ГГТ находится в мембране, в цитоплазме, в лизосомах. Определение уровня ГГТ в крови используется для диагностики заболеваний печени. Глутамилтрансфераза (углутамилтранспептидаза) встречается преимущественно в печени, почках и поджелудочной железе. Повышение уровня ГГТ в плазме крови, однако, почти всегда связано с поражениями печени и возможно при следующих условиях: 1) при заболеваниях печени, сопровождающихся холестазом. Обычно в этих случаях имеется параллелизм между нарастанием содержания ГГТ и ЩФ. При обтурационной желтухе беременных уровень ГГТ не нарастает; 2) при индуцировании лекарственными средствами. Многие лекарственные средства, из которых наиболее широко распространены против осудорожныс препараты и алкоголь, индуцируют биосинтез ГГТ. Поэтому значение небольшого или умеренного (в 2—3 раза, по сравнению с нормой) повышения содержания ГГТ особенно трудно интерпретировать. Прежнее мнение о том, что оно обусловлено злоупотреблением алкоголем, по-видимому, является несправедливым по отношению к больному. Значительно повышенные уровни ГГТ, не соответствующие таковым трансаминаз, предполагают следующее: 1) алкогольный гепатит или злоупотребление алкоголем; 2) индуцирование противосудорожными средствами. Гепатоцитолиз Это разрушение печеночных клеток Наблюдаеться чаще всего при остром гепатите . Синдром гепатоцитолиза - повышение АЛТ, АСТ, гамма-глютамиптранспептидазы, ЛДГ5, сывороточного железа и витамина В12. Холестаз Холестаз обусловлен нарушением секреции желчи гепатоцитами, что приводит к накоплению в плазме некоторых или всех веществ, которые в норме экскретируются с желчью. Первичное поражение — нарушение секреции желчных кислот, что может быть обусловлено: обратным давлением, создающимся в ре зультате закупорки (внутри или внепеченочной) желчных протоков; угнетением секреторного механизма в условиях инфекционных болезней, воздействий лекарственных средств, гипоксии или других, часто неидентифицированных, метаболических факторов. Наиболее широко используемый ппдпкатор холестаза — содержание в плазме фермента щелочная фосфатаза (ЩФ). При холестазе стимулирован биосинтез ЩФ на синусоидальной поверхности гепатоцитов. Кроме того, если давление в желчных протоках нарастает, ЩФ, которая уже была секретпрована в желчевыводящие пути, может поступать вместе с другими компонентами желчи обратно в синусоиды и таким образом проникать в систему кровообращения. В случаях внепеченочной закупорки желчных протоков содержание ЩФ в плазме максимальное. При холестазе обычно, но не всегда, происходит задержка в организме билирубина (преимущественно конъюгированного), что сопровождается желтухой и билирубинемией. Кроме того, нарушается экскреция холестерина и повышается его содержание в плазме. В тяжелых случаях холестаза, особенно при установленном билиарном циррозе, могут развиваться ксантомы.
61.Биохимическая диагностика инфаркта миокарда. Креатинкиназа. Лактатдегидрогеназа. Другие биохимические показатели повреждения миокарда Инфаркт-некроз сердечной мышцы в следствии острого соответствия потребности миокарда в кислороде и его доставке. Он развиваеться при коронарном атеросклерозе,сопровождающемся тромбозом коронарных артерий . Клиника : 1.Болевой синдром-боль длится часами и сопровождается страхом смерти, носит сжимающий , давящий характер, может сопроваждаться тошнотой , метеоризмом . Не купируеться нитроглицерином . При аускультации сердца — приглушение 1 тона(снижение сократительности миокарда) и появление дополнительного 3 тона (ритм галопа)-дисфункция сосочковых мышц,шум трения перикарда. 2.Кардиогенный шок 3.Сердечная недостаточность с отеком легкого 4.Нарушение ритма и проводимости Лабораторные исследования : 1). Общий анализ крови: симптом ножниц: к концу первых суток лейкоциты повышаются (до 10-12 тыс.), а к концу недели приходят в норму. СОЭ с 4-5- дня начинает расти и держится до 20 дней (что отражает белковые сдвиги в крови). 2). Биохимические анализы крови: в крови повышаются трансаминазы (АСТ, АЛТ), ЛДГ и КФК (креатинфосфокиназа) и Тропонины Основные принципы биохимического исследования: а). Временные параметры - АСТ и КФК появляются через 5-6ч после ИМ, а нормализируются - АСТ через 30-36 ч, а КФК - через 1 сутки. ЛДГ повышается через 12-14ч и держится 2-3 недели. б). Динамичность исследования - анализы берутся 2-3 раза в неделю. в). Органоспецифичность ферментов: фракции КФК - ММ (в мозгу), МВ (в сердце), ВВ (в мышцах). Надо исследовать КФК (МВ). Фракции ЛДГ - 1-2 (ИМ), 3 (ТЭЛА), 4-5 (поражение печени или ПЖ). Также в крови исследуют ЦРБ (при ИМ - 1-3 креста) и фибриноген (повышен - более 4 тыс. мг/%). 3) Маркеры : 1. Ранние маркеры некроза миокарда а)Миоглобин (дыхательный пигмент, широко представленный в мышечной ткани человека. Содержание миоглобина при ИМ повышается в сыворотке крови наиболее рано — в пределах 2 ч после возникновения симптомов. Он в неизмененном виде выводится мочой и к 24-му часу с момента начала симптомов исчезает из кровотока. Существуют методики, позволяющие определить концентрацию миоглобина в крови в течение 10 мин. Большое содержание миоглобина в скелетной мускулатуре и зависимость его концентрации от функции почек делают его неспецифичным в отношении некроза миокарда и ограничивают его применение для диагностики ИМ. б)МВ-КФК (сердечная форма креатинфосфокиназы — КФК) КФК — фермент, широко представленный в мышечной ткани человека. Изолированное определение в крови общей КФК в .настоящее время большинством экспертов признано нецелесообразным для диагностики ИМ из-за высокого содержания этого фермента в скелетной мускулатуре и низкой специфичности в отношении некроза миокарда . МД-КФК при ИМ появляется в сыворотке крови через 3—4 ч после начала симптомов и достигает диагностически значимого уровня к 4—6-му часу. Повышенный ее уровень сохраняется 48—72 ч. Доля МВ-КФК среди общей КФК, превышающая 5—6%, является специфичным признаком некроза миокарда. Однако хроническая почечная недостаточность, травматичные операции, гипотиреоз, некоторые онкологические заболевания, инсульты, миастении могут привести к повышенному уровню МВ-КФК в крови и гипердиагностике ИМ . При использовании MB-КФК для диагностики ИМ необходимо повторно определять концентрацию этого маркера в крови. Экспертами Европейского кардиологического общества (ЕКО) в настоящее время считается предпочтительным для диагностики ИМ определять массу МВ-КФК, а не активность этого фермента в крови. в)Сердечная форма белка, связывающего жирные кислоты В последние десятилетия внимание исследователей обращено на сердечную форму белка, связывающего жирные кислоты (сБСЖК) сБСЖК по последовательности аминокислот идентичен БСЖК, содержащемуся в поперечнополосатой мышечной ткани скелетных мышц, однако представлен в скелетной мускулатуре в минимальном количестве. Максимальное количество сБСЖК находится в ткани миокарда — 0,5 мг/г. Единственная мышца, в которой имеется относительно большое количество сБСЖК, — это диафрагма (примерно 25% от содержания в ткани миокарда) . Некоторое количество сБСЖК содержится в тканях аорты, и можно предположить, что содержание его повышается, в крови при расслаивающей аневризме аорты. Согласно данным Т. Borhers и соавт., в цитоплазме содержится 3,18 мкг сБСЖК на 1 мг белка, в митохондриях — 0,18 мкг, а в ядре — 0,03 мкг. Так как сБСЖК в основном свободно расположен в цитоплазме клеток, в случае повреждения клеточной мембраны кардиомиоцита он быстро попадает в кровоток [28, 29]. В крови здоровых людей циркулирует небольшое количество сБСЖК. Было выявлено, что в крови у женщин уровень сБСЖК достоверно ниже, чем у мужчин (0,7 мкг/л против 1,2 мкг/л; p<0,005). Различие в содержании в крови сБСЖК между мужчинами и женщинами, по-видимому, связано с большей мышечной массой у первых . Таким образом, определение содержания сБСЖК в крови больных с ОКС с целью раннего выявления некроза миокарда представляется перспективным. Однако из-за небольшого количества исследований нет единого мнения экспертов в отношении целесообразности определения сБСЖК при ОКС и он пока не рекомендован для использования в широкой клинической практике. 2. Поздние маркеры а) Лактатдегидрогеназа (ЛДГ) ЛДГ — цитозольный белок с молекулярной массой 135 кДа, использующийся в клинической практике на протяжении четырех десятилетий. ЛДГ имеет пять изо-энзимов. В сердечной мышце содержится преимущественно изоэнзим ЛДГ-1. При ИМ концентрация ЛДГ начинает превышать нормальный уровень через 14—48 ч после начала симптомов, достигает максимального значения на 3—6-е сутки заболевания и возвращается к норме на 7—14-е сутки болезни [39]. ЛДГ-1 была обнаружена также в эритроцитах, почках, мозге, желудке, повышение концентрации этого белка в крови больных далеко не всегда связано с некрозом миокарда . Отношение ЛДГ-1/ЛДГ-2, превышающее 0,76, обладает 90% специфичностью при выявлении некроза миокарда . Это соотношение может увеличиваться и в случае отсутствия ИМ, если у больного имеются массивный гемолиз, мегалобластическая анемия, распространенное повреждение скелетных мышц, тяжелое заболевание печени. Из-за позднего повышения концентрации ЛДГ в сыворотке крови этот маркер не применяется для ранней диагностики ИМ и суждения об успехе тромболитической терапии, однако ЛДГ длительно использовалась для диагностики ИМ в поздние сроки заболевания б) Аспартатаминотрансфераза (АсАТ) АсАТ несколько десятилетий используется для диагностики ИМ. У больных ИМ уровень АсАТ превышает норму через 8—12 ч после начала боли, достигает максимального значения к 24—З6-му часу и возвращается к норме за 3—4 дня. Большое количество этого фермента содержится в тканях печени, что сильно снижает его специфичность в отношении некроза миокарда . АсАТ неудобна как для ранней, так и для поздней диагностики ИМ, она используется только в сочетании с более чувствительными и специфичными маркерами. Низкая специфичность в отношении некроза миокарда послужила причиной того, что использование этого маркера, как и ЛДГ, для диагностики ИМ в настоящее время также признано нецелесообразным . в) Сердечные тропонины I и Т Тропониновый комплекс, регулирующий процесс мышечного сокращения в кардиомиоцитах, состоит из трех субъединиц: Т, I и С . Сердечные тропонины и тропонины скелетных мышц имеют различную аминокислотную последовательность, что позволяет создавать высокоспецифичные диагностикумы для определения концентрации сердечных тропониновI и Т (сТн 7) в сыворотке крови. Молекулярная масса сТн Т составляет 37 кДа, сТн I —23,8 кДа. Сердечные тропонины при ИМ обычно достигают в крови больных диагностически значимого уровня через б ч после начала симптомов, повышенный их уровень сохраняется в дальнейшем в течение 7—14 сут, что делает их удобными для поздней диагностики ИМ . Из-за высокой специфичности и чувствительности определение сердечных тропонинов стало "золотым стандартом" в биохимической диагностике ИМ . Таблица 1. Биохимические маркеры некроза миокарда
|
Биохимические маркеры некроза миокарда следующие:
|
3.Диагностика Для диагностики ИМ у больных, перенесших оперативное вмешательство,нецелесообразно использовать ни КФК, ни МB-КФК, ни миоглобин, ни фракции ЛДГ из-за их низкой специфичности. С этой целью необходимо применять высокоспецифичные маркеры — сердечные тропонины. Точная биохимическая диагностика ИМ у больных, перенесших операцию на сердце, связана с большими трудностями из-за повышенного содержания сердечных тропонинов в крови у этих больных вследствие повреждения миокарда в ходе вмешательства. При вьывлении в послеоперационном периоде уровня биохимического маркера, значительно превышающего обычный для такого вмешательства ожидаемый уровень, следует думать об ИМ.
Для ранней диагностики ИМ (менее 6 ч после начала боли) целесообразно использовать миоглобин из-за его высокой чувствительности (91% в 1-й час после поступления) [II]. Определение содержания миоглобина с высокой точностью исключает ИМ, однако низкая специфичность этого теста требует в дальнейшем определения у больных с повышенной концентрацией миоглобина содержания более специфичного маркера ИМ (MB-КФК или сердечного тропонина) для подтверждения наличия некроза миокарда.
Для поздней диагностики ИМ много лет использовалось определение в крови концентрации изофермента ЛДГ-1. В настоящее время из-за низкой кардиоспецифичности определение этого маркера, как было отмечено вьпле, не рекомендовано для диагностики ИМ . Более специфично в отношении некроза миокарда определение сердечных тропонинов. Поскольку значение сердечных тропонинов может оставаться повышенным после некроза миокарда в течение 7—10 дней и более, повышенное содержание сердечных тропонинов рекомендуют отнести к последнему (наиболее недавнему) клиническому событию.
Выявление рецидива ИМ может представлять специфические диагностические трудности, поскольку повышение уровня тропонинов может быть длительным и в том случае время начального повреждения миокарда сложно выяснить. При подозрении на рецидив ИМ следует определять ранние маркеры некроза миокарда (миоглобин и МД-КФК).
Повышение в крови больного уровня биохимических маркеров отражает наличие повреждения миокарда, но не указывает на его механизм . По этой причине повышенное содержание биохимического маркера в крови при отсутствии других данных о наличии ишемии миокарда побуждает к поиску другой причины повреждения сердца, такой как, например, миокардит. 62.Наследственные гипербилирубинемии. Диагностика желтухи. Нарушения обмена порфиринов. Гипербилирубинемия наследственная - это доброкачественное повышение уровня билирубина, связанное с генетически обусловленным дефицитом фермента глюкуронилтрансферазы, с помощью которой в печеночных клетках из непрямого билирубина образуется прямой. Наследственное нарушением обмена билирубина, проявляется хронической или перемежающейся желтухой без выраженного изменения структуры и функции печени, явных признаков повышенного гемолиза (разрушения красных клеток крови) и холестаза (застоя желчи в печеночных протоках). Коррекции болезни состоит в активации выведения билирубина с желчью. Существует несколько генетически детерминированных заболеваний, основными симптомами которых является повышение содержания билирубина в крови и желтуха : 1. гипербилирубинемию негемолитическую наследственную с ядерной желтухой (синдром Криглера — Наджара) 2. гипербилирубинемию юношескую идиопатическую семейную (синдром Жильбера) 3.желтуху хроническую идиопатическую (синдром Дабина-Джонсона) 4.желтуху хроническую семейную негемолитическую (синдром Ротора). При синдроме Криглера-Найяра 1 типа неконъюгированный билирубин в крови выше 200 мкмоль/л. Происходит накопление билирубина в ядрах серого вещества головного мозга, в результате чего развиваются судороги, опистотонус, нистагм, атетоз и т.д. Манифестация наступает в первые часы жизни, причем больные чаще погибают в течение первого года жизни от ядерной желтухи. Изменений печени (биохимических, гистологических) не обнаруживают. Проба с фенобарбиталом не дает результата (фенобарбитал индуцирует активность УДФГТ, но в связи с отсутствием этого фермента при данном синдроме препарат не имеет точки приложения). В лечении применяют фототерапию, кровопускания, обменные переливания крови, альбумина, плазмаферез, трансплантацию печени, генную инженерию. При синдроме Криглера-Найяра 2 типа манифестация наступает несколько позже — в первые месяцы жизни. Проявления сходны с синдромом 1 типа, но менее тяжелые, т.к. УДФГТ присутствует в гепатоцитах, хотя активность ее значительно снижена. Уровень неконъюгированного билирубина в крови не достигает 200 мкмоль/л. Достаточно эффективны фенобарбитал и фототерапия. Диагностика синдрома Дабина-Джонсона основана на выявлении в крови конъюгированной и неконъюгированной (за счет деконъюгации и рефлюкса билирубина в кровь) гипербилирубинемии до 100 мкмоль/л, в моче — билирубинурии. Показатели щелочной фосфатазы обычно не изменены. Характерен подъем уровня бромсульфалеина в крови через 2 часа после введения. При холецистографии тень желчного пузыря отсутствует. Ухудшение, как правило, наступает на фоне беременности или приема пероральных контрацептивов.Макроскопически в ткани печени определяются темные пятна («шоколадная печень»), появление которых связывают с нарушением секреции метаболитов тирозина, триптофана, фенилаланина. Микроскопически выявляют грубые зерна пигмента липофусцина, которые накапливаются преимущественно в центре долек. Синдром Ротора Тип наследования аутосомно-доминантный. Патогенез связан не только с нарушением экскреции билирубина (как при синдроме Дабина-Джонсона), но и с нарушением его захвата синусоидальным полюсом гепатоцитов. Чаще развивается у мальчиков в пубертатном периоде. Клиника сходна с синдромом Дабина-Джонсона. В крови определяется гипербилирубинемия до 100 мкмоль/л (в равной мере повышены показатели прямого и непрямого билирубина). Имеют место билирубинурия; нарушение поглощения бромсульфалеина печенью, но второй пик концентрации в крови, как при синдроме Дабина-Джонсона, отсутствует; при холецистографии желчный пузырь контрастируется. При биопсии печени накопление пигмента обнаруживают редко, более характерна мелкокапельная жировая дистрофия гепатоцитов преимущественно по ходу желчных капилляров. Лечение не разработано. Прогноз благоприятный. Желтуха(icterus) — синдром, развивающийся вследствие накопления в крови избыточного количества билирубина, характеризующийся желтушной окраской кожи, слизистых оболочек и склер. При увеличении билирубина в сыворотке крови в 1,5-2 раза наблюдается желтушность слизистых оболочек, склер, затем кожи.
В зависимости от источника происхождения повышенного содержания билирубина в сыворотке крови различают 3 формы желтухи : 1. Предпеченочная /надпеченочная/ а) при гемолитических анемиях (наследственных и приобретенных) б) повышенный распад эритроцитов при инфаркте легкого, гематомных кровоизлияниях, отравлениях… 2. Печеночная желтуха а) гепатоцеллюлярная (паренхиматозная) вирусный гепатит токсический гепатит цирроз лептоспироз, инфекционный мононуклеоз и т.д. б) гепатоканаликулярная холангиолитический гепатит холангит холестатический гепатит /метилтестостерон, аминазин, атофан./ 3. Послепеченочная (подпеченочная или механическая) желтуха. а) полная закупорка желчных ходов при воспалении и злокачественных новообразованиях поджелудочной железы, фатерова соска, желчных протоков, при желчекаменной болезни камнем 6) неполная закупорка (камень), стриктура желчных протоков, воспалительные процессы /холангиты/, вторичный билиарный цирроз печени. Наличие билирубинурии исключает предпеченочную (гемолитическую) желтуху. Билирубин в моче появляется только при печеночной и механической желтухе

ПОКАЗАТЕЛИ
НОРМА
Билирубин общий 5 – 17 мкмоль/л
Билирубин связанный (прямой)<10 – 15 % от общего
Щелочная фосфатаза 35 – 130 МЕ/л
АсАТ 5 – 40 МЕ/л
АлАТ 5 – 35 МЕ/л
ГГТ (γ-глютамилтрансфераза) 10 – 48 МЕ/л
Холестерин 1,8 – 4,9 ммоль/л
Альбумин 35 – 50 г/л
γ-глобулин 5 -15 г/л
Протромбиновая время 12 -16 сек
ПТИ >80% Надпеченочная желтуха Желтухи этой группы развиваются в результате повышенной продукции билирубина и недостаточности функции захвата его печенью. Основным в генезе этой желтухи является усиленный распад эритроцитов (гемолиз), поэтому обычно их и называют гемолитическими. Патология при этих желтухах лежит в основном вне печени.
Гемолиз бывает внутрисосудистым, когда эритроциты лизируются в крови, и внесосудистым - эритроциты подвергаются деструкции и перевариваются системой макрофагов.
Внутрисосудистый гемолиз может возникнуть вследствие механического разрушения эритроцитов при травмировании в малых кровеносных сосудах (маршевая гемоглобинурия), турбулентном кровяном потоке (дисфункция протезированных клапанов сердца), при прохождении через депозиты фибрина в артериолах (тромботическая тромбоцитопеническая пурпура, гемолитико-уремический синдром, ДВС-синдром), в результате несовместимости эритроцитов по системе АВ0, резус или какой-либо другой системе (острая посттрансфузионная реакция), под влиянием комплемента (пароксизмальная ночная гемоглобинурия, пароксизмальная холодовая гемоглобинурия), вследствие прямого токсического воздействия (яд змеи кобры, инфекции), при тепловом ударе.
Второй механизм обусловлен изменениями физических свойств эритроцитов, снижением их пластичности - способности изменять свою форму при прохождении через узкую фильтрационную сеть селезенки. Нарушение пластичности отмечается при мембранных дефектах эритроцитов (наследственный микросфероцитоз), аномалиях гемоглобина, ведущих к повышению вязкости внутриклеточной среды эритроцита (серповидно-клеточная анемия), наличии включений в цитоплазме эритроцитов (бета-талассемия, альфа-талассемия) и др В результате усиленного распада эритроцитов образуется большое количество свободного билирубина, который печень не в состоянии захватить и не в состоянии связать весь этот билирубин с глюкуроновой кислотой. В результате в крови и тканях накапливается непрямой билирубин. Так как через печень идет повышенный поток непрямого билирубина, то прямого билирубина образуется значительно больше. Насыщенная пигментами желчь поступает в тонкий и толстый кишечник, где продуктов деградации билирубина (уробилиногена, стеркобилиногена) образуется значительно больше.
Для решения вопроса о надпеченочном характере желтухи используют комплекс клинических и лабораторных данных
Желтушность кожи и склер умеренная, кожа, как правило, бледная
Печень и селезенка могут быть увеличенными, но функция печени существенно не нарушена.
В общем анализе крови:
- анемия.
- увеличение числа ретикулоцитов. Ретикулоцитоз отражает активацию костномозговой продукции эритроцитов в ответ на их разрушение на периферии.
- ускоренный выброс из костного мозга недозрелых эритроцитов, содержащих РНК, обуславливает феномен полихроматофилии эритроцитов в фиксированных окрашенных азур-эозином мазках крови.
Биохимический анализ крови:
- уровень общего билирубина в сыворотке крови повышен;
- уровень непрямого билирубина повышен, уровень его повышения зависит от активности гемолиза и способности гепатоцитов к образованию прямого билирубина и его экскреции.
- уровень прямого билирубина (связанного) в сыворотке крови нормальный или слегка увеличен;
В моче:
- в моче повышается содержание стеркобилиногена (стеркобилинурия!), уробилиногена.
- билирубинурия отсутствует, так как через неповрежденный почечный фильтр проходит только прямой билирубин.
Кал:
- приобретает более интенсивное окрашивание.
- повышение стеркобилиногена (темная окраска).
Отдельно хотелось бы остановится на желтухе, развивающейся при гемолитической болезни новорожденного.
Причины
Несовместимость крови матери и плода по группе или по резус-фактору. Накопление гидрофобной формы билирубина в подкожном жире обуславливает желтушность кожи. Однако реальную опасность представляет накопление билирубина в сером веществе нервной ткани и ядрах ствола с развитием "ядерной желтухи" (билирубиновая энцефалопатия).
Клиническая диагностика
Проявляется сонливостью, плохим сосанием, умственной отсталостью, ригидностью затылочных мышц, тоническими судорогами, тремором конечностей, изменением рефлексов с возможным развитием глухоты и параличей.
Лабораторная диагностика
В крови выявляются выраженная анемия, ретикулоцитоз, эритро- и нормобластоз. Гипербилирубинемия за счет непрямой фракции от 100 до 342 мкмоль/л, в дальнейшем присоединяется и прямая фракция. Уровень билирубина в крови быстро нарастает и к 3-5 дню жизни достигает максимума. Важнейший момент в диагностике - выявление несовместимости по АВО-системе и/или Rh-фактору. Печеночная желтуха Причиной печеночных желтух могут быть как инфекционные, так и неинфекционные болезни. Учитывая тот факт, что среди инфекционных болезней печеночная желтуха чаще всего обусловлена вирусными гепатитами, при проведении дифференциальной диагностики желтух, протекающих с признаками инфекционного процесса, прежде всего необходимо исключить у пациента вирусный гепатит (путем исследования специфических маркеров). В исключении острого вирусного гепатита важную роль играет сопоставление выраженности лихорадки и других проявлений общей интоксикации со степенью поражения печени.
Печеночные желтухи обусловлены поражением гепатоцитов. По ведущему механизму можно выделить несколько вариантов печеночных желтух. В одних случаях печеночная желтуха связана с нарушением экскреции и захвата билирубина, регургитацией билирубина. Это наблюдается при печеночно-клеточной желтухе, при остром и хроническом гепатитах, остром и хроническом гепатозе, циррозе печени. В других случаях нарушаются экскреция билирубина и его регургитация. Подобный тип отмечается при холестатической желтухе, холестатическом гепатите, первичном билиарном циррозе печени, идиопатическом доброкачественном возвратном холестазе, при печеночно-клеточных поражениях. В основе желтух может лежать нарушение конъюгации и захвата билирубина. Это отмечается при энзимопатической желтухе при синдромах Жильбера, Криглера — Найяра. Печеночная желтуха может быть связана с нарушением экскреции билирубина, например, при синдромах Дабина — Джонсона и Ротора.
Говоря о патогенезе отметим, что в первую очередь нарушается экскреция прямого билирубина в желчные капилляры. Частично последний поступает в кровь, повышая концентрацию общего билирубина. Прямой билирубин способен проходить через почечный фильтр, поэтому в моче определяется билирубин. Снижение содержания прямого билирубина в желчи приводит к уменьшению образования стеркобилиногена. Поскольку в больной клетке нарушается процесс конъюгации свободного билирубина, увеличивается содержание и непрямого билирубина в крови. Повреждение гепатоцитов ведет к нарушению деградации уробилиногена и он поступает в большой круг кровообращения и через почки выводится с мочой.
Для решения вопроса о печеночном характере желтухи используют комплекс клинических и лабораторных данных :
Общее состояние нарушено, симптомы интоксикации.
Желтушность кожи и склер умеренно выраженная, с оранжевым оттенком или с серым колоритом.
Печень и селезенка увеличены.
Наличие геморрагического синдрома.
Тяжесть и боль в области правого подреберья.
Неустойчивый кожный зуд.
В общем анализе крови: при вирусных гепатитах возможны лейкопения, нейтропения, относительный лимфо- и моноцитоз.
Биохимический анализ крови:
- уровень общего билирубина в сыворотке крови повышен за счет повышения прямого билирубина (связанного) и относительного повышения непрямого билирубина.
- повышение индикаторов цитолитического синдрома (повреждение гепатоцитов) – повышение АЛТ, АСТ, особенно АлАТ, коэффициент де Ритиса менее 1,33.
- увеличены показатели тимоловой пробы.
- нарушение синтетической функции печени: снижение альбуминов, фибриногена, ПТИ < 80%;
В моче:
- появляются желчные пигменты — билирубин и уробилиноген
- цвет мочи темный.
Кал:
- содержание стеркобилиногена понижается (стул обесцвечивается).
Наличие австралийского антигена и других специфических антител.
Теперь рассмотрим некоторые наследственные паренхиматозные желтухи .
Подпеченочные желтухи Подпеченочные желтухи возникают в результате нарушения проходимости желчных протоков, ведущим механизмом при этом является нарушение экскреции и регургитации билирубина. По характеру закупорки подпеченочные желтухи подразделяются на следующие разновидности:
— интраканальные (наблюдаются при закупорке желчных протоков камнями, опухолью, паразитами, воспалительным экссудатом);
— экстраканальные (обусловлены сдавлением протоков извне опухолью, эхинококком, сужением рубцами).
В зависимости от причины обтурации, в клинике будут преобладать свои проявления.При закупорке камней присоединяется инфекция, что отягощает течение обтурационной желтухи. Наблюдается синдром Шарко или, другое название триада Шарко: желтуха, сопровождающаяся увеличением печени, боли, лихорадка. В тяжелых случаях может развиться сепсис, при котором появится пентада Рейнольда: триада Шарко + гипотония и спутанное сознание.
При закупорке опухолью клиника будет скудная, отмечается симптом Курвуазье - увеличенный, безболезненный желчный пузырь. Этот симптом связан с закупоркой дистальных отделов желчных путей. Этот симптом встречается при раке головкиподжелудочной железы. Однако, если опухоль высокой локализации, то симптома Курвуазье не будет.
В патогенезе ключевым моментов является нарушение оттока желчи. При частичной или полной обтурации желчных протоков нарушается желчевыделение и компоненты желчи попадают в кровь, то есть увеличивается в крови содержание прямого билирубина, а значит, он появляется в моче. Так как желчь в меньшем количестве поступает в кишечник или совсем не поступает, резко уменьшается количество стеркобилиногена.
Для решения вопроса о подпеченочном характере желтухи используют комплекс клинических и лабораторных данных
Желтуха с зеленоватым или зеленовато-сероватым оттенком;
Увеличение и уплотнение печени, реже – селезенки;
Устойчивый кожный зуд.
Биохимический анализ крови:
высокий уровень прямого билирубина (> 20 % от нормы);
повышение маркеров холестаза - ГГТ (гаммаглютаминтрансферазы), щелочной фосфатазы, холестерина, холестерола, желчных кислот, нуклеотидазы, β-ЛП;
отсроченное, умеренное повышение АЛТ, АСТ; АСТ/АЛТ < 1,33.
отсутствие нарушений синтетической функции печени;
В моче:
- определяется конъюгированный билирубин
- цвет мочи темный (холурия).
Кал:
- резкое снижение уровня стеркобилиногена вплоть до полного отсутствия (ахоличный стул).
Проявления обтурационной и паренхиматозной желтухи очень сходны. Критерием для дифференциального диагноза является наличие уробилиногена в моче при печеночной желтухе и отсутствие при обтурационной.
Нарушение обмена порфиринов Порфирины — циклические соединения, образованные четырьмя пиррольными кольцами, предшественники гема. Порфирии — группа заболеваний, обусловленных нарушениями биосинтеза порфиринов, они обнаруживаются в крови, кале или моче пациентов. Классификация. 1)приобретённые (действие токсических соединений) 2) наследственные (перемежающаяся острая порфирия, врождённая эритропоэтическая порфирия, наследственная копропорфирия, наследственная фотокопропорфирия). Лабораторная диагностика нарушений порфиринового обмена
Исследование порфиринов в биологическом материале представляет определенные трудности в связи с небольшим содержанием, наличием различных типов и изомеров (различное расположение радикалов), определение которых требует специфических методов. Принцип - соединения, имеющие кольцо порфирина. флуоресцируют и характеризуются интенсивным поглощением на границе видимой и ультрафиолетовой областей спектра. Восстановленные формы порфиринов (порфириногены) бесцветны.
v Определение уровня порфиринов в моче
v Определение содержания порфобилиногена в моче
v Определение ДАЛК в моче
v Определение протопорфирина в эритроцитах
Определение уровня порфиринов в моче
Качественные - основаны на способности порфиринов в УФ давать красную флуоресценцию. В норме с мочой выделяется 0-2 мг/л (вне чувствительности метода).
Количественные - унифицированный метод Соулсби - основан на спектрофотометрии. Производят экстракцию порфиринов из мочи, а затем измерение оптической плотности на 3 длине волн - 380. 402, 430нм — пересчет по креатинину.
Норма - 30,5-122 н/моль/г креатинина.
Показания: заболевания печени. Порфирии.
Определение содержания порфобилиногена в моче
Материал: свежевыделенная моча (хранение не более 2 часов при комнатной температуре) или в холодильнике при 4 °С или -20 0 С.
Используется качественная реакция с реактивом Эрлиха (парадиметилбензальдегид в концетрированной соляной кислоте) +бутанол. Смешивают, встряхивают, отстаивают. Происходит разделения на 2 слоя. Верхний - бутанол. Внизу - водная фаза. У здоровых - окрашен бутанольный слой, у больных - водный.
Норма: ПБГ в моче не обнаруживается. Реакция становится положительной при концентрации ПБГ выше 6 mi л (норма 0-2 мг/л).
Показания: Порфирия. анемия, свинцовая интоксикация
Определение ДАЛК в моче
Требования к материалу см. выше. Определяют по реакции с реактивом Эрлиха после удаления ПБГпутем сорбции на активированном угле. Содержание ДАЛК рассчитывают по калибровочному графику, затем пресчитывают на 1г креатинина. поскольку диурез за сутки может быть различным.
Норма 3,9-19 мкмолы'г креатинина.
Показания: нарушения порфиринового обмена, интоксикации свинцом, бензолом и др.
