
- •1.Критерии аналитической надежности лабораторных исследований
- •6.Устройство, основные характеристики и правила настройки микроскопа. Основные микроскопические технологии.
- •7.Приготовление цитологического мазка, правила фиксации и окраски. Теория цитологических окрасок.
- •9.Основные этапы созревания гранулоцитов и моноцитов, опишите морфологические и цитохимические признаки клеток миелопоэза. Клиническое значение цитологического исследования клеток миелопоэза.
- •20.2.5.1. Фрагмент общей схемы
- •20.2.5.2. Антигеннезависимая дифференцировка
- •20.2.5.3. Антигензависимая дифференцировка
- •II. Проплазмоцит и плазмоцит
- •III. Активированные т-лимфоциты
- •14.Хронические миелопролиферативные заболевания. Патогенез, диагностика. Современные возможности лечения.
- •16.Острый миелолейкоз. Методы цитохимического анализа миелобластов.
- •18.Современные методы клинического исследования крови. Сравнительная характеристика и клиническое значение микроскопии мазка и исследования крови в гематологическом анализаторе.
- •20.Цитологические характеристики и клиническое значение исследования бластов в крови и препарате костного мозга.
- •25.Анемия хронических заболеваний. Этиология, патогенез, диагностика.
- •31.Стадии созревания мегакариоцитов, морфологические и иммунофенотипические характеристики. Структура и функция рецепторов тромбоцитов, роль арахидоновой кислоты, простациклин, тромбоксан.
- •33.Клиническое исследование мочи. Возможности визуальной колориметрии мочи в сравнении со стандартным клиническим исследованием.
- •3. Анализ мочи по Нечипоренко Процедура анализа :
- •4.1. Активированное парциальное (частичное) тромбопластиновое время (аптв)
- •4.2. Протромбиновое время
- •4.3. Тромбиновое время
- •51 . Ионометрия. Ионоселективные электроды. Кислотность среды и ее измерение. Индикаторы.
- •53.Нарушения обмена калия. Причины, методы диагностики. Гипокалиемия.
- •Диагностика
- •63.Диагностика сахарного диабета. Значение определения гликозилированного гемоглобина.
- •Лабораторные исследования : 1.Исследование уровня глюкозы в крови натощак Нормальным считается уровень глюкозы в пределах 3,5-5,5 ммоль/л.
- •6.Исследование гликированного гемоглобина
- •7.Исследование уровня фруктозамина в крови
- •8.Исследование липидов в крови
- •9.Исследование креатинина и мочевины
- •10 .Определение белка в моче
- •11.Исследование на кетоновые тела
- •Изменения фракции α2-глобулинов.
- •Изменения фракции β-глобулинов.
- •Изменения фракции γ-глобулинов.
- •Метод – колориметрический электрофорез Показания к назначению анализа - белковые фракции:
- •Лабораторная диагностика
- •2.Функциональная геномика
- •3.Сравнительная геномика
- •1.Обнаружение биомаркеров биологических процессов
- •2.Применения в медицине
- •3.Уточнение аннотации генома
- •4.Сравнительная протеомика
- •Основные методы Масс-спектрометрия
3. Анализ мочи по Нечипоренко Процедура анализа :
Собранная в посуду моча перемешивается.
5-10 мл мочи отливается в градуированную пробирку.
Пробирки центрифугируются 3 минуты при 3500 оборотов/мин.
Верхний слой мочи сливается, в пробирке оставляют 1 мл мочи с осадком.
Осадок хорошо перемешивается и сливается в камеру Горяева, камеру Фукса-Розенталя или камеру Бюркера.
Во всей сетке идет раздельный подсчет лейкоцитов, эритроцитов и цилиндров в 1 мм3 осадка мочи.
Производят подсчет по формуле N = (H/v)*(Vo/Vs). Здесь N — истинное количество элементов, Vo — объем осадка (1000 мкл), Vs — общий объем пробы, H — количество подсчитанных в камере клеток, v — объем камеры (0,9 мм3 для камер Горяева и Бюркера, 3,2 мм3 для камеры Фукс-Розенталя).
4. Трехстаканная проба мочи Правила сбора мочи для трехстаканной пробы:
Воздержание от мочеиспускания в течение 3-5 часов
Туалет наружных половых органов (подмывание теплой водой без мыла)
Сбор мочи в 3 емкости – в первый контейнер примерно 1/5 от объема мочеиспускания, во второй контейнер 3/5, в последний 1/5.
В том случае, если основным заболеванием, которое требует диагностики, является простатит, то перед сбором 3-й порции производится массаж простаты.
Собранную мочу необходимо как можно раньше отправить в лабораторию для исследования.
5. Анализ мочи на микобактерии туберкулеза Анализ мочи на микобактерии туберкулеза является бактериоскопическим методом исследования, при котором производится окраска мазка из осадка по Цилю-Нильсену. Суть метода:
Суть метода основана на кислотоустойчивости микобактерий туберкулеза. При окрашивании выделяют несколько этапов. Сначала происходит проникновение карболового фуксина в клетку через мембрану. Затем все некислотоустойчивые структуры клетки обесцвечиваются серной кислотой и докрашиваются раствором метиленового синего. Таким образом, все клетки и структуры приобретают синий цвет, исключение составляет лишь кислотоустойчивая микобактерия туберкулеза, окрашенная в малиново-красный цвет.
Показания для исследования:
- Длительное неэффективное лечение воспалительных заболеваний мочеполовой системы (цистит, пиелит, эпидидимит, пиелонефрит, простатит).
- Подозрение на туберкулез мочеполовой системы (нарушения мочеиспускания, гематурия, появление мутной мочи, обусловленное пиурией, боли в поясничной области, возможно увеличение мошонки с одной стороны).
- Туберкулез легких или туберкулезное поражение других органов.
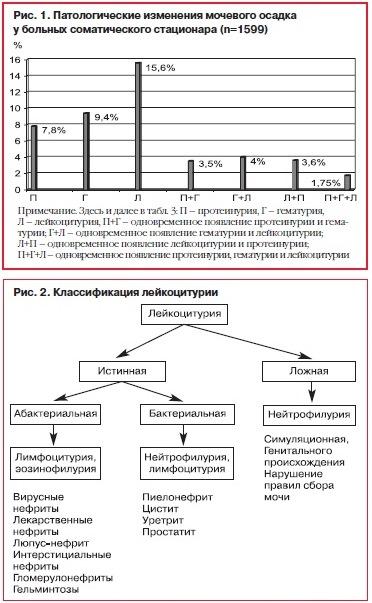
34.Лейкоцитурия. Методы диагностики, клиническое значение. Дифференциальный диагноз септической и асептической лейкоцитурии В норме при исследовании осадка мочи может определяться 2—5 лейкоцитов в поле зрения. Лейкоцитурия — наличие большего, чем в норме, количества лейкоцитов в моче. Лейкоцитурия может быть незначительной (8—10, 20—40 лейкоцитов в поле зрения), умеренной (50—100 в поле зрения) и выраженной (пиурия), когда лейкоциты покрывают все поля зрения либо встречаются скоплениями.
Механизм
происхождения лейкоцитурии связан в
одних случаях (при пиелонефрите и
интерстициальном нефрите) с проникновением
лейкоцитов из очагов воспалительной
инфильтрации межуточной ткани почек в
просвет канальцев через поврежденные
или разрушенные этим процессом их
стенки. В других случаях (при пиелите,
цистите, уретрите) — с попаданием
лейкоцитов в мочу из слизистой оболочки
мочевых путей, пораженных воспалительным
процессом. При гнойном пиелонефрите
пиурия появляется в результате прорыва
гнойного содержимого из гнойника
(абсцесса, карбункула) в полость чашечки
(чашечек) или ло
Наиболее
точно выявить лейкоцитурию можно путем
микроскопии осадка мочи.
Для
микроскопического исследования мочи
существуют два метода:
1) обычное
исследование осадка мочи при общем ее
анализе;
2) количественный подсчет
форменных элементов — методики
Каковского—Аддиса, Нечипоренко, Амбурже
и др. Нормальное содержание лейкоцитов
в осадке мочи составляет: при общем
анализе — до 5—6 в поле зрения, при
анализе по Каковскому — Аддису — до 2
000 000 в сутки, по Амбурже — до 2500 в мин.
Так, например, определяют количество
форменных элементов в моче, выделенной
за сутки (метод Каковского—Аддиса), за
1 ч (метод Рофе), за 1 мин (метод Амбюрже);
содержание лейкоцитов в 1 мл мочи (метод
Нечипоренко) или в 1 мм3 нецентрифугированной
мочи (метод Стансфилда—Уэбба). В основе
всех количественных методов исследования
лежит определение числа форменных
элементов (отдельно лейкоцитов,
эритроцитов и цилиндров) в 1 мм3 осадка
мочи с помощью счетной камеры
(гемоцитометра).
 По
типу обнаруженных лейкоцитов выделяют
разные типы
уроцитограмм:
По
типу обнаруженных лейкоцитов выделяют
разные типы
уроцитограмм:
нейтрофильный — инфекция: пиелонефрит, туберкулёз
мононуклеарный — гломерулонефрит, интерстициальный нефрит
лимфоцитарный — системная красная волчанка, ревматоидный артрит (системный вариант)
эозинофильный — аллергоз
По количеству выделенных лейкоцитов можно разделить на микролейкоцитурию (менее 200 в п/зр) и пиурию (более 200 в п/зр).
Уровень лейкоцитурии:
почечный (тубулярный и гломерулярный) — при гломерулонефрите, интерстициальном нефрите
почечный (чашечки, лоханки) — при пиелонефрите, туберкулёзе, карбункуле почки, аномалиях положения почек, гипоплазии, поликистозе почек, гидронефрозе.
внепочечный (мочеточники) — удвоение мочеточников, дивертикул мочеточника, мегалоуретер, эктопия мочеточника, ПМР, перегиб мочеточника.
внепочечный (мочевой пузырь) — дивертикул мочевого пузыря, цистит, камни мочевого пузыря, уретероцеле, туберкулёз
внепочечный (уретра) — стриктура уретры, клапан уретры, свищ уретры, уретрит, фимоз
35.Эритроцитурия. Этиология и механизмы эритроцитурии. Методы диагностики, клиническое значение Эритроциты могут поступать в мочу из любого участка мочевого тракта. У здоровых людей встречаются 1—2 эритроцитов в поле зрения микроскопа (при 40-кратном увеличенной лишь в отдельных анализах. При обнаружении в утренней моче более 2 эритроцитов в поле зрения говорят об эритроцитурии и это требует количественного анализа осадка мочи по Нечипоренко, Амбюрже или Каковскому - Аддису. Морфология эритроцитов мочи в определенной степени зависит от осмоляльности мочи: в гипертонической моче клетки могут иметь двояковогнутую форму, в гипотоничной — имеют более сферическую форму.
Морфологически эритроциты в моче различаются по их происхождению из того или иного отдела мочевых путей. Красные кровяные тельца в случае болезней почек дисморфны и только при условии значительной эритроцитурии могут быть как дисморфными, так и неизмененными. Эритроциты из лоханки, мочеточника, мочевого пузыря, уретры униморфны и только в гипотонической моче могут терять гемоглобин и превращаться в тени.
Эритроцитурия почечного происхождения обнаруживается при гломерулонефрите, пиелонефрите, амилоидозе, диабетическом гломерулосклерозе, туберкулезе, ряде нефропатий у больных с системными заболеваниями соединительной ткани и системными васкулитами, инфарктах, опухолях, травмах почек. Она может увеличиваться при условии лечения производными аминохинолина, неспецифическими противовоспалительными средствами, сульфаниламидами, иногда глюкокортикоидами. Причины эритроцитурии при заболеваниях мочевыводящих путей - мочекаменная болезнь, мочевые диатезы, воспалительные процессы, аномалии развития, опухоли, травмы.
В клинической практике появление эритроцитов (крови) в моче называется гематурией.
Причины гематурии:
Болезнь мочевыводящих путей
почечной паренхимы
почечной выделительной системы (чашечки и почечной лоханки), мочеточник, мочевой пузырь, мочеиспускательный канал
мужских половых органов - предстательная железа (простата), уретры,
Болезнь за пределами мочевыводящих путей - например, расстройства свертываемости крови, некоторые лекарственные препараты, системное заболевание.
Среди заболеваний, которые вызывают гематурию - урологические:
опухоли мочеполовой системы (наиболее частая причина гематурии)
почечно-каменная болезнь мочевыводящих путей
травмы мочеполовой системы
воспаление мочевыделительного тракта.
Эритроцитурия может быть распознана невооруженным глазом (макрогемотурия) или микроскопически (микрогематурия). Норма эритроцитов в моче составляет 1-2 клетки в поле зрения .
При микроскопии осадка мочи в зависимости от наличия гемоглобина попадаются такие виды эритроцитов:
Неизмененные эритроциты – содержат гемоглобин, имеют вид двояковогнутого диска красного цвета.
Измененные (выщелоченные) эритроциты – без гемоглобина, под микроскопом бесцветные, могут выглядеть в виде колец. Выход гемоглобина происходит в результате повышенной осмолярности, длительного нахождения эритроцитов в моче и фильтрации в клубочках почек (гломерулонефрит).
Процесс формирования мочи начинается в клубочках почек, где происходит первичная фильтрация крови, при этом в норме эритроциты, лейкоциты и белки плазмы не проходят через мембрану клубочков. Поэтому их появление в моче является признаком заболевания.
Когда эритроциты в моче повышаются?
Причины появления эритроцитов в моче бывают соматического, ренального (почечного) ипостренального происхождения. Причины соматического происхождения связаны с тем, что почки не вовлечены в патологический процесс, а реагируют на заболевание в других органах и системах. К ним относятся:
Тромбоцитопения – состояние сниженного количества тромбоцитов в крови, которое приводит к нарушению свертываемости крови в сосудах и ее попадании в мочу при первичной фильтрации в клубочках.
Гемофилия – снижение свертываемости крови за счет снижения синтеза плазменных факторов свертывания. Механизм попадания эритроцитов в мочу тот же.
Интоксикация организма – попадание токсинов (ядов) при различных вирусных и бактериальных инфекциях вызывает повышение проницаемости мембраны клубочков для эритроцитов, за счет чего они попадают в мочу.
Рентальные причины вызывают повышение эритроцитов при заболеваниях почек:
Острый и хронический гломерулонефрит – аутоиммунное заболевание клубочков и канальцев почек, при котором в нее попадает значительное количество эритроцитов во время фильтрации. Поэтому под микроскопом определяются измененные формы эритроцитов.
Опухоль почки – растущее новообразование может разрушать стенку сосудов, возникает небольшое кровотечение с попаданием эритроцитов в мочу. В этом случае в анализе визуализируются неизмененные эритроциты.
Мочекаменная болезнь – обменное заболевание, при котором формируются камни в чашечно-лоханочной системе почек, края камней могут повреждать слизистую оболочку, приводя к кровотечению, в моче также появляются неизмененные эритроциты.
Пиелонефрит – инфекционное воспалительное заболевание почек, преимущественно поражается одна почка, в результате воспаления повышается проницаемость сосудов почки. В моче повышается количество неизмененных эритроцитов, которые попадают в нее за счет диапедеза (просачивания) через стенки артерий.
Гидронефроз – нарушение оттока мочи вызывает растяжение почки с повреждением сосудов.
Травма – проникающее ножевое ранение или разрыв почки при падении приводят к массивному кровотечению, моча становится насыщенно красного цвета (макрогематурия).
В случае причин постренального происхождения повышенное содержание эритроцитов в моче развивается вследствие заболеваний мочевого пузыря или мочеиспускательного канала:
Цистит – воспаление слизистой оболочки мочевого пузыря, в результате которого происходит проникновение эритроцитов через стенки сосудов, их форма не изменяется.
Наличие камня в мочевом пузыре или мочеиспускательном канале (уретре) вызывает травматизацию слизистой оболочки с кровотечением и попаданием неизмененных эритроцитов в мочу.
Неопластический (опухолевый) процесс в мочевом пузыре или уретре – рост опухоли вызывает разрушение сосудов, в моче появляются неизменные эритроциты, количество которых зависит от калибра поврежденного сосуда.
Травмы мочевого пузыря или уретры с повреждением сосудов и кровотечением сопровождаются макрогематурией.
Некоторые заболевания органов половой системы также могут провоцировать повышенное количество эритроцитов в моче. Так некоторые заболевания предстательной железы у мужчин приводят к гематурии:
рак предстательной железы – появление крови в моче вызвано разрушением сосудов растущей опухолью в простате;
простатит – воспаление предстательной железы, механизм повышения количества эритроцитов такой же, как и при других воспалительных заболеваниях мочеполовой системы.
У женщин появление эритроцитов в моче обусловлено такими заболеваниями органов половой системы:
маточные кровотечение – кровь при этом из влагалища может попадать в мочу во время акта мочеиспускания;
эрозия шейки матки – процесс часто захватывает и нарушает целостность сосудов с выходом крови.
Если в моче повышаются и лейкоциты и эритроциты, то это свидетельствует о наличии воспалительного процесса в почках (пиелонефрит) или в органах мочеполовой системы (цистит, уретрит, простатит).
Повышение количества эритроцитов в моче бывает не только при патологиях, но и в норме, при некоторых физиологических состояниях:
пребывание в жарком помещении (баня, горячие цеха), что приводит к общему перегреванию организма, вызывает транзиторное (временное) увеличение эритроцитов в моче;
стрессы – вызывают повышение концентрации глюкокортикостероидов в крови, которые делают стенку сосудов почек проницаемой для эритроцитов;
выраженные физические нагрузки – у спортсменов, у людей после тяжелого физического труда развивается микрогематурия;
употребление алкоголя – алкогольные напитки вызывают спазм (сужение) сосудов почек и повышение проницаемости их стенок для эритроцитов;
пища с высоким содержанием пряностей.
Кроме эритроцитов при макрогематурии красное окрашивание моче может придавать непосредственно гемоглобин. При развитии гемолиза (процесс разрушения эритроцитов в крови) гемоглобин скапливается в плазме и выводится с мочой – гемоглобинурия. Стоит помнить, что гемоглобин забивает почечные клубочки и блокирует фильтрацию мочи, как результат возникает острая почечная недостаточность.
Используют трехстаканную пробу. Количество эритроцитов в моче можно оценить по методу Каковского-Аддиса,Нечипоренко, Амбурже.
36.Клиническое значение и методы выявления протеинурии. Физиологическая протеинурия
Преходящее выделение белка с мочой у здоровых людей может появляться после тяжелой физической нагрузки (длительные походы, марафонский бег, игровые виды спорта). Это так называемая рабочая (маршевая) протеинурия или протеинурия напряжения. Генез такой протеинурии объясняют гемолизом с гемоглобинурией и стрессовой секрецией катехоламинов с преходящим нарушением гломерулярного кровотока. При этом протеинурия выявляется в первой после физической нагрузки порции мочи.
Известна albuminuria solaris, возникающая при выраженной реакции кожи на инсоляцию, а также при раздражении кожи некоторыми веществами, например, при смазывании ее йодом.
Установлена возможность появления протеинурии при повышении уровня адреналина и норадреналина в крови, чем объясняют выделение белка с мочой при феохромоцитоме и гипертонических кризах.
Выделяют алиментарную протеинурию, появляющуюся иногда после употребления обильной белковой пищи.
Доказана возможность появления центрогенной протеинурии – при эпилепсии, сотрясении мозга.
Описана эмоциональная протеинурия во время экзаменов.
К протеинурии функционального происхождения относят и описываемое некоторыми авторами выделение белка с мочой при энергичной и продолжительной пальпации живота и области почек (пальпаторная протеинурия).
Лихорадочная протеинурия наблюдается при острых лихорадочных состояниях, чаще у детей и стариков. Механизм ее малоизучен. Этот вид протеинурии сохраняется в период повышения температуры тела и исчезает при ее снижении и нормализации. Если протеинурия сохраняется в течение многих дней и недель после нормализации температуры тела, то следует исключить возможное органическое заболевание почек - либо вновь возникшее, либо уже существующее.
При заболеваниях сердца часто выявляют застойную, или сердечную протеинурию. С исчезновением сердечной недостаточности она обычно исчезает.
У новорожденных в первые недели жизни также наблюдается физиологическая протеинурия.
Ортостатическая (постуральная, лордотическая) протеинурия наблюдается у 12 – 40% детей и подростков, характеризуется выявлением белка в моче при длительном стоянии или ходьбе с быстрым исчезновением (преходящий вариант ортостатической протеинурии) или уменьшением его (персистирующий вариант) в горизонтальном положении. Генез ее связывают с нарушениями почечной гемодинамики, развивающимися за счет лордоза, сдавливающего нижнюю полую вену в положении стоя, или выброса ренина (ангиотензина II) в ответ на изменения объема циркулирующей плазмы при ортостатизме.
Физиологическая протеинурия, как правило, незначительная – не более 1,0 г/сут.
Патологическая протеинурия
Патологическая протеинурия бывает почечного и внепочечного происхождения.
Почечная протеинурия
Почечная протеинурия является одним из наиболее важных и постоянных признаков заболеваний почек и может быть гломерулярной, или клубочковой, и тубулярной, или канальцевой. При сочетании этих двух типов развивается смешанный тип протеинурии.
Клубочковая протеинурия
Клубочковая протеинурия обусловлена повреждением гломерулярного фильтра, возникает при гломерулонефритах и при нефропатиях, связанных с обменными или сосудистыми заболеваниями. При этом из крови в мочу в большом количестве фильтруются плазматические белки.
В основе нарушения работы клубочкового фильтра лежат различные патогенетические механизмы:
токсические или воспалительные изменения гломерулярной базальной мембраны (отложение иммунных комплексов, фибрина, клеточная инфильтрация), вызывающие структурную дезорганизацию фильтра;
изменения гломерулярного кровотока (вазоактивные агенты – ренин, ангиотензин II, катехоламины), влияющие на гломерулярное транскапиллярное давление, процессы конвекции и диффузии;
недостаток (дефицит) специфических гломерулярных гликопротеидов и протеогликанов, ведущий к потере фильтром отрицательного заряда.
Клубочковая протеинурия наблюдается при остром и хроническом гломерулонефрите, амилоидозе, диабетическом гломерулосклерозе, тромбозе почечных вен, застойной почке, гипертонической болезни, нефросклерозе.
Клубочковая протеинурия может быть селективной и неселективной в зависимости от тяжести повреждения гломерулярного фильтра.
Селективная протеинурия встречается при минимальном (нередко обратимом) повреждении гломерулярного фильтра (нефротический синдром с минимальными изменениями), представлена белками с молекулярной массой не выше 68000 – альбумином и трансферрином.
Неселективная протеинурия чаще встречается при более тяжелом повреждении фильтра, отличается повышением клиренса средне- и высокомолекулярных плазматических белков (в составе белков мочи присутствуют также альфа2-глобулины и гамма-глобулины). Неселективная протеинурия наблюдается при нефротической и смешанной формах гломерулонефрита, вторичном гломерулонефрите.
Канальцевая протеинурия (тубулярная протеинурия)
Канальцевая протеинурия связана либо с неспособностью канальцев реабсорбировать белки, прошедшие через неизмененный гломерулярный фильтр, либо обусловлена выделением белка эпителием самих канальцев.
Канальцевая протеинурия наблюдается при остром и хроническом пиелонефрите, отравлении тяжелыми металлами, остром канальцевом некрозе, интерстициальном нефрите, хроническом отторжении почечного трансплантата, калийпенической нефропатии, генетических тубулопатиях.
Внепочечная протеинурия
Внепочечная протеинурия возникает при отсутствии патологического процесса в самих почках и делится на преренальную и постренальную.
Преренальная протеинурия развивается при наличии необычно высокой плазматической концентрации низкомолекулярного белка, который фильтруется нормальными клубочками в количестве, превышающем физиологическую способность канальцев к реабсорбции. Подобный тип протеинурии наблюдается при миеломной болезни (в крови появляется низкомолекулярный белок Бенс-Джонса и другие парапротеины), при выраженном гемолизе (за счет гемоглобина), рабдомиолизе, миопатии (за счет миоглобина), моноцитарном лейкозе (за счет лизоцима).
Постренальная протеинурия обусловлена выделением с мочой слизи и белкового экссудата при воспалении мочевых путей или кровотечением. Заболевания, которые могут сопровождаться внепочечной протеинурией - мочекаменная болезнь, туберкулез почки, опухоли почки или мочевых путей, циститы, пиелиты, простатиты, уретриты, вульвовагиниты. Постренальная протеинурия чаще весьма незначительна и практически менее важна.
Степень выраженности протеинурии
В зависимости от степени выраженности выделяют легкую, умеренную и тяжелую протеинурию.
Легкая протеинурия (от 300 мг до 1 г/сут) может наблюдаться при острой инфекции мочевыводящих путей, обструктивной уропатии и пузырно-мочеточниковом рефлюксе, тубулопатиях, мочекаменной болезни, хроническом интерстициальном нефрите, опухоли почки, поликистозе.
Умеренная протеинурия (от 1 до 3 г/сут) отмечается при остром канальцевом некрозе, гепаторенальном синдроме, первичном и вторичном гломерулонефрите (без нефротического синдрома), протеинурической стадии амилоидоза.
Под тяжелой, или выраженной протеинурией понимают потерю белка с мочой, превышающую 3,0 г в сутки или 0,1 г и более на килограмм массы тела за 24 часа. Такая протеинурия почти всегда связана с нарушением функции клубочкового фильтрационного барьера в отношении размера или заряда белков и наблюдается при нефротическом синдроме.
Все качественные пробы на белок в моче основаны на способности белков к денатурации под влиянием различных физических и химических факторов. При наличии белка в исследуемом образце мочи появляется либо помутнение, либо выпадение хлопьевидного осадка. В связи с этим к исследуемому образцу мочи предъявляются определенные требования.
Условия определения белка в моче на основе реакции коагуляции:
Моча должна иметь кислую реакцию. Мочу щелочной реакции подкисляют несколькими (2 - 3) каплями уксусной кислоты (5 – 10%).
Моча должна быть прозрачной. Помутнение устраняется через бумажный фильтр. Если помутнение не исчезает, добавляют тальк или жженую магнезию (около 1 чайной ложки на 100 мл мочи), взбалтывают и фильтруют.
Качественную пробу следует проводить в двух пробирках, одна из них – контрольная.
Искать помутнение следует на черном фоне в проходящем свете.
К качественным методам определения белка в моче относятся:
кольцевая проба Геллера,
проба с 15 – 20% сульфосалициловой кислотой,
проба с кипячением, и другие.
Проба Геллера. Ход определения: В пробирку наливают 1 – 1,5 мл азотной кислоты или реактива Ларионовой и пипеткой осторожно по стенке пробирки наслаивают такое же количество мочи, стараясь не взбалтывать жидкость в пробирке. При наличии белка на границе двух жидкостей появляется белое кольцо. Реакцию оценивают на черном фоне и учитывают время появления нитевидного кольца. Чувствительность пробы 0,033 г/л. При таком содержании белка на границе жидкостей появляется белое нитевидное кольцо между 2-й и 3-й минутами.
37.Диагностика протеинурии переполнения. Феномен Бенс-Джонса. Понятие о моноклональных гаммапатиях Преренальная, или протеинурия «переполнения», наблюдается при миеломной болезни (протеинурия Бенс-Джонса), рабдомиолизе, макроглобулинемии Вальденстрема, массивном внутрисосудистом гемолизе. Протеинурия переполнения может колебаться от 0,1 до 20 г/сутки. Высокая протеинурия (более 3,5 г/сутки.) в этом случае не является признаком нефротического синдрома, так как не сопровождается гипоальбуминемией и другими его признаками. Для выявления миеломной нефропатии больному необходимо исследовать мочу на белок Бенс-Джонса.
Белок Бенс-Джонса - белок, состоящий из моноклональных легких цепей иммуноглобулинов (типа к и X), в избытке секретирующийся прежде всего плазматическими клетками. Белок Бенс-Джонса циркулирует в крови и выделяется с мочой вследствие его небольшой молекулярной массы. Образование белка Бенс-Джонса является истинной патологией, в первую очередь В-системы иммунитета. Моноклональный компонент (М) - парапротеин - синтезируется одним клоном лимфоидных клеток и определяется поэтому при электрофорезе белков сыворотки крови. Для определения белка Бенс-Джонса мочу, подкисленную до рН около 5,5, фильтруют и нагревают; при t° около 56° белок выпадает в осадок, который при подкислении растворяется. Для количественного определения мочу нагревают до t° 70°, отделяют осадок центрифугированием, промывают водой, спиртом, эфиром и взвешивают
М-компонент можно выявить с помощью иммуноэлектро-фореза с моноспецифическими антисыворотками к легким цепям типа к и X, электрофореза на различных носителях (бумага, ацетат-целлюлоза, полиакриламидный гель), а также методом иммунофиксации на ацетат-целлюлозной пленке и иммуноизотахофореза на ацетат-целлюлозных мембранах (что позволяет обнаружить фрагменты Ig в малых концентрациях).
Моноклональная гаммапатия — это сборное наименование целого класса заболеваний, при котором происходит патологическая секреция аномальных, измененных по химическому строению, молекулярной массе или иммунологическим свойствам иммуноглобулинов (гамма-глобулинов) одним клоном плазматических клеток или B-лимфоцитов. Эти иммуноглобулины затем нарушают функции тех или иных органов и систем, например, почек, что и приводит к развитию симптомов заболевания.
Моноклональные гаммапатии могут быть доброкачественными, когда клональная популяция клеток, секретирующих аномальные иммуноглобулины, не проявляет тенденций к неконтролируемому росту и размножению или к неконтролируемому увеличению продукции аномального белка. А могут быть и злокачественными, когда клональная популяция, производящая аномальный белок, склонна к постоянному неконтролируемому росту и
Доброкачественные моноклональные гаммапатии часто развиваются как последствия чрезмерной хронической антигенной стимуляции, приводящей к усиленному размножению определенных клонов плазматических клеток. Например, именно такой характер имеют доброкачественные моноклональные гаммапатии, наблюдаемые после пересадки костного мозга, реже после пересадки органов и тканей или при некоторых хронических инфекциях.
38.Клиническое значение выявления микроальбуминурии Микроальбуминурия – это выделение почками (путем клубочковой фильтрации) альбумина в количествах, определить которые с помощью рутинных лабораторных методов (клинический анализ мочи, например, путем осаждения сульфосалициловой кислотой) не удается - от 30 до 300 мг/сутки или от 20 до 200 мкг/минуту. При отсутствии инфекции мочевыводящих путей и острого заболевания повышенная экскреция альбуминов с мочой, как правило, отражает патологию клубочкового аппарата почек. Клиническое значение микроальбуминурии. Чаще всего микроальбуминурия является признаком первичных или вторичных функциональных либо органических поражений тубулогломерулярного аппарата почек и свидетельствует о генерализованном поражении сосудистой системы и прогрессировании почечной недостаточности. Следует помнить, что микроальбуминурия встречается не только при патологических изменениях почечных клубочков, но и при поражениях интерстиция канальцев вследствие нарушения реабсорбции белков. При поражении интерстиция канальцев микроальбуминуриирия сочетается с повышенной экскрецией иммуноглобулинов (IgG), которую также не удается выявить рутинными методами, что требует проведения дополнительных исследований. Микроальбуминурия не является патогномоничной для определенных патологических состояний или заболеваний, но наиболее часто она развивается при артериальной гипертензии и сахарном диабете. В случае возникновения микроальбуминурии при артериальной гипертензии и сахарном диабете ее расценивают как один из ранних неблагоприятных прогностических признаков и факторов риска развития поражений органов-мишеней. Встречается и физиологическая протеинурия (она может возникнуть вследствие вазомоторных реакций, вызывающих повышение гидратации и проницаемости базальной мембраны клубочков с последующей фильтрацией белка, экскреция альбуминов с мочой значительно увеличивается при повышенном потреблении белков с пищей, после тяжелой физической нагрузки). Микроальбуминурия может развиться при системной волчанке и других аутоиммунных процессах. При данных заболеваниях происходит инфильтрации базальной мембраны клубочков нейтрофилами, что ведет к ее деградации, а также вследствие отложения в ней иммунных комплексов. Микроальбуминурия может развиться при застойной сердечной недостаточности, болезнях почек, гормонально-активных опухолях надпочечников, интоксикации лекарственными средствами, бактериальной и химической интоксикации, отторжении пересаженной почки и др. В 1999 г. Всемирная организация здравоохранения определила микроальбуминурию как один из компонентов метаболического синдрома, что отражает существенный вклад этого фактора риска в кардиоваскулярную заболеваемость и смертность у больных сахарным диабетом. Прогностическое значение микроальбуминурии. Многие исследователи расценивают микроальбуминурию как предиктор таких патологических состояний, как сахарный диабет, артериальная гипертензия, атеросклероз, коллагенозы, нефропатия беременных. Микроальбуминурия является маркером повреждения аппарата клубочковой фильтрации и предиктором повреждения почек при сахарном диабете, одним из критериев диабетической и гипертонической нефроангиопатии и предиктором эклампсии у женщин, страдающих нефропатией беременности, а также нефропатий неясной этиологии и идиопатических поражений клубочкового аппарата почек. При сахарном диабете типа 1 микроальбуминурию следует рассматривать как предиктор нефропатии, а при диабете типа 2 – как прогностический признак повышенной смертности от заболеваний сердечно-сосудистой системы. Определение уровня микроальбуминурии используют также для прогнозирования заболеваний сердечно-сосудистой системы и повышенной смертности от них в общей популяции. Динамика уровня микроальбуминурии может служить одним из критериев эффективности лечения того или иного патологического состояния. Методы выявления микроальбуминурии. Учитывая значительную вариабельность экскреции альбуминов с мочой, диагностическое значение имеет лишь персистирующая микроальбуминурия, под которой понимают ее обнаружение не менее чем в двух из трех последовательных анализах мочи, выполненных за 3-6 месяцев. Важно, что тест на микроальбуминурию не должен проводиться на фоне инфекции, лихорадки, воспаления неинфекционного генеза, после интенсивной физической нагрузки, продолжительного пребывания в вертикальном положении. При скрининге для выявления микроальбуминурии допустимо использовать специальные тест-полоски, например, Micro-Bumin test (с пределом чувствительности более 40 мг/л) или Albu-Sure test (с пределом чувствительности более 20 мг/л). Также применяются тест-полоски Micral-Test и абсорбирующие таблетки Micro-Bumintest. Но при положительном результате этих тест-полосок наличие микроальбуминурии необходимо подтвердить с помощью количественных или полуколичественных методов определения экскреции альбуминов с мочой. Для полуколичественной экспресс-оценки степени микроальбуминурии применяют индикаторные тест-полоски, например, URS (Urine Reagent Strips) - 1P (США). Возможны шесть вариантов при определении альбуминурии тест-полосками: (1) «альбумин в моче не определяется»; (2) «следы альбуминов» (около 150 мг/л); (3) 300 мг/л; (4) 1000 мг/л; (5) 2000 мг/л; (6) более 2000 мг/л. По данным URS-1P-теста микроальбуминурией считается уровень экскреции альбуминов с мочой не более 300 мг/л, а макроальбуминурией - не более 1000 мг/л. Чувствительность и специфичность URS-1P-теста превышают 90%. Для количественной оценки микроальбуминурии существуют следующие два основных метода: (1) прямой иммунотурбидиметрический и (2) косвенный, основанный на существовании сильной корреляции между содержанием в моче креатинина и альбумина. (3) Также для количественной оценки микроальбуминурии применяют иммунохимический метод с помощью системы HemoCue ® Альбумин Мочи. (1) Прямой иммунотурбидиметрический метод, основанный на том, что человеческий альбумин можно определить по реакции со специфическим антителом, при которой в присутствии этиленгликоля происходит быстрая преципитация иммунокомплексов; если имеется значительный избыток антитела, преципитат вызывает турбидность (поглощение света), степень которой зависит от концентрации альбумина в исследуемом образце (турбидность определяют фотометрически при длине световой волны 340 нм). Содержание альбумина в исследуемом образце определяют по калибровочной кривой, которую строят по результатам определения концентрации альбумина с применением набора калибраторов. Калибровочной кривой пользуются либо непосредственно графически, либо с помощью специальной компьютерной программы. Содержание альбумина, определенное во второй после утренней 3-часовой порции мочи, умножают на 8 для получения содержания альбумина в суточной моче. Норма экскреции альбумина при использовании данного метода составляет 25 мг/сут. Минимальная определяемая концентрация альбумина равна 5 мг/л. (2) Концентрацию альбумина в моче по содержанию в ней креатинина определяют при невозможности использования иммунотурбидиметрического метода. Уровень креатинина в моче определяют известными методами. Содержание альбумина рассчитывают по формуле: МАУа = (Са/Ск х 5,65) / 1000, где МАУа – экскреция альбумина (мкг на 1 мг креатинина), Са – концентрация альбумина (мг/л), Ск – концентрация креатинина (мкмоль/л), 5,65 и 1000 – переводные коэффициенты (норма – до 40 мкг/мг). Чувствительность и специфичность иммунотурбидиметрического метода приближаются к 100%; соответствующие характеристики креатининового метода лишь немногим ниже. (3) Иммунохимический метод с помощью системы HemoCue ® Альбумин Мочи основан на иммунохимической реакции, использующей античеловеческие антитела. Комплекс антиген-антитело создает осадок, который улавливается фотометрически в диапазоне 610 нм. HemoCue Система состоит из фотометра, трансформатора и микрокюветы. Микрокювета содержит высушенный замораживанием реактив, необходимый для анализа. Забор мочи в микрокювету происходит капиллярным действием. Преимуществом системы HemoCue является наличие фабричной калибровки, количественное определение микроальбуминурии в моче, быстрое (в пределах 90 секунд) получение результатов, что позволяет ее считать экспресс-методом, она не нуждается в любом дополнительном оборудовании, показывает высокую точность, чувствительность и специфичность и требует минимального обслуживания.
39.Методика микроскопии осадка мочи. Патологические изменения и их клиническое значение. Принцип метода — микроскопическое исследование нативных препаратов мочевого осадка, полученного при центрифугировании мочи. Необходимое оборудование 1. Центрифуга. 2. Микроскоп. 3. Центрифужные пробирки. 4. Предметные и покровные стекла. Ход исследования Приготовление препаратов — в центрифужную пробирку помещают 10 мл утренней мочи после тщательного ее перемешивания. Центрифугируют в течение 5 мин при скорости 2 000 об./мин. Затем быстрым наклоном пробирки сливают прозрачный верхний слой, а оставшийся осадок переносят пипеткой с тонко оттянутым концом на середину предметного стекла и покрывают покровным. Надо стараться перенести осадок с минимальным количеством жидкости, чтобы покровное стекло покрывало его полностью. Большая капля расплывается, колеблется, препарат становится многослойным, и это затрудняет микроскопические исследования. Изучение препарата начинают с малого увеличения (8 ґ 10) для общего обзора, а более детальное изучение препарата с количественной оценкой структур производят при большом увеличении (10 ґ 40). Если структуры встречаются в каждом поле зрения, то количественную оценку выражают их числом в поле зрения, при небольшом количестве структур, когда их встречают далеко не в каждом поле зрения, — числом в препарате. Организованный осадок Эритроциты имеют дискообразную форму, окрашены в характерный желто-зеленый цвет. Включения в цитоплазме отсутствуют. В концентрированной моче кислой реакции эритроциты могут приобретать звездчатую форму. При длительном пребывании эритроцитов в моче низкой относительной плотности они теряют гемоглобин и имеют вид одноконтурных или двухконтурных колец. В норме эритроциты либо не встречаются, либо обнаруживаются единичные в препарате. Гематурия может быть при поражении паренхимы почки (гломерулонефрит, пиелонефрит, опухоли и др.), при тяжелой физической нагрузке и при поражениях мочевыводящих путей (почечных лоханок, мочеточников, мочевого пузыря, уретры). Лейкоциты в моче имеют вид небольших зернистых клеток округлой формы. При низкой относительной плотности мочи размер их увеличивается и в некоторых из них (“активных”) можно наблюдать броуновское движение гранул. При бактериуриях в щелочной моче лейкоциты довольно быстро разрушаются. Лейкоциты в моче представлены главным образом нейтрофилами, но иногда можно обнаружить лимфоциты и эозинофилы, которые отличаются обильной, равномерной, крупной, преломляющей свет зернистостью. Активные лейкоциты, так называемые клетки Штернгеймера-Мальбина, можно выявить следующими способами. I способ Ход исследования Центрифугируют свежую утреннюю мочу. К осадку прибавляют 1—2 капли реактива, размешивают, каплю берут на стекло, покрывают покровным и микроскопируют. При этом различают два вида лейкоцитов: одни имеют ядра пурпурно-красного цвета и бесцветную или бледно-розовую цитоплазму, другие бледно-синее, иногда бледно-фиолетовое ядро и почти бесцветную цитоплазму. Бледно-синие клетки называются клетками Штернгеймера—Мальбина, в цитоплазме некоторых из них заметно активное движение гранул. В норме в мочевом осадке у мужчин от 0 до 3 лейкоцитов в поле зрения, у женщин — от 0 до 5 лейкоцитов в поле зрения. Увеличение числа лейкоцитов в мочевом осадке свидетельствует о воспалительных процессах в почках или мочевыводящих путях. Наличие в моче “активных” лейкоцитов свидетельствует об интенсивности воспалительного процесса независимо от его локализации. Эпителиальные клетки в мочевом осадке имеют различное происхождение, т.е. десквамация их происходит с органов, покрытых различными видами эпителия (многослойного плоского, переходного и кубического призматического). В мочевом осадке практически всегда встречают клетки плоского и переходного эпителия от единичных в препарате до единичных в поле зрения. Единичные в препарате клетки почечного эпителия на фоне нормальной микроскопической картины мочевого осадка не дают основания говорить о патологии. Особого диагностического значения клетки плоского эпителия, попадающие в мочу из влагалища, наружных половых органов и мочеиспускательного канала, не имеют, но если их обнаруживают расположенными пластами в моче, взятой катетером, то это может указывать на метаплазию слизистой оболочки мочевого пузыря. Такую картину можно наблюдать при лейкоплакии мочевого пузыря и мочеточников, что является предопухолевым состоянием. Переходный эпителий выстилает слизистую оболочку мочевого пузыря, мочеточников, почечных лоханок, крупных протоков предстательной железы и простатического отдела мочеиспускательного канала. Усиленная эксфолиация клеток этого эпителия может быть при острых воспалительных процессах мочевого пузыря и лоханок, интоксикациях, а также при мочекаменной болезни и новообразованиях мочевыводящих путей. Клетки почечного эпителия можно выявить в мочевом осадке при поражении паренхимы почек (нефритах), интоксикациях, расстройствах кровообращения. Обнаружение клеток почечного эпителия в тесной связи с цилиндрами говорит о тяжелом поражении почек. Цилиндры — элементы осадка — представляют собой белковые или клеточные образования канальцевого происхождения, имеющие цилиндрическую форму и различную величину. В мочевом осадке различают следующие виды цилиндров: гиалиновые, зернистые, восковидные, эпителиальные, эритроцитарные, пигментные, лейкоцитарные. Гиалиновые цилиндры имеют нежные контуры, прозрачны, при ярком освещении плохо заметны. На поверхности может быть легкая зернистость за счет аморфных солей или клеточного детрита. Образуются из свернувшегося белка. Появление гиалиновых цилиндров свидетельствует о развитии протеинурии, что является следствием повышенной проницаемости клубочковых капилляров. Они представляют собой коллоидную форму белка, возникающую при изменении рН. Зернистые цилиндры имеют более резкие контуры и состоят из плотной зернистой массы желтоватого цвета. Восковидные цилиндры имеют резко очерченные контуры и гомогенную с блеском, слегка желтоватую структуру. Образуются из уплотненных гиалиновых и зернистых цилиндров при задержке их в канальцах. Эпителиальные цилиндры имеют четкие контуры и состоят из клеток почечного эпителия. Эритроцитарные цилиндры желтоватого цвета, состоят из массы эритроцитов, образуются при почечной гематурии. Пигментные цилиндры могут быть обнаружены при гемоглобинурии и миоглобинурии; они коричневого цвета, имеют сходство с зернистыми. Лейкоцитарные цилиндры образуются из массы лейкоцитов, обнаруживаются при гнойных процессах в почках, пиелонефритах. Кроме цилиндров, образованных из белка и клеток, в мочевом осадке иногда встречаются образования цилиндрической формы из аморфных солей, не имеющие практического значения. Эти образования растворяются при подогревании препарата или прибавлении к нему капли щелочи или кислоты. В нормальной моче можно встретить единичные гиалиновые цилиндры (1—2 в препарате). Цилиндрурия является симптомом поражения паренхимы почки; хотя и считается, что вид цилиндров особого диагностического значения не имеет, гиалиновые цилиндры подтверждают ренальную протеинурию, а лейкоцитарные и эритроцитарные дают возможность предположить источник лейкоцитурии и гематурии.
Неорганический осадок мочи Характер неорганического осадка мочи зависит от реакции мочи. В кислой моче выпадают такие кристаллы, каких никогда не бывает в щелочной моче, и наоборот. Особую группу составляют осадки, встречающиеся исключительно при урологических заболеваниях. В кислой моче в осадке содержатся аморфные ураты, кристаллы мочевой кислоты, щавелевокислого кальция, кислого фосфата кальция, мочевины, креатинина, аминокислот, индикана и пигментов, Мочекислые соли (ураты) выпадают в виде кирпично-красного аморфного осадка при кислой реакции мочи или на холоде. Кристаллы кислого урата натрия и аммония могут принимать форму звездчатых пучков или мелкосферических образований. Щавелевокислый кальций (оксалат кальция) — прозрачные, бесцветные и сильно преломляющие свет кристаллы, по своей форме напоминающие почтовые конверты. Они встречаются в моче после приема пищи, богатой щавелевой кислотой (щавель, помидоры, спаржа, зеленые бобы), при сахарном диабете, нефрите, подагре. Цистин. Кристаллы цистина имеют вид правильных, бесцветных прозрачных шестигранных табличек, лежащих рядом или одна над другой, напоминая шестигранный карандаш в поперечном разрезе. Они нерастворимы в воде, алкоголе и эфире, но растворимы в минеральных кислотах и в аммиаке, что позволяет отличить их от сходных кристаллических форм мочевой кислоты. Наличие в моче аминокислоты цистина (цистинурия) связано с нарушением белкового обмена и наследственно обусловленным дефектом реабсорбции ее в канальцах (тубулопатия). В диагностике цистинурии полагаться только на исследование осадка мочи под микроскопом не следует. Необходимо распознавание цистина с помощью химической реакции, применяемой при исследовании цистиновых камней. Холестерин обыкновенно наблюдается в моче при жировой дистрофии печени, эхинококкозе почек и хилурии. Кристаллы холестерина имеют вид гонких бесцветных ромбических табличек с обрезанными углами и ступенеобразными уступами. Билирубин. Кристаллы билирубина встречаются в моче, богатой желчными пигментами, при желтухе, вызванной тяжелыми заболеваниями или токсическими поражениями печени. Они представляют собой тонкие иглы, часто собранные в пучки, реже — ромбические таблички от желтого до рубиново-красного цвета и, как правило, располагаются на поверхности лейкоцитов и эпителиальных клеток. Кристаллы билирубина легко растворяются в хлороформе и щелочах и дают реакцию Гмелина.
40.Клиническое исследование транссудатов и экссудатов. Плевральный выпот. Спинномозговой ликвор. Пунктатом в медицине называют биологический материал, получаемый путем пункции – прокола кожных покровов с забором биологического материала для анализа. Таким материалом может выступать ткань органа или жидкость из полости. Жидкость может находиться в естественной (брюшной, плевральной) или в патологической (полости кисты или абсцесса) полости. Жидкость, получаемая во время пункции, может быть различного происхождения. На основании физико-химических свойств пунктаты-жидкости делят на экссудаты и транссудаты. Главное отличие между этими понятиями состоит в том, что экссудат – это жидкость, выделяющаяся при воспалении, а транссудат – при нарушении регионального кровообращения или лимфообращения (при сердечной недостаточности, циррозе печени). Основанием для взятия пунктата является появление признаков патологического накопления жидкости. Поводом для выполнения пункции и откачивания (аспирации) жидкости являются клинические данные или результаты УЗИ соответствующего органа. Пункцию с аспирацией выполняют при увеличении живота в объеме при асците, затруднении дыхания при плеврите, нарушениях со стороны сердечно-сосудистой системы при эндокардите, нарушении слуха при среднем отите. К заболеваниям, при которых может образовываться транссудат или экссудат относятся средний отит, рак легкого, пневмония, плеврит, цирроз печени, гепатит, перитонит.
Внешне экссудат от транссудата может не отличаться. Большая часть отличий заключается в разнице физико-химических свойств. Транссудат в основном состоит из жидкости, содержание в нем белка и клеточных элементов минимально. Отличить эти два типа жидкостей можно с помощью пробы Ривельта, при которой в емкость с биологическим материалом добавляют раствор уксусной кислоты. Образование мутного облачка и выпадение осадка говорит о том, что материал является экссудатом (положительная проба Ривельта). Различают пунктаты (транс- и экссудаты) и по удельной плотности. У транссудата она не превышает 1015, а у экссудата – более 1015. В экссудате содержится более 30 граммов белка на литр, лейкоцитов – более 1000 в одном микролитре. Виды экссудатов: фибринозный, гнойный, геморрагический, серозный, хилезный, мононуклеарный и другие. Вид определяют по тому, какие элементы преобладают в исследуемом материале. В чем состоит клиническое значение исследования пунктата Основная функция этого исследования – определить характер жидкости. От этого зависит дальнейшая тактика лечения. При экссудативных процессах основное лечение направлено на борьбу с воспалением и подразумевает назначение противомикробных средств. При обнаружении транссудата задача врача состоит в устранении причин, вызвавших нарушение кровообращения и лимфодинамики. Пациенту назначают мочегонные средства, препараты, повышающие тонус сосудов и укрепляющие сосудистую стенку.
Для пункций опухолей, кист и других образований применяют иглы длиной 6-8 см и достаточной толщины. Если предполагается трепанация кости, пользуются иглами Куликовского или Вира. Аспирацию пунктата осуществляют 5- или 10-граммовыми шприцами. Иглы и шприц должны быть сухими и обезжиренными. Перед пункцией поверхностно расположенные подвижные новообразования или увеличенные лимфатические узлы следует фиксировать большим и указательным пальцами левой руки. При пункции иглу вводят так, чтобы ее конец находился в глубине исследуемого образования. Вращательными и колебательными движениями иглы стараются отделить от массы наибольшие участки ткани, которые можно было бы аспирировать. Аспирацию осуществляют всасывающими движениями поршня, но в полость цилиндра пунктат не засасывают, чтобы не было затруднений в переносе пунктата на предметное стекло, а лишь заполняют им просвет иглы. Делают поршнем несколько всасывающих движений, отсоединяя шприц и приводя в исходное положение поршень после каждого всасывающего движения. Заполнив просвет иглы пунктатом, шприц отсоединяют, а иглу извлекают из тканей. Небольшое количество пунктата наносят на сухое обезжиренное предметное стекло и при помощи другого стекла делают мазок, распределяя пунктат тонким слоем. Затем выбирают одно из двух действий: или препарат немедленно направляют в цитологическую лабораторию, или, если это невозможно, производят его окраску методом Романовского—Гимзы или Паппенгейма, предварительно высушив мазок на воздухе. Основными преимуществами цитологического метода являются его простота и быстрое получение результатов. Недостаток метода состоит в том, что: в ряде случаев трудно трактовать результаты исследования; иногда существует ограниченность участка для взятия материала при пункции.
Плевральный выпот — это аномальное увеличение количества жидкости в плевральном пространстве. плевральные выпоты могут быть грубо разделены на две категории: транссудаты и экссудаты. Транссудаты представляют собой фильтраты плазмы и содержат белок в относительно низких концентрациях. Их возникновение связано о избыточным гидростатическим давлением (наблюдаемым, например, при застойной сердечной недостаточности) или с недостаточным онкотическим давлением (как при гипопротеинемических состояниях). Экссудаты содержат относительно большие количества белка и возникают вследствие нарушения нормального механизма "образование — абсорбция". Это может наблюдаться при повреждении эндотелия плевральных капилляров, что обусловливает проникновение белка в плевральное пространство (как при воспалительных или инфекционных процессах), или вследствие блокады лимфатической системы, которая препятствует удалению из плевральной полости высокомолекулярных протеинов (как это имеет место при некоторых злокачественных выпотах). Внутреннее поражение плевры чаще вызывает образование экссудатов, тогда как нормальная плевра ассоциируется с транссудативными плевральными выпотами. Клинические проявления Хотя симптомы, побуждающие больного обращаться к врачу, чаше связаны с предшествующим заболеванием и общим физическим состоянием, собственно плевральный выпот обычно бывает симптоматическим, если он достигает 500 мл. Чаще всего больной жалуется на одышку (в покое или при физической нагрузке). Нередко отмечаются плевритические боли в груди или непродуктивный кашель. Плевритическая боль обычно имеет место в том случае, когда плевральный выпот обусловлен инфекцией. Боль может быть умеренной, но чаще она бывает сильной и описывается больным как "колющая", "острая" или "режущая". Ее интенсивность возрастает при вдохе, часто вызывая прекращение респираторного усилия. Это определяется при осмотре больного по короткому, поверхностному и обычно несколько учащенному дыханию. Хотя боль может быть распространенной, как правило, она имеет загрудинную локализацию. Следовательно, в подобных случаях необходимо исключить другие причины загрудинной боли, обостряющейся при респираторном усилии и дыхательных движениях, например переломы ребер (могут быть патологическими) и остеохондроз. Данные, получаемые при объективном исследовании, весьма вариабельны. Наличие плеврального выпота обусловливает ослабление дыхательных шумов на стороне поражения и уменьшение перкуторного тона над скоплением жидкости. при осмотре больного часто обнаруживаются признаки заболеваний, предрасполагающих к возникновению плевральных выпотов (например, застойной сердечной недостаточности, рака легкого или грудной железы или системные признаки инфекции).
Цереброспинальную жидкость исследуют немедленно после забора. Лабораторное исследование включает 4 больших этапа:
макроскопическое исследование
микроскопическое исследование
биохимическое исследование
бактериологическое и бактериоскопическое исследование
Количественный и качественный состав ликвора имеет важное, значение для диагностики. Белково-клеточная диссоциация (т.е.повышение количество белка при нормальном цитозе) характерна для опухолей мозга. Низкое содержание белка (0,16-0,2%)наблюдается при гидроцефалии.
Клеточно-белковая диссоциация (увеличение количества клеток при нормальном или умеренном повышении содержания белка)характерна для воспалительных заболеваний нервной системы. Высокий цитоз (от 150 до нескольких тысяч клеток в 1 мм.3)наблюдается при острых менингитах различного генеза, умеренный цитоз (от 10до 100 клеток в 1 мм.3) - при арахноидитах, энцефалитах, нейросифилисе и т.д. При серозных менингитах увеличение числа клеток происходит за счет лимфоцитов, при гнойных - за счет полинуклеаров, при цистицеркозе обнаруживаются эозинофилы, при опухолях - опухолевые клетки и других.
Бактериологическое исследование спинно-мозговой жидкости имеет большое диагностическое значение, в частности, для обнаружения туберкулезных палочек, менингококков, стрепто-или стафилококков и т.п.
|
Заболевание |
Цитоз, клеточный состав |
Белок |
Глюкоза |
|
Норма |
≤5/мм3, как правило, лимфоциты |
0,2-0,45 г/л |
45 - 80 |
|
Вирусный менингит/менингоэнцефалит |
10-300/мм3, преимущественно лимфоциты |
↑ |
N |
|
Бактериальный менингит |
1000-10000/мм3, преимущественно нейтрофилы |
↑↑ |
↓↓ |
|
Грибковый менингит |
100-1000/мм3, преимущественно лимфоциты |
↑↑ |
↓ |
|
Туберкулёзный менингит |
100-1000/мм3, преимущественно лимфоциты |
↑↑ |
↓↓ |
|
Карциноматоз мозговых оболочек |
10-100/мм3, преимущественно лимфоциты |
↑ |
↓ |
|
Нейросифилис |
5-300/мм3, преимущественно лимфоциты |
↑ |
N/↓ |
|
Саркоидоз |
5-100/мм3, преимущественно лимфоциты |
↑ |
↓ |
|
Субарахноидальное кровоизлияние |
Эритроциты > 100000/мм3, увеличено количество, преимущественно за счёт нейтрофилов |
↑ |
N/↓ |
В норме цереброспинальная жидкость бесцветна, а по внешнему виду не отличается от воды. При заболеваниях центральной нервной системы возможно изменение цвета ликвора от светло желтого до красного или даже коричневого. Для определения цвета спинномозговую жидкость сравнивают с дистиллированной водой.
Красный оттенок, как правило, обусловлен примесью неизмененной крови (эритроцитархия). Также возможно попадание крови во время пункции - такую кровь называют "путевой"
окраска ликвора обычно в желтоватый или зеленоватый цвет, иногда наблюдается при менингитах, субарахноидальных кровоизлияниях.
Обычно смена окраски спинномозговой жидкости обусловлена присутствием оксигемоглобина, метгемоглобина и билирубина.
Регистрируют интенсивность ксантохромии пользуясь системой плюсов:
резко выраженная 4 (++++)
выраженная 3 (+++)
умеренно выраженная 2 (++)
слабовыраженная 1 (+)
Прозрачность.В норме спинномозговая жидкость должна быть прозрачной.Оценку прозрачности проводят сравнивая полученный материал с дистиллированной водой. Помутнение может свидетельствовать о патологическом процессе и присутствии в материале клеточных и тканевых элементов.Если после центрифугирования СМЖ становится прозрачной, то мутность обусловлена преимущественно наличием форменных элементов, если же остается мутной - микроорганизмов. Легкая опалесценция СМЖ наблюдается также при содержании в ней большого количества грубо дисперсной фракции белка - фибриногена.Фибринозная пленка. В норме в СМЖ практически отстутствует фибриноген. При большой концентрации фибриногена на стенках пробирки образуется нежная почти невидимая сеточка, мешочкек или желеобразной сгусток.
41.Клиническое исследование мокроты. Бронхоальвеолярный лаваж. Исседование мокроты
1. Характер мокроты:
1.1. Слизистая (ОРЗ, катаральный бронхит, бронхиальная астма).
1.2. Слизисто-гнойная (хронический бронхит, пневмония). Представлят собой смесь слизи и гноя с преобладанием слизи.
1.3. Гнойно-слизистая: содержит гной и слизь с преобладанием гноя (хронический гнойный бронхит, бронхоэктатическая болезнь, абсцедирующая пневмония).
1.4. Гнойная : не содержит слизи. Появляется в случае прорыва в дренирующий бронх содержимого абсцесса легкого или эмпиемы плевры.
1.5. Слизисто-кровянистая: состоит из слизи с прожилками крови (массивная пневмония, рак бронха).
1.6. Слизисто-гнойно-кровянистая : содержит все три составляющих, равномерно перемешанных между собой (бронхоэктазы, туберкулез, рак бронха).
1.7. Кровавое отделяемое (легочное кровотечение).
1.8. Серозная мокрота : наблюдается при отеке легких (левожелудочковая недостаточность).
2. Консистенция : 2.1. Вязкая. 2.2. Густая. 2.3. Жидкая.
3. Количество мокроты : может варьировать в широких пределах. 3.1. Скудное количество мокроты выделяется при воспалении дыхательных путей (ОРЗ, трахеит, бронхит). 3.2. Обильное количество мокроты (от 0.5 до 2 л) выделяется обычно из полостей в легочной ткани (абсцесс, эмпиема, мешотчатые бронхоэктазы, кистозная гипоплазия ), при отеке легких. При отстаивании большой порции гнойной мокроты она разделяется на два слоя - гнойный и серозный (абсцесс легкого) или три- гнойный, серозный и слизистый (бронхоэктазы, туберкулезная каверна).
4. Запах. Свежевыделенная мокрота обычно не имеет запаха. Неприятный запах может появлятся при гнойных заболеваниях легких, распадающейся опухоли; зловонный (гнилостный) запах отмечается при гангрене легкого.
5. Патологические включения : 5.1. Спирали Куршмана - слепки мелких бронхов : встречаются при бронхиальной астме. 5.2. Кристаллы Шарко -Лейдена - образуются при распаде эозинофилов (экзогенные формы бронхиальной астмы). 5.3. Гнойные пробки (пробки Дитриха) - встречаются при бронхоэктатической болезни. 5.4. Некротизированные кусочки легкого (абсцесс, гангрена), кусочки распадающейся опухоли, инородные тела.
6. Микроскопическое исседование мокроты позволяет обнаружить :
6.1. Опухолевые (атипические) клетки.
6.2. Лейкоциты - встречаются в любой мокроте; в слизистой - единичные (до 8-10 в поле зрения), в гнойной - сплошь покрывают все поле зрения. При неспецифическом воспалении преобладают нейтрофилы, при туберкулезном -лимфоциты.
6.3. Эритроциты единичные могут встречатся в любой мокроте; в большом количестве обнаруживаются при кровохарканье и легочном кровотечении (инфаркт легкого, распространенные пневмонией, бронхоэктатическоя болезнь, полостные образования в легочной ткани, отек легких).
6.4. Эозинофилы: обнаружение в мокроте более 20 процентов эозинофилов позволяет предположить экзогенную форму бронхиальной астмы.
7. Микробиологическое обследование (бактериоскопия окрашенных мазков, посевы мокроты на специальные питательные Среды) позволяет выявить и индентифицировать возбудителей легочной инфекции, а также определить их чувствительность к антибактериальным препаратам.
Компьютерная и ядерно-магнитно-резонансная (ЯМР-) томография - наиболее совершенные, но пока еще труднодоступные для широкого применения методы исследования, позволяющие дифференцировать очень незначительно различающиеся ткани и изменения в них, что позволяет выявлять различные патологические изменения в легких с высокой степенью точности.
Брохоскопия
Диагностическая бронхоскопия позволяет визуально оценить особенности дыхательных путей от голосовой щели до субсегментарных бронхов, получить образцы содержимого дыхательных путей на разных уровнях цитологического и бактериологического исследования, провести бронхоальвеолярный лаваж с последующим забором полученной жидкости. С помощью бронхоскопа можно произвести пункционную биопсию слизистой оболочки бронха, а также трансбронхиальную биопсию прилежащих тканей (лимфатический узел, паренхима лёгкого).
Цели: Установление источника кровотечения и его остановка. Выявление возможной эндобронхиальной опухоли, не видимой на рентгенограмме. Исключение локальной бронхиальной обструкции Установление причины ателектаза. Биопсия, оценка перабельности рака легкого. Исключение обструкции бронха, получение материала для бактериологического исследования и улучшение дренажа полостного образования. Промывание бронхов, введение ЛС (например, антибиотиков) Разжижение и отсасывание слизи. Удаление инородных тел.
Бронхоскопию применяют и с лечебной целью, например для промывания бронхов и местного введения антибактериальных средств (санация бронхов), для разжижения и отсасывания слизи из просвета закупоренных бронхов при некупирующемся риступе бронхиальной астмы. Она так же позволяет установить источник кровотечения и его причину (бронхоэктазы, пухоль, туберкулёз).
Радионуклидные методы
Суть методов состоит во введении в кровеносное русло радиоактивных изотопов и последующей оценке их распределения в органах грудной клетки с помощью специальных аппаратов (сканеры, гамма-камера и т.п.). В пульмонологической практике обычно используют радиоактивные изотопы технеция (Тс99), галлия (67Gа), ксенона (133Хе)‚ индия (133In), фосфора (32Р). Радионуклидные методы позволяют оценить перфузионные свойства (технеций), региональную вентиляцию (ксенон), пролиферативную клеточную активность интерстиция, лимфатических узлов (галлий). Например, данное исследование с высокой степенью достоверности позволяет выявить нарушения перфузии участка лёгочной ткани при эмболии ветви лёгочной артерии. Активный саркоидоз характеризуется накоплением изотопа галлия в лимфатических узлах средостения.
Радионуклидные методы
Суть методов состоит во введении в кровеносное русло радиоактивных изотопов и последующей оценке их распределения в органах грудной клетки с помощью специальных аппаратов (сканеры, гамма-камера и т.п.). В пульмонологической практике обычно используют радиоактивные изотопы технеция (Тс99), галлия (67Gа), ксенона (133Хе)‚ индия (133In), фосфора (32Р). Радионуклидные методы позволяют оценить перфузионные свойства (технеций), региональную вентиляцию (ксенон), пролиферативную клеточную активность интерстиция, лимфатических узлов (галлий). Например, данное исследование с высокой степенью достоверности позволяет выявить нарушения перфузии участка лёгочной ткани при эмболии ветви лёгочной артерии. Активный саркоидоз характеризуется накоплением изотопа галлия в лимфатических узлах средостения.
Исследование лаважной жидкости Широкое распространение получило микроскопическое исследование жидкости — смыва со стенок субсегментарных бронхов — так называемои бронхоальвеолярной лаважной жидкости. Нормальны клеточный состав лаважной жидкости у некурящих представлен преимущественно альвеолярными макрофагами (до 90%)‚ палочкоядерными лейкоцитами (1—2%)‚ лимфоцитами (7—12%)‚ а также клетками эпителия бронхов (1—5%). Изменения клеточного состава лаважной жидкости, активности альвеолярных макрофагов и ряда других иммунологических и биохимических показателей имеют важное диагностическое значение. Например, при саркоидозе (диффузное поражение лёгких) в бронхоальвеолярной промывной жидкости отмечают преобладание лимфоцитов над нейтрофилами. Обнаружение в лаважной жидкости грибов, пневмоцист и других микроорганизмов позволяет диагностировать редкие варианты бронхолёгочной инфекции (например, пневмоцистную пневмонию при ВИЧ-инфекции).
ФВД
Один из доступных способов - спирометрия (исследование ФВД с помощью спирометра).
Спирометр создает запись (спиротрамму) кривой изменения объемов относительно оси времени (в секундах), когда пациент дышит спокойно (при измерении дыхательного объёма и минутного объема дыхания), или проиводит максимально глубокий вдох и затем выдыхает воздух максимально быстро и сильно (тест Тиффно). Многие результаты спирометрических измерений представляют в виде процентов от должных величин. Основные спирографические показатели (лёгочные объёмы) подразделяют на статические и динамические. Объёмные статические характеристики. — ЖЁЛ - максимальный объём воздуха, который может быть изгнан из лёгких вслед за максимальным вдохом. -— Дыхательный объём -— - объём воздуха, вдыхаемый за один вдох при спокойном дыхании (норма 500—800 мл). Часть дыхательного объёма, участующую. в газообмене, называют альвеолярным объемом, остаток(около 30% lsхательного объёма) — «мёртвым пространством», под которым понимают прежде всего «анатомическую» остаточную ёмкость легких (воздух, находящийся в проводящих воздухоносных путях). Объёмные динамические показатели.
-— Форсированная жизненная ёмкость лёгких (ФЖЁЛ; объем воздуха, который может быть изгнан из легких с макс. возможной силой и скоростью после максимального вдоха.
-— Объём форсированного выдоха за 1 сек (ОФВ1) -— объём воздуха, который рый может быть изгнан с максимальным усилием в течение первой секунды после глубокого вдоха, т.е. часть ФЖЁЛ, выдыхаемая за 1 сек. ОФВ1 прежде всего отражает состояние крупных дыхательных путей. (нормальное значение ОФВ1 —— 75% от ЖЕЛ) -— Отношение ОФВ1/ФЖЁЛ (индекс Тиффно) выражают в процентах (в норме не менее 70%). Индекс Тиффно возрастает с увеличением усилия выдоха. Если снижается только ОФВ1 (индекс Тиффно менее 70%), это обструкция; если снижены и ОФВ1 и ФЖЁЛ (индекс = или >70%), это рестрикция. Так же используется пневмотахеометрия ( методика, позволяющая определить изменения объемной скорости потока вдыхаемого и выдыхаемого воздуха на протяжении дыхательного цикла) и исследования газового состава крови. 42.Принципы и основные параметры копрологического исследования. Клиническое значение. Копрологический анализ кала представляет собой метод исследования, позволяющий получить информативные данные о характере патологических изменений в органах желудочно-кишечного тракта, а особенно о функциональном состоянии прямой кишки. Сущность анализа заключается в макроскопической оценке физико-химических свойств кала, микроскопическом и химическом исследовании материала. Исследуют:
цвет
- консинстенцию
Количество
Цвет
Запах,реакция pH,скрытая кровь, гемоглобин, слизь,мыш,волокна,
теркобилин (уробилиноген) – являются продуктами, образующимися в результате распада гемоглобина, происходящего в кишечнике. Стеркобилин способен окрашивать каловые массы в коричневый цвет, при отсутствии его кал обесцвечивается. уменьшение содержания стеркобилина в кале наблюдается при гепатитах, поражающих паренхиму печени, остром панкреатите, холангите повышение содержания стеркобилина обнаруживается при анемиях гемолитического происхождения
. Билирубин в кале обнаруживается при следующих патологических состояниях: повышенная моторика кишечника ускоренная эвакуация кишечного содержимого тяжёлые формы дисбактериоза, вызванные длительным применением антибиотиков и сульфаниламидов Стеаторея — это выделение избыточного количества жира с каловыми массами. При стеаторее количество выделяемых с калом жиров за сутки превышает 5 граммов
При отсутствии жёлчи (или недостатке в ней жёлчных кислот) жиры перестают абсорбироваться и выделяются с калом, который вместо обычного коричневого становится белого или серого цвета жирной консистенции. Такое состояние называется стеаторея, её следствием является отсутствие в организме важнейших жирных кислот, жиров и витаминов, а также патологии нижних отделов кишечника, которые не приспособлены к столь насыщенному непереваренными жирами химусу.
43.Физиология гемостаза. Функционирование тромбоцитов, эндотелиальной стенки, коагуляционного каскада. Компоненты системы противосвертывания, механизмы функционирования. Методы исследования. Забор крови для коагулогических анализов. Нормальная коагулограмма Сосудисто-тромбоцитарный механизм гемостаза. Этот механизм обеспечивает гемостаз в наиболее часто травмируемых мелких сосудах (микроциркуляторных) с низким артериальным давлением. Он состоит из ряда последовательных этапов.
1. Кратковременный спазм поврежденных сосудов, возникающий под влиянием сосудосуживающих веществ, в том числе и высвобождающихся из тромбоцитов (адреналин, норадреналин, серотонин).
2. Адгезия (прилипание) тромбоцитов к раневой поверхности, происходящая в результате изменения в месте повреждения отрицательного электрического заряда внутренней стенки сосуда на положительный. Тромбоциты, несущие на своей поверхности отрицательный заряд, прилипают к травмированному участку. Адгезия тромбоцитов завершается за 3-10 секунд.
3. Обратимая агрегация (скучивание) тромбоцитов у места повреждения. Она начинается почти одновременно с адгезией и обусловлена выделением поврежденной стенкой сосуда и клетками крови биологически активных веществ (АТФ, АДФ). В результате образуется рыхлая тромбоцитарная пробка, через которую проходит плазма крови.
4. Необратимая агрегация тромбоцитов, при которой тромбоциты теряют свою структурность и сливаются в гомогенную массу, образуя пробку, непроницаемую для плазмы крови. Эта реакция происходит под действием тромбина, разрушающего мембрану тромбоцитов, что ведет к выходу из них физиологически активных веществ: серотонина, гистамина, ферментов и факторов свертывания крови. Выделение активаторов способствует вторичному спазму сосудов. Освобождение фактора 3 дает начало образованию тромбоцитарной протромбиназы, т. е. включению механизма коагуляционного гемостаза. На агрегатах тромбоцитов образуется небольшое количество нитей фибрина, в сетях которого задерживаются форменные элементы крови.
5. Ретракция тромбоцитарного тромба, т. е. уплотнение и закрепление тромбоцитарной пробки в поврежденном сосуде за счет фибриновых нитей - и гемостаз на этом заканчивается.
В крупных сосудах тромбоцитарный тромб, будучи непрочным, не выдерживает высокого кровяного давления и вымывается. Для формирования более прочного фибринового тромба включаются механизмы ферментативного коагуляционного гемостаза. Коагуляционный механизм гемостаза. Коагуляционный гемостаз активируется при травме крупных сосудов и протекает через ряд последовательных фаз и включает два механизма – внешний и внутренний Первая фаза. Самой сложной и продолжительной фазой является формирование протромбиназы. Этот процесс осуществляется через внешний механизм активации.
Образование тканевой протромбиназы запускается тканевым тромбопластином (фосфолипиды), представляющего собой фрагменты клеточных мембран, образующиеся при повреждении стенок сосуда и окружающих тканей. Тромбоцитарный и эритроцитарный тромбопластины высвобождаются при разрушении тромбоцитов и эритроцитов. Участвуют плазменные факторы VII, ионы Са+, X, а также V. Эта фаза длится 5-10 с.
Внутренний механизм свертывания крови протекает медленнее, чем внешний. Начальной реакцией является активация XII фактора, которая осуществляется при его контакте с обнажающимися при повреждении сосуда волокнами коллагена. Затем фактор XII с помощью активированного им калликреина и кинина активирует фактор XI, образуя с ним комплекс. На фосфолипидах разрушенных тромбоцитов и эритроцитов завершается образование комплекса фактор XII + фактор XI. В дальнейшем реакции образования кровяной протромбиназы протекают на матрице фосфолипидов. Под влиянием фактора XI активируется фактор IX, который реагирует с фактором IV (ионы кальция) и VIII, образуя кальциевый комплекс. Он адсорбируется на фосфолипидах и затем активирует фактор X. Этот фактор на фосфолипидах же образует комплекс фактор Х + фактор V + фактор IV и завершает образование кровяной протромбиназы. Образование кровяной протромбиназы длится 5-10 минут. Вторая фаза. Образование протромбиназы знаменует начало второй фазы свертывания крови - образование тромбина из протромбина. Протромбиназа адсорбирует протромбин и на своей поверхности превращает его в тромбин. Этот процесс протекает с участием факторов IV, V, X, а также факторов 1 и 2 тромбоцитов. Вторая фаза длится 2-5 с. Третья фаза. В третьей фазе происходит образование (превращение) нерастворимого фибрина из фибриногена. Эта фаза протекает в три этапа. На первом этапе под влиянием тромбина происходит отщепление пептидов, что приводит к образованию желеобразного фибрин-мономера. Затем с участием ионов кальция из него образуется растворимый фибрин-полимер. На третьем этапе при участии фактора XIII и фибриназы тканей, тромбоцитов и эритроцитов происходит образование окончательного (нерастворимого) фибрин-полимера. Фибриназа при этом образует прочные пептидные связи между соседними молекулами фибрина-полимера, что в целом увеличивает его прочность и устойчивость к фибринолизу. В этой фибриновой сети задерживаются форменные элементы крови, формируется кровяной сгусток (тромб), который уменьшает или полностью прекращает кровопотерю.
Спустя некоторое время после образования сгустка тромб начинает уплотняться, и из него выдавливается сыворотка. Этот процесс называетсяретракцией сгустка. Он протекает при участии сократительного белка тромбоцитов (тромбостенина) и ионов кальция. В результате ретракции тромб плотнее закрывает поврежденный сосуд и сближает края раны.
Одновременно с ретракцией сгустка начинается постепенное ферментативное растворение образовавшегося фибрина - фибринолиз, в результате которого восстанавливается просвет закупоренного сгустком сосуда. Расщепление фибрина происходит под влиянием плазмина (фибринолизина), который находится в плазме крови в виде профермента плазминогена, активирование которого происходит под влиянием активаторов плазминогена плазмы и тканей. Плазмин разрывает пептидные связи фибрина, в результате чего фибрин растворяется.
Ретракцию кровяного сгустка и фибринолиз выделяют как дополнительные фазы свертывания крови.
Нарушение процесса свертывания крови происходит при недостатке или отсутствии какого-либо фактора, участвующего в гомеостазе. Так, например, известно наследственное заболевание гемофилия, которое встречается только у мужчин и характеризуется частыми и длительным кровотечением. Это заболевание обусловлено дефицитом факторов VIII и IX, которые называются антигемофильными.
Свертывание крови может протекать под влиянием факторов, ускоряющих и замедляющих этот процесс.
образования внутрисосудистых тромбов существуют постоянно. Поддержание жидкого состояния крови обеспечивается по принципу саморегуляции с формированием соответствующей функциональной системы. Главными аппаратами реакций этой функциональной системы являются свертывающая и противосвертывающая (антикоагулянтная и фибринолитическая) системы.
Некоторые авторы выделяют первую и вторую противосвертывающие системы.
Первая противосвертывающая система (ППС) осуществляет нейтрализацию тромбина в циркулирующей крови при условии его медленного образования и в небольших количествах. Нейтрализация тромбина осуществляется теми антикоагулянтами, которые постоянно находятся в крови, и поэтому ППС функционирует постоянно. К таким веществам относятся:
фибрин, который адсорбирует часть тромбина;
антитромбины (известно 4 вида антитромбинов), они препятствуют превращению протромбина в тромбин;
гепарин - блокирует фазу перехода протромбина в тромбин и фибриногена в фибрин, а также тормозит первую фазу свертывания крови;
продукты лизиса (разрушения фибрина), которые обладают антитромбиновой активностью, тормозят образование протромбиназы;
клетки ретикуло-эндотелиальной системы, которые поглощают тромбин плазмы крови.
При быстром лавинообразном нарастании количества тромбина в крови ППС не может предотвратить образование внутрисосудистых тромбов. В этом случае в действие вступает вторая противосвертывающая система (ВПС), которая обеспечивает поддержание жидкого состояния крови в сосудах рефлекторно-гуморальным путем по следующей схеме. Резкое повышение концентрации тромбина в циркулирующей крови приводит к раздражению сосудистых хеморецепторов. Импульсы от них поступают в гигантоклеточное ядро ретикулярной формации продолговатого мозга, а затем по эфферентным путям к ретикуло-эндотелиальной системе (печень, легкие и др.). В кровь выделяются в больших количествах гепарин и вещества, которые осуществляют и стимулируют фибринолиз (например, активаторы плазминогена). Гепарин ингибирует первые три фазы свертывания крови, вступает в связь с веществами, которые принимают участие в свертывании крови. Образующиеся при этом комплексы с тромбином, фибриногеном, адреналином, серотонином, фактором XIII и др. обладают антикоагулянтной активностью и литическим действием на нестабилизированный фибрин.
Основные показатели коагулограммы следующие:
Время свертывания означает временной промежуток между тем, как кровь начала идти из ранки, например, при порезе пальца, и тем моментом, когда кровь останавливается, поскольку в ней образуется сгусток фибрина. Интервал этот в норме для капиллярной крови составляет от 30 секунд до 3-5 минут. Венозная кровь сворачивается дольше – в течение 5-10 минут. Данный показатель говорит о том, как тромбоциты справляются со своей работой.
Длительность кровотечения из ранки может быть больше, если число тромбоцитов снижено по какой-либо причине, если наблюдается нехватка витамина С или человек долго принимает лекарства-антикоагулянты, например, аспирин, а также при гемофилии или болезнях печени. Быстрее кровь сворачивается после перенесенных обильных кровотечений и при использовании средств гормональной контрацепции.
Протромбиновый индекс (ПТИ) измеряют как отношение времени свертывания плазмы крови здорового человека, так называемой, контрольной крови, к времени свертывания крови больного, у которого берется анализ. Значение ПТИ показывает состояние печени человека. При беременности данный показатель возрастает – это нормально. Патологический сдвиг в большую сторону значения протромбинового индекса происходит при применении пероральных противозачаточных препаратов, а также если есть риск возникновения тромбов. При снижении ПТИ, появляется опасность кровотечений.
При анализе коагулограмма крови норма протромбинового индекса колеблется в пределах 93-107%. Для поддержания нормального состояния этого показателя организму нужен витамин К.
Тромбиновое время, равное в норме 15-18 секундам, измеряет интервал превращения фибриногена в фибрин. Если тромбиновое время меньше нормы, скорей всего, в крови избыток фибриногена. Удлинение тромбинового промежутка связано с наследственным недостатком этого белка или с тяжелой печеночной недостаточностью.
При использовании в лечении пациента гепарина данный показатель необходимо строго контролировать!
Активированное частичное тромбопластиновое время (АЧТВ) — самый чувствительный показатель свертываемости крови, обозначающий время образования кровяного сгустка после соединения с плазмой хлорида кальция и с рядом других компонентов. В норме коагулограмма ачтв показывает интервал 30-40 секунд. Показатель чутко реагирует на изменение любой другой составляющей коагулограммы в пределах 30 или 40 процентов. Увеличение АЧТВ наблюдается при дефиците витамина К и заболеваниях печени.
Активированное время рекальцификации (АВР) помогает понять, как протекает один из этапов свертывания крови. В норме показатель колеблется в пределах от 50 до 70 секунд. Если в анализе коагулограмма авр короче нормативного, значит можно говорить о состоянии тромбофилии. При удлинении временного промежутка появляется опасность обильной кровопотери в случае кровотечения. Увеличение времени рекальцификации происходит из-за снижения в крови числа тромбоцитов, при гепариновой терапии, при критических состояниях, таких как ожог, травма, шок.
Концентрация фибриногена составляет в норме от 5,9 до 11,7 мкмоль/л. Понижается показатель при болезнях, поражающих печень. Повышается — при злокачественных новообразованиях, при нехватке гормонов щитовидной железы, острых инфекционных заболеваниях.
Растворимые фибрин-мономерные комплексы (РФМК) показывают изменение молекул фибрина под действием плазмина и тромбина. Верхний предел нормы РФМК на 100 мл составляет 4 мг. При исследовании коагулограмма рфмк расшифровка показателя служит маркером внутрисосудистого свертывания крови. Изменение его зависит от тех же причин, что и варьирование фибриногена.
Тромботест позволяет зрительно увидеть количество содержащегося в крови фибриногена. Нормой является тромботест 4 или 5 степени.
Толерантность плазмы к гепарину показывает количество в крови тромбина. Анализ определяет время, за которое в плазме крови образуется сгусток фибрина после введения в неё гепарина. В нормальной крови здорового человека это происходит за 7-15 минут. О снижении устойчивости крови к действию гепарина свидетельствует промежуток толерантности более четверти часа. Снижается гепариновая устойчивость при болезнях печени. Меньше семи минут время толерантности будет при гиперкоагуляции, характерной для беременности, раковых опухолей, послеоперационных периодов, заболеваний сердечно-сосудистой системы.
Фибринолитическая активность характеризует способность крови самостоятельно растворять появившиеся тромбы. За этот показатель отвечает в плазме фибринолизин, способный расщеплять структуру тромба. Если тромбы в крови растворяются быстрее нормы, значит у человека повышенная кровоточивость.
Продолжительность кровотечения по Дьюкухарактеризует время кровотечения при уколе пальца специальным ланцетом. Укол делается на определенную глубину – 4 мм. Затем через каждые 15-30 секунд с помощью особой бумаги с ранки снимается одна капелька выступившей крови. При этом бумага не касается пальца. После удаления одной капли крови, засекается время, когда из ранки выступит следующая. Таким образом проверяется время остановки капиллярного кровотечения. В норме оно составляет примерно от 1,5 до 2-х минут. На результат этой пробы влияют серотонин и кровяные пластинки.
Фибриноген – это синтезируемый печенью белок. При определенных факторах он преобразуется в кроветворной системе в высокомолекулярный белок фибрин. Волокна фибрина служат основой для образования тромбов. Содержание фибриногена в здоровой крови должно быть в пределах 2-4 г/л.
Опасное снижение уровня фибриногена коагулограмма показывает при:
Токсикозах во время беременности.
Сбоях в работе гемостаза.
Циррозе печени.
Тяжелой форме гепатита.
Недостатке витаминов группы В и аскорбиновой кислоты.
Приёме рыбьего жира.
Использовании анаболиков, антикоагулянтов.
Увеличивается содержание фибриногена в крови при пневмонии, острых инфекциях и различных воспалительных процессах, после родов, во время беременности, после перенесенных операций, при ожоговых травмах, гипотиреозе, инфаркте или инсульте, как последствие приема гормональных препаратов.
Фибриноген В – в анализе здоровой крови данный маркер должен быть негативным.
Ретракция кровяного сгустка — нормальный её уровень в процентах составляет от 44 до 65. Это показатель уменьшения в объеме кровяного сгустка, его сокращения с выделением при этом сыворотки крови. Повышение ретракции характерно для анемий. Снижение происходит вследствие увеличения количества эритроцитов и уменьшения тромбоцитов.
Время рекальцификации плазмы (ВРП) в норме составляет от 60 до 120 секунд. Это один из важных показателей гемостаза, перекликающийся с АВР и фиксирующий время свертывания оксалатной и цитратной плазмы, которое засекается с момента введения в неё солей кальция. Сокращение времени рекальцификации свидетельствует о гиперактивности системы свертывания.
Преаналитический этап коагулопатических исследований : Рекомендации : - по возможности осуществлять пункцию вены без жгута( или со жгутом не более 1 мин ) -кровь береться в специальный пробирки , содержащие 3,8% цитрата Na с использованием вакуумной техники -быстрое смешивание пробы крови с антикоагулянтом (5-7 кратное переворачивание) -если выполняеться открытый забор крови , должны использоваться пластиковые прибирки , а кровь должна поступать из иглы прямо в пробирку с цитратом Na без использования шприца -доставка в лабораторию в течение 2-х часов от получения материала Изучаемые тесты коагуляции : - начальные исследования (скриниг) 1.протромбиновый тест 2.активированное частичное тромбопластиновое время 3.тромбиновое/рептилазное время 4.фибриноген 5.лизис эуглобулинов 6.время кровотечения -при подозрении на гипокоагуляцию 1.активность кофактора ристоцетина- ФФВ 2.фактор 13 3.количество и агрегация тромбоцитов 4.отдельные факторы и ингибиторы к ним 5.ингибиторы фибринолиза -при подозрении на гиперкоагуляцию 1.компоненты системы свертывания крови (фибриноген и его активная форма , фактор 8 , резистентность фактора 5 к ПрС) 2.волчаночный антикоагулянт 3.компоненты системы противосвертывания(Гк-2 , ПрС) 4.Активаторы фибринолиза , включая факторы 12 и прекалликреин 5.ингибиторы активаторов фибринолиза
44.Скрининговые тесты исследования системы гемостаза. Значение протромбинового теста, активированного частичного тромбопластинового и тромбинового времени. Проблемы, связанные с проведением протромбинового теста. Методы контроля гепаринотерапии. Скрининговые тесты на состояние внутреннего и внешнего каскада активации протромбиназы позволяют выявлять нарушения со стороны факторов-субстратов, кофакторов, ингибиторов каскада свертывания, а также действие некоторых лекарственных препаратов или аутоантител. Основным тестом на состояние внутреннего каскада свертывания плазмы является АПТВ, на состояние внешнего каскада - протромбиновое время.
