
- •Предисловие
- •Глава 1. Введение в обмен углеводов
- •1.1 Общая характеристика обмена углеводов
- •1.2 Классификация и структура углеводов
- •Б Полисахариды
- •1.3 Переваривание углеводов пищи
- •А Переваривание углеводов в ротовой полости
- •В Пристеночное пищеварение или гидролиз олиго- и дисахаридазами
- •1.4 Всасывание и транспорт углеводов
- •А Na+-зависимые транспортеры глюкозы
- •Б Na+-независимые транспортеры глюкозы
- •1.5 Пути использования глюкозы в клетках
- •1.6 Гликолиз
- •Б Схема гликолиза
- •1.7 Реакции гликолиза
- •Г Реакция 2
- •Е Реакция 4
- •Ж Реакция 5
- •И Реакция 7
- •К Реакция 8
- •Л Реакция 9
- •М Реакция 10
- •Н Реакция 11
- •1.8 Энергетический баланс гликолиза
- •А Аэробный гликолиз
- •Б Анаэробный гликолиз
- •1.9 Регуляция гликолиза
- •Б Гормональная регуляция
- •1.10 Пути использования пирувата в клетках
- •1.11 Эффекты Пастера и Кребтри
- •Б Эффект Кребтри
- •1.12 Вовлечение других углеводов в гликолиз
- •А Фруктоза
- •Мышцы
- •Печень
- •Б Галактоза
- •В Манноза
- •Термины
- •Вопросы к семинарскому занятию
- •Дополнительные вопросы и ключевые слова
- • Переваривание, абсорбция и транспорт углеводов
- • Гликолиз
- • Метаболизм глюкозы в других клетках и тканях
- •Вопросы для самопроверки
- •Глава 2. Глюконеогенез
- •2.1 Общая характеристика глюконеогенеза
- •2.2 Субстраты глюконеогенеза
- •А Пируват и лактат
- •Б Глюкогенные аминокислоты
- •В Глицерол
- •Г Жирные кислоты
- •2.3 Реакции глюконеогенеза
- •Реакция 1
- •Реакция 2
- •Реакции 3-8
- •Реакция 9
- •Реакция 10
- •Реакция 11
- •В Общая схема глюконеогенеза
- •2.4 Энергетический баланс глюконеогенеза
- •2.5 Биохимический смысл глюконеогенеза и его регуляция
- •Б Механизмы регуляции
- •Аллостерическая регуляция
- •Гормональная регуляция
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- • Глюконеогенез
- •Вопросы для самопроверки
- •Глава 3. Обмен гликогена
- •3.1 Общая характеристика
- •3.2 Структура и функции гликогена
- •Б Структура гликогена
- •3.3 Синтез гликогена (гликогеногенез)
- •В Синтез УДФ-глюкозы
- •Реакция 1
- •Реакция 2
- •Реакция 3
- •Г Синтез праймера
- •Д Элонгация цепей гликогена
- •Реакция 4
- •Е Образование ветвей
- •3.4 Распад гликогена (гликогенолиз)
- •Б Уравнения реакций
- •В Укорочение цепей гликогена
- •Реакция 1а
- •Г Отщепление ветвей
- •Реакция 1б
- •Е Расщепление гликогена в лизосомах
- •3.5 Регуляция обмена гликогена
- •А Аллостерическая регуляция
- •Гликогенфосфорилаза
- •Гликогенсинтаза
- •Глюкагон и адреналин
- •Инсулин
- •Ca2+-зависимая регуляция обмена гликогена
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- • Метаболизм гликогена
- •Вопросы для самопроверки
- •Глава 4. Цикл трикарбоновых кислот
- •4.1 Общая характеристика
- •4.2 Окислительное декарбоксилирование пирувата
- •А Строение пируватдегидрогеназного комплекса
- •Реакция 1
- •Реакция 2
- •Реакция 3
- •Реакция 4
- •Реакция 5
- •4.3 Цикл трикарбоновых кислот
- •Б Схема цикла трикарбоновых кислот
- •Г Реакции ЦТК
- •Реакция 1
- •Реакция 2
- •Реакция 3
- •Реакция 4
- •Реакция 5
- •Реакция 6
- •Реакция 7
- •Реакция 8
- •Д Энергетический баланс ЦТК
- •4.4 Регуляция ЦТК и окислительного декарбоксилирования пирувата
- •Регуляция с помощью количества субстрата
- •Ингибирование метаболитами цикла
- •4.5 Амфиболическая роль ЦТК
- •Б Анаплеротические реакции
- •Пируваткарбоксилаза
- •Малик-фермент
- •Фосфоенолпируваткарбоксикиназа
- •Реакции катаболизма аминокислот
- •Реакции катаболизма жирных кислот
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- • Окислительное декарбоксилирование пирувата (ОДП)
- • Цикл трикарбоновых кислот (ЦТК)
- • Анаплеротические пути
- •Вопросы для самопроверки
- •Глава 5. Пентозофосфатный путь
- •5.1 Общая характеристика
- •5.2 Реакции пентозофосфатного пути
- •А Схема пентозофосфатного пути
- •В Окислительная фаза
- •Реакция 1
- •Реакция 2
- •Реакция 3
- •Г Неокислительная фаза
- •Реакция 4
- •Реакция 5
- •Реакция 6
- •Реакция 7
- •Реакция 8
- •5.3 Сценарии и регуляция пентозофосфатного пути
- •Б Сценарии пентозофосфатного пути
- •В Ксилулозо-5-фосфат как регуляторная молекула
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- • Пентозофосфатный путь
- • Путь уроновых кислот
- •Вопросы для самопроверки
- •Рекомендуемая литература

Регуляция обмена гликогена 53
каскад, приводящий к фосфорилированию (глюкагон и адреналин) и дефосфорилированию ферментов.
А Аллостерическая регуляция
Ферменты гликогенсинтаза и гликогенфосфорилаза способны «реагировать» на уровень метаболитов и энергии в клетке. Синтез гликогена — гликогеногенез — активен при большом количестве субстратов и энергии в клетке. Распад гликогена — гликогенолиз — происходит, когда количество глюкозы и энергии снижается.
Прежде чем приступить к описанию механизма аллостерической регуляции, рассмотрим сами ферменты, которые ей подвержены.
Гликогенфосфорилаза
Гликогенфосфорилаза катализирует отщепление остатков глюкозы от молекулы гликогена. Этот фермент является аллостерическим и может находиться может находиться в двух состояниях:
1.Фосфорилированное состояние является активным и называется a-формой. Стимулируется глюкагоном и адреналином. Особенностью данного состояния является его невосприимчивость к аллостерическим ингибиторам (глюкозо-6-фосфату, АТФ).
2.Дефосфорилированное состояние является неактивным и называется
b-формой. Стимулируется гормоном инсулином.
Каждое из этих состояний может принимать одну из двух конформаций (см.
Рис. 17):
1.R-конформация активна и хорошо связывает остатки фосфорной кислоты (субстрат реакции). Превалирует у фосфорилированных молекул фермента.
2.T-конформация неактивна и не способна связываться с остатками
фосфорной кислоты. Преобладает у нефосфорилированной гликогенфосфорилазы.
Фосфорилирование и дефосфорилирование гликогенфосфорилазы происходит под действием гормонов и относится к гормональной регуляции. Аллостерическая регуляция позволяет изменять конформацию фермента: T ↔ R.
Поведение гликогенфосфорилазы соответствует параллельной модели кооперативного взаимодействия: связывание аллостерического эффектора одновременно меняет конформацию обеих субъединиц фермента.
Между мышечной и печёночной гликогенфосфорилазой есть небольшие отличия в аллостерической регуляции:
1.Печёночная гликогенфосфорилаза ингибируется глюкозо-6-фосфа-
том, АТФ и глюкозой (т.е. переходит в неактивную T-конформацию). Как правило, в печени фермент обычно находится в активной a-форме. При избытке глюкозы он переходит из R-конформации в неактивную T-конформацию.
2.Мышечная гликогенфосфорилаза ингибируется глюкозо-6-фосфа-
том и АТФ (переходит в Т-конформацию) и активируется АМФ (принимает активную R-конформацию). При больших физических нагрузках в

54 |
Глава 3 |
Обмен гликогена |
мышцах образуется много молекул АМФ, которые сигнализируют о резком снижении «доступной энергии» и необходимости в глюкозе для работы мышц. В расслабленных мышцах гликогенфосфорилаза чаще всего находится в неактивной b-форме. Как только возникает потребность в глюкозе, АМФ способен активировать даже неактивную гликогенфосфорилазу b, изменив её конформацию с T на R.
Рис. 17. Регуляция гликогенфосфорилазы. Фермент может находится в 4 состоя-
ниях: фосфорилированном T и R и дефосфорилированном T и R. Фосфорилированное состояние (а-форма) является активным для фосфорилазы. При этом фосфорилированная форма может иметь как R-конформация (более активную), так и T- конформация (менее активную). То же относится и к дефосфорилированной форме (b-форме). Самым активным является состояние a+R, а наименее активным — b + T (зелёным цветом отмечена самая активная форма, а красным — наименее активная).
Биохимический смысл аллостерической регуляции гликогенфосфорилазы заключается в том, что избыток продукта подавляет активность фермента. Если глюкозы и энергии в клетке стало более, чем достаточно, то совершенно ни к чему расщеплять гликоген, поэтому глюкозо-6-фосфат и АТФ подавляют гликогенфосфорилазу.
Гликогенсинтаза
Гликогенсинтаза участвует в синтезе гликогена и существует в двух формах:
1.Фосфорилированная форма является неактивной и называется гликогенсинтазой I (b-форма, глюкозо-6-фосфат независимая). Не способна

Регуляция обмена гликогена 55
к аллостерической регуляции. Стимулируется глюкагоном и адреналином.
2.Дефосфорилированная форма активна и называется гликогенсинтазой D (a-форма, глюкозо-6-фосфат зависимая). Стимулируется инсулином. Эта форма способна к аллостерической регуляции: активируется глюкозо-6-фосфатом.
БГормональная регуляция
Глюкагон и адреналин
Процессы синтеза и расщепления гликогена должны быть строго синхронизированы с состоянием организма (голодание и насыщение), поэтому гормональная регуляция обмена гликогена крайне важна.
При голодании альфа-клетки островков Лангерганса поджелудочной железы секретируют гормон глюкагон. В стрессовом состоянии и при физических нагрузках хромаффинные клетки мозгового вещества надпочечников выделяют другой гормон
— адреналин. Глюкагон и адреналин действуют на клетки печени и мышечной ткани.
Внутриклеточный сигнальный каскад, запускаемый этими гормонами, активирует распад гликогена и одновременно выключает его синтез.
Этапы регуляции (см. Рис. 18):
1.При голодании снижается уровень глюкозы в крови, на что сразу же реагируют клетки поджелудочной железы и секретируют глюкагон. При стрессе в ответ на нервные импульсы клетки надпочечников выделяют адреналин.
2.Глюкагон и адреналин связываются со своими рецепторами на по-
верхности клеток и запускают аденилатциклазную сигнальную систему.
а. Наибольшее количество рецепторов к глюкагону находится на поверхности клеток печени, поэтому печень является основным эффекторным органом глюкагона (небольшое количество рецеп-
торов к нему обнаружено в мембранах клеток сердечной мышцы, жировой ткани, селезёнки, тимуса, поджелудочной железы, ЖКТ и коры головного мозга).
б. Адреналин связывается с β-адренергическими рецепторами клеток печени и мышц и с α1-адренергическими рецепторами клеток печени.
3.Запуск сигнальной системы приводит к активации фермента аденилатциклазы, который синтезирует вторичный мессенджер — циклический АМФ (цАМФ).
4.цАМФ активирует фермент протеинкиназу А, фосфорилирующий ферменты, участвующие в метаболизме гликогена:
а. Фосфорилированная гликогенсинтаза переходит в неактивную b-форму. Синтез гликогена прекращается.
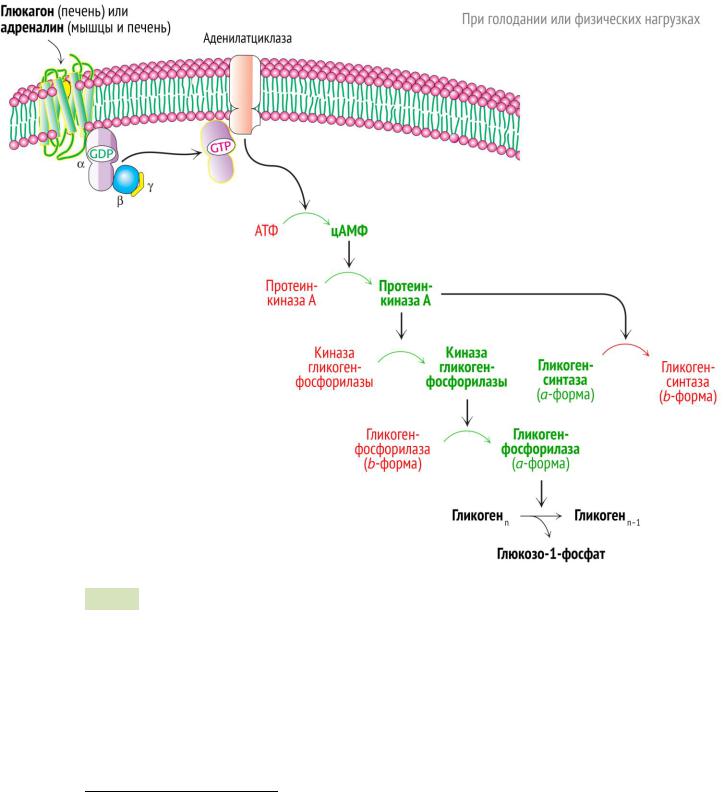
56 |
Глава 3 |
Обмен гликогена |
|
б. |
Фосфорилированная киназа гликогенфосфорилазы1 (активная) |
|
|
фосфорилирует гликогенфосфорилазу и переводит её в актив- |
|
|
ную a-форму. |
5. Гликогенфосфорилаза начинает расщеплять гликоген. Таким образом, запускается распад гликогена в печени и мышцах.
Рис. 18. Регуляция расщепления гликогена под действием гормонов глюкагона и адреналина.
Инсулин
Инсулин — анаболический белковый гормон, активирующий синтез гликогена в печени и мышцах. В течение первого часа после приёма богатой углеводами пищи концентрация глюкозы в крови повышается до 150 мг/дл, а затем снижается до нормальных значений в течение 2-3 часов.
1Киназа гликогенфосфорилазы — регуляторный фермент, фосфорилирующий гликогенфосфорилазу (и активирующий её).

Регуляция обмена гликогена 57
Клетки поджелудочной железы очень чувствительны к повышению сахара в крови, поэтому секретируют инсулин в кровь, как только количество глюкозы в крови резко возрастает.
Инсулин понижает концентрацию глюкозы в крови, вызывая целый ряд событий и стимулируя захват глюкозы клетками и синтез гликогена в печени и мышцах. Инсулин-
зависимые ткани (мышечная и жировая) захватывают глюкозу благодаря транслокации глюкозных транспортеров (ГЛЮТ4-белков) из цитозоля в мембрану клеток. Попав в клетку, глюкоза фосфорилируется до глюкозо-6-фосфата, который аллостерически активирует фермент гликогенсинтазу, переводя его из неактивной T- конформации в активную R-конформацию (даже если он находится в b-форме).
Рис. 19. Регуляция биосинтеза гликогена под действием гормона инсулина.
Этапы регуляции:
1.После приёма пищи, богатой углеводами, уровень сахара в крови резко повышается, и бета-клетки поджелудочной железы начинают секрети-
ровать инсулин.
2.Инсулин связывается со своим рецептором в мембране клетки (печени или мышечной ткани).
3.Активируется тирозинкиназная активность рецептора, и он фосфори-
лирует особый белок — субстрат инсулинового рецептора (IRS-бе- лок).
