
- •2. Значения, которые принимают квантовые числа.
- •3. Обозначение состояния электрона в атоме.
- •4. Форма и знаки орбиталей.
- •5. Энергия электрона в многоэлектронном атоме.
- •1.2. Периодический закон и Периодическая система химических элементов д.И. Менделеева
- •1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
- •1.2.2. Общая характеристика металлов iа – iiiа групп в связи с их положением в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •1.2.3. Характеристика переходных металлов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •1.2.4. Общая характеристика неметаллов ivа – viiа групп в связи с их положением в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •Химические свойства.
- •1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи. Ионная, металлическая и водородная связь.
- •Ионная связь
- •Металлическая связь
- •Водородная связь
- •Водородная связь в молекуле воды
- •Виды химической связи
- •1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов.
- •1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
- •1.4. Химическая реакция.
- •1.4.1. Классификация химических реакций в неорганической и органической химии.
- •Классификация органических реакций
- •1.4.2. Тепловой эффект химической реакции. Термохимические уравнения.
- •1.4.3. Скорость реакции, ее зависимость от различных факторов.
- •1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
- •1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты.
- •Сильные электролиты
- •Слабые электролиты
- •1.4.6. Реакции ионного обмена.
- •1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
- •1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее.
- •Коррозия металлов и способы защиты от нее.
- •Защита металлов от коррозии
- •1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот).
- •Закономерности катодного восстановления
- •Закономерности анодного окисления
- •2. Неорганическая химия
- •2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
- •Бинарные соединения
- •Сложные соединения
- •2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, алюминия; переходных металлов (меди, цинка, хрома, железа) Щелочные металлы
- •Щелочноземельные металлы
- •Взаимодействие алюминия с серой при нагревании.
- •2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния.
- •2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
- •2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
- •Свойства оснований
- •2.6. Характерные химические свойства кислот.
- •2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
- •2.8. Взаимосвязь различных классов неорганических веществ.
1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее.
Любая окислительно-восстановительная реакция состоит из процессов окисления и восстановления.
Окисление – это отдача электронов элементом, т. е. повышение его степени окисления.
Восстановителем называется вещество, в состав которого входит элемент, повышающий степень окисления. К типичным восстановителям относятся простые вещества, имеющие малую электроотрицательность (металлы, водород и др.), катионы и анионы, атомы которых находятся в низких или низших степеней окисления. Низшая степень окисления для неметаллов равна номеру группы минус 8.
Восстановление – принятие электронов элементом или понижение его степени окисления.
Окислителем называется вещество, в состав которого входит элемент, понижающий степень окисления. Типичными окислителями являются простые вещества, атомы которых имеют высокую электроотрицательность (галогены, кислород), катионы и анионы, атомы которых имеют высокую или высшую степень окисления. Высшая степень окисления атома равна номеру группы, в которой он находится.
Многие вещества, в зависимости от партнера и условий проведения реакции могут быть как восстановителями, так и окислителями. В этом случае говорят об окислительно-восстановительной двойственности.
Уравнения окислительно-восстановительных реакций представляет иногда сложную задачу, поэтому для облегчения уравнивания предложено несколько методов. Наиболее часто используются метод полуреакций, электронного баланса и по изменению степени окисления.
Рассмотрим правила определения степеней окисления в соединениях.
1. Степень окисления элемента в простых соединениях (состоят из одного типа химических элементов: Н2, Р4, Fe) равна нулю.
2. Водород в большинстве соединений имеет степень окисления +1, но в соединениях с металлами (гидридах: NaH, CaH2) она равна –1.
3. Кислород имеет степень окисления –2, за исключением пероксидов (Н2О2 и др.), где степень окисления равна –1.
4. Фтор во всех соединениях имеет степень окисления –1.
5. Металлы в соединениях имеют положительную степень окисления. Кроме того:
первая группа, главная подгруппа (щелочные металлы) +1;
вторая группа вся, кроме ртути +2;
алюминий +3.
6. Алгебраическая сумма степеней окисления в нейтральной молекуле равна нулю, а в сложном ионе – заряду иона.
Степень окисления указывается над символом атома со знаком плюс или минус впереди.
![]() .
.
Пример.
Определить степени окисления в соединениях Са(ClO2)2 и NH4NO3.
Решение.
В Са(ClO2)2 известны степени окисления кальция (II группа) +2 и кислорода –2. Обозначив степень окисления хлора за «х», составляем уравнение и находим неизвестную степень окисления.
2 + 2.(х + 2(–2)) = 0; 2 + 2х – 8 = 0; х = +3. Хлор в этом соединении имеет степень окисления +3.
NH4NO3 – нитрат аммония является солью азотной кислоты HNO3, в которой азот имеет степень окисления +5 (1 + х + 3(–2) = 0); х=+5. В NH4NO3 х + 4.(+1) + 5 + 3.(–2) = 0; х = –3.
В этом соединении азот имеет две степени окисления +5 в нитрат ионе и –3 в катионе аммония.
Рассмотрим составление уравнения окислительно-восстановительной реакции по методу электронного баланса на примере реакции
Fe2O3 + Br2 + KOH = K2FeO4 + KBr + H2O
1. Расставим степени окисления у элементов в данном уравнении, согласно правилам, изложенным выше.
![]()
2. Видим, что у железа степень окисления повышается (это полуреакция окисления), а у брома – понижается (полуреакция восстановления). Запишем эти две полуреакции с указанием электронов, отдаваемых восстановителем и принимаемых окислителем.
![]()
![]()
Необходимо, чтобы число отданных и принятых электронов было равно, поэтому первую полуреакцию умножим на 2, а вторую на 3.
![]()
![]()
Расставим
коэффициенты в основном уравнении.
![]() должно быть 2 моль. ВFe2O3
уже есть 2 моль железа, поэтому коэффициент
перед этой молекулой равен единице.
Br2
должно быть 3 моль;
должно быть 2 моль. ВFe2O3
уже есть 2 моль железа, поэтому коэффициент
перед этой молекулой равен единице.
Br2
должно быть 3 моль;
![]() – 2 моль, аKBr
– 6 моль.
– 2 моль, аKBr
– 6 моль.
Fe2O3 + 3Br2 + KOH = 2K2FeO4 + 6KBr + H2O
Метод электронного баланса позволяет расставить коэффициенты только перед окислителем и восстановителем, остальные расставляются методом подбора. Сначала уравнивается калий, потом водород, а кислород в последнюю очередь.
В правой части 10 калия, ставим 10 перед КОН. Стало 10 моль водорода в левой части, ставим 5 перед водой. Количество кислорода при правильной расстановке оказывается уравнено самостоятельно.
Fe2O3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 5H2O
Fe2O3 в этой реакции будет восстановителем, а Br2 – окислителем.
Так как окислитель и восстановитель находятся в разных соединениях, то тип ОВР называется межмолекулярный
Я![]() ркий
опыт протекает при разложении оранжевого
дихромата аммония, в результате которого
образуются газообразный азот, вода и
темно-зеленый оксид хрома(III).
Это реакция «вулкан».
ркий
опыт протекает при разложении оранжевого
дихромата аммония, в результате которого
образуются газообразный азот, вода и
темно-зеленый оксид хрома(III).
Это реакция «вулкан».



1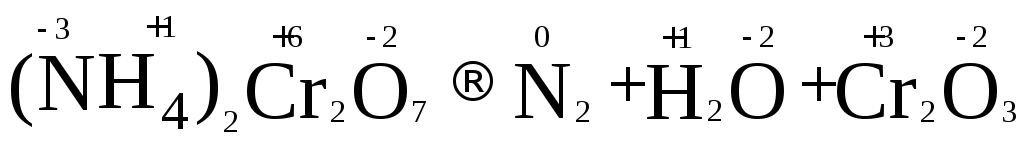 .
Расставим степени окисления у элементов
в данном уравнении, согласно правилам,
изложенным выше.
.
Расставим степени окисления у элементов
в данном уравнении, согласно правилам,
изложенным выше.
2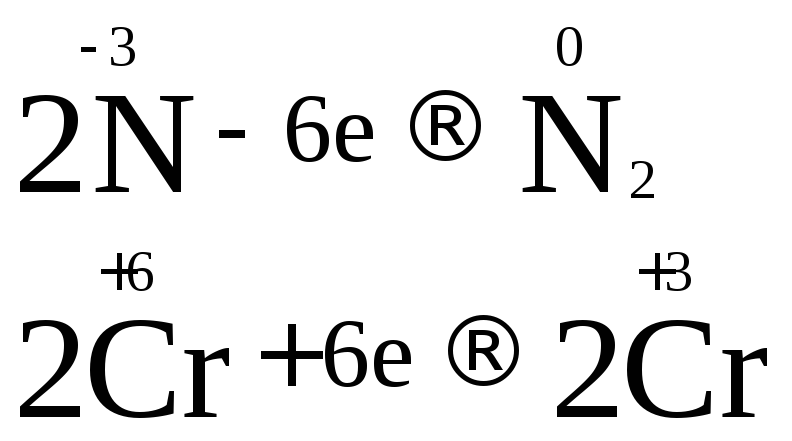 .
Видим, что у азота степень окисления
повышается (это полуреакция окисления),
а у хрома – понижается (полуреакция
восстановления). Запишем эти две
полуреакции с указанием электронов,
отдаваемых восстановителем и принимаемых
окислителем.
.
Видим, что у азота степень окисления
повышается (это полуреакция окисления),
а у хрома – понижается (полуреакция
восстановления). Запишем эти две
полуреакции с указанием электронов,
отдаваемых восстановителем и принимаемых
окислителем.
Р![]() асставим
коэффициенты перед окислителем и
восстановителем в уравнении.
асставим
коэффициенты перед окислителем и
восстановителем в уравнении.
д![]() олжно
быть 2 моль. В дихромате аммония уже
есть 2 моль азота.
олжно
быть 2 моль. В дихромате аммония уже
есть 2 моль азота.
![]()
должно быть 2 моль. В молекуле азота уже есть 2 моль азота.
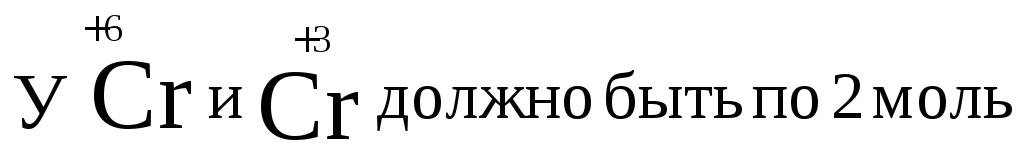
В дихромате аммония и в оксиде хрома(III) уже есть по 2 моль хрома. Значит перед дихроматом аммония, азотом и оксидом хрома(III) должны стоять единицы, которые обычно не ставятся.
У![]() равниваем
водород, для этого перед водой ставим
4. Кислород сам уравнялся.
равниваем
водород, для этого перед водой ставим
4. Кислород сам уравнялся.
В этом уравнении и элемент окислитель, и элемент восстановитель находятся в одном соединении, но это разные элементы. Такой тип ОВР называется внутримолекулярный.
А![]() окислителем и восстановителем будет
являться одно и то же соединение –дихромат
аммония
окислителем и восстановителем будет
являться одно и то же соединение –дихромат
аммония
