
- •2. Значения, которые принимают квантовые числа.
- •3. Обозначение состояния электрона в атоме.
- •4. Форма и знаки орбиталей.
- •5. Энергия электрона в многоэлектронном атоме.
- •1.2. Периодический закон и Периодическая система химических элементов д.И. Менделеева
- •1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
- •1.2.2. Общая характеристика металлов iа – iiiа групп в связи с их положением в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •1.2.3. Характеристика переходных металлов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •1.2.4. Общая характеристика неметаллов ivа – viiа групп в связи с их положением в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •Химические свойства.
- •1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи. Ионная, металлическая и водородная связь.
- •Ионная связь
- •Металлическая связь
- •Водородная связь
- •Водородная связь в молекуле воды
- •Виды химической связи
- •1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов.
- •1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
- •1.4. Химическая реакция.
- •1.4.1. Классификация химических реакций в неорганической и органической химии.
- •Классификация органических реакций
- •1.4.2. Тепловой эффект химической реакции. Термохимические уравнения.
- •1.4.3. Скорость реакции, ее зависимость от различных факторов.
- •1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
- •1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты.
- •Сильные электролиты
- •Слабые электролиты
- •1.4.6. Реакции ионного обмена.
- •1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
- •1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее.
- •Коррозия металлов и способы защиты от нее.
- •Защита металлов от коррозии
- •1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот).
- •Закономерности катодного восстановления
- •Закономерности анодного окисления
- •2. Неорганическая химия
- •2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
- •Бинарные соединения
- •Сложные соединения
- •2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, алюминия; переходных металлов (меди, цинка, хрома, железа) Щелочные металлы
- •Щелочноземельные металлы
- •Взаимодействие алюминия с серой при нагревании.
- •2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния.
- •2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
- •2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
- •Свойства оснований
- •2.6. Характерные химические свойства кислот.
- •2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
- •2.8. Взаимосвязь различных классов неорганических веществ.
1.2.4. Общая характеристика неметаллов ivа – viiа групп в связи с их положением в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
Неметаллы – это химические элементы, для атомов которых характерна способность, принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое 4-х и более электронов и малому радиусу атомов по сравнению с атомами металлов (по периоду слева направо атомные радиусы уменьшаются).
Все элементы-неметаллы (кроме водорода) занимают в периодической системе химических элементов Д. И. Менделеева верхний правый угол, образуя треугольник, вершиной которого является фтор F, а основанием диагонали B-At.
|
Неметаллов всего 22: к 15 представленных в таблице еще относятся водород (Н) и 6 инертных газов (He, Ne, Ar, Kr, Xe и Rn).
Для неметаллов характерны высокие значения электроотрицательности, она изменяется в пределах от 2 до 4. неметаллы – это элементы главных подгрупп, преимущественно p-элементы, исключение составляет водород – s-элемент.
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. В соответствии с численными значениями относительных электроотрицательностей окислительные способности неметаллов увеличиваются в следующем порядке:
![]()
Все неметаллы, кроме фтора, проявляют восстановительные свойства (способность отдавать электроны). Причем эти свойства постепенно возрастают от кислорода к кремнию:
![]()
Химические свойства.
1. Окислительные свойства неметаллов
- взаимодействие с металлами:
2Na + S = Na2S
- взаимодействие с водородом (образуются летучие водородные соединения):
H2 + Cl2 = 2HCl
- любой неметалл выступает в роли окислителя в реакциях с теми неметалами, которые имеют более низкое значение электроотрицательности:
2P + 3Cl2 = 2PCl3
- взаимодействие со сложными веществами:
CH4 + 2O2 = CO2 + 2H2O
2. Восстановительные свойства
- взаимодействие с кислородом (исключение – фтор):
4P + 5O2 = P4O10
- взаимодействие со сложными веществами-окислителями:
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O.
При взаимодействии с неметаллами концентрированная серная кислота восстанавливается до SO2.
3. Реакция диспропорционирования
Она характерна для активных неметаллов. Протекает в щелочной среде:
3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O.
1.3. Химическая связь и строение вещества
Учение о химической связи относится к важнейшим проблемам современной химии. Знание природы взаимодействия атомов в веществе позволяет понять причины многообразия химических соединений, строение и механизм их образования.
Химическая связь возникает при взаимодействии атомов, обусловливающем образование химически устойчивой системы, при этом происходит понижение энергии системы. Возьмем простейший пример – образование молекулы водорода из атомов.
E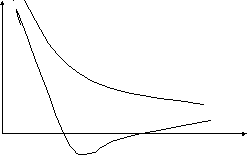
кривая 1
r0 r (расстояние между
атомами)
кривая 2
По мере сближения атомов, их электроны начинают притягиваться не только ядром своего атома, но и ядром другого атома. Атомные орбитали начинают перекрываться, и появляется вероятность одновременного появления обоих электронов в области перекрывания. Здесь вступает в действие принцип Паули: если спины электронов параллельны, то они стремятся разойтись, между ядрами возникает дополнительное отталкивание и химическая связь не образуется (кривая 1).
Если же спины электронов двух атомов антипараллельны, то принцип Паули не препятствует их совместному пребыванию в межъядерной зоне в области притяжения. Кривая 2 описывает понижение энергии и химическая связь образуется. Система из двух атомов водорода имеет минимальную энергию при некотором расстоянии между атомами r0. При дальнейшем сближении атомов энергия системы снова возрастает за счет увеличения сил отталкивания между ядрами.
Таким образом, химическая связь – это вид межатомных взаимодействий, характеризуемый определенной энергией, обуславливающий существование двух и многоатомных молекул.
