
- •2. Значения, которые принимают квантовые числа.
- •3. Обозначение состояния электрона в атоме.
- •4. Форма и знаки орбиталей.
- •5. Энергия электрона в многоэлектронном атоме.
- •1.2. Периодический закон и Периодическая система химических элементов д.И. Менделеева
- •1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
- •1.2.2. Общая характеристика металлов iа – iiiа групп в связи с их положением в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •1.2.3. Характеристика переходных металлов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •1.2.4. Общая характеристика неметаллов ivа – viiа групп в связи с их положением в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •Химические свойства.
- •1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи. Ионная, металлическая и водородная связь.
- •Ионная связь
- •Металлическая связь
- •Водородная связь
- •Водородная связь в молекуле воды
- •Виды химической связи
- •1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов.
- •1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
- •1.4. Химическая реакция.
- •1.4.1. Классификация химических реакций в неорганической и органической химии.
- •Классификация органических реакций
- •1.4.2. Тепловой эффект химической реакции. Термохимические уравнения.
- •1.4.3. Скорость реакции, ее зависимость от различных факторов.
- •1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
- •1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты.
- •Сильные электролиты
- •Слабые электролиты
- •1.4.6. Реакции ионного обмена.
- •1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
- •1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее.
- •Коррозия металлов и способы защиты от нее.
- •Защита металлов от коррозии
- •1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот).
- •Закономерности катодного восстановления
- •Закономерности анодного окисления
- •2. Неорганическая химия
- •2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
- •Бинарные соединения
- •Сложные соединения
- •2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, алюминия; переходных металлов (меди, цинка, хрома, железа) Щелочные металлы
- •Щелочноземельные металлы
- •Взаимодействие алюминия с серой при нагревании.
- •2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния.
- •2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
- •2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
- •Свойства оснований
- •2.6. Характерные химические свойства кислот.
- •2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
- •2.8. Взаимосвязь различных классов неорганических веществ.
1.2.2. Общая характеристика металлов iа – iiiа групп в связи с их положением в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
Отличительной особенностью металлов, находящихся в I-III группах главных подгруппах является дефицит валентных электронов.
В IА группе находятся щелочные металлы, они имеют один s-электрон на внешнем электронном слое, который при химических реакциях легко теряют, проявляя степень окисления +1. Поэтому щелочные металлы являются сильными восстановителями.
Щелочны́е мета́ллы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Согласно положению этих элементов в Периодической системе изменение их свойств представлено на рисунке.
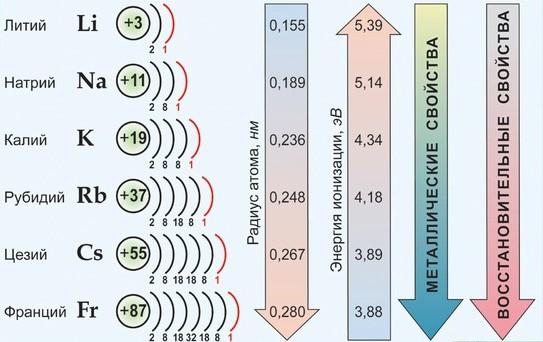
По группе сверху вниз увеличиваются радиусы атомов за счет увеличения число электронных слоев. Уменьшается энергия ионизации (легкость отрыва электрона от атома), что соответствует увеличению восстановительных, а значит и металлических свойств.
Химические свойства щелочных металлов кратко можно представить в таблице.
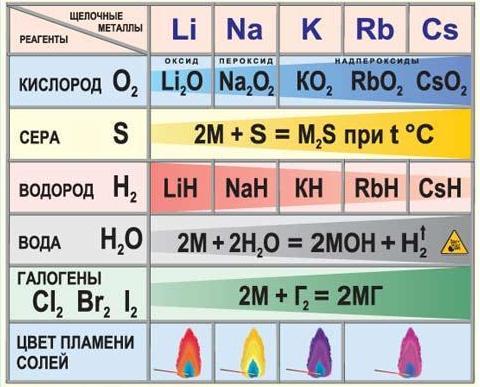
Щелочные металлы активно реагируют с кислородом с образованием оксидов, пероксидов и надпероксидов. С серой при нагревании образуют сульфиды, с водородом – гидриды, с галогенами – галогениды.
Очень активно взаимодействуют с водой, часто с воспламенением выделяющегося водорода.

Атомы элементов IIА группе имеют на внешнем электронном уровне два s‑электрона: ns2.
В реакциях атомы элементов подгруппы легко отдают оба электрона внешнего энергетического уровня и образуют соединения, в которых степень окисления элемента равна +2.
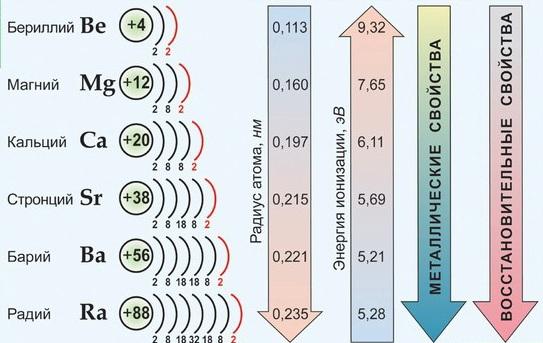
Металлы этой подгруппы менее активны, чем металлы IА группы. Бериллий является амфотерным металлом, магний образует основание – слабый электролит, а кальций, стронций и барий образуют щелочи.
Это активные металлы являются сильными восстановителями. Из металлов этой подгруппы несколько менее активен бериллий, что обусловлено образованием на поверхности этого металла защитной оксидной пленки.
Амфотерность бериллия проявляется в том, что он взаимодействует с водными растворами щелочей с образованием комплексной соли и выделением водорода:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2.
Остальные металлы II группы со щелочами не реагируют.
В IIIА группе находятся бор (В), алюминий (Al), галлий (Ga), индий (In), таллий (Tl).
В этой подгруппе особенной ярко проявляется изменение кислотно-основных свойств по подгруппе сверху вниз от кислотных до основных. Если соединения бора обладают кислотными свойствами, алюминий, галлий и индий – амфотерными, то соединения таллия – основными.
На внешнем энергетическом уровне алюминия имеются свободные р‑орбитали, что позволяет ему переходить в возбужденное состояние. В возбужденном состоянии атом алюминия образует три ковалентные связи или полностью отдает три валентных электрона, проявляя степень окисления +3.

Общим для элементов этих групп является то, что они характеризуются небольшим (1-3) числом электронов на внешнем уровне их атомов и легкостью потери электронов, что отражает низкие значения электроотрицательности.
Алюминий, галлий, бериллий проявляют уже амфотерные (то есть металлические и неметаллические – металлоидные) свойства.
