
- •2. Значения, которые принимают квантовые числа.
- •3. Обозначение состояния электрона в атоме.
- •4. Форма и знаки орбиталей.
- •5. Энергия электрона в многоэлектронном атоме.
- •1.2. Периодический закон и Периодическая система химических элементов д.И. Менделеева
- •1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
- •1.2.2. Общая характеристика металлов iа – iiiа групп в связи с их положением в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •1.2.3. Характеристика переходных металлов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •1.2.4. Общая характеристика неметаллов ivа – viiа групп в связи с их положением в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •Химические свойства.
- •1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи. Ионная, металлическая и водородная связь.
- •Ионная связь
- •Металлическая связь
- •Водородная связь
- •Водородная связь в молекуле воды
- •Виды химической связи
- •1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов.
- •1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
- •1.4. Химическая реакция.
- •1.4.1. Классификация химических реакций в неорганической и органической химии.
- •Классификация органических реакций
- •1.4.2. Тепловой эффект химической реакции. Термохимические уравнения.
- •1.4.3. Скорость реакции, ее зависимость от различных факторов.
- •1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
- •1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты.
- •Сильные электролиты
- •Слабые электролиты
- •1.4.6. Реакции ионного обмена.
- •1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
- •1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее.
- •Коррозия металлов и способы защиты от нее.
- •Защита металлов от коррозии
- •1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот).
- •Закономерности катодного восстановления
- •Закономерности анодного окисления
- •2. Неорганическая химия
- •2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
- •Бинарные соединения
- •Сложные соединения
- •2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, алюминия; переходных металлов (меди, цинка, хрома, железа) Щелочные металлы
- •Щелочноземельные металлы
- •Взаимодействие алюминия с серой при нагревании.
- •2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния.
- •2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
- •2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
- •Свойства оснований
- •2.6. Характерные химические свойства кислот.
- •2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
- •2.8. Взаимосвязь различных классов неорганических веществ.
1.4.2. Тепловой эффект химической реакции. Термохимические уравнения.
Любые химические реакции всегда сопровождаются теми или иными энергетическими эффектами, выделением или поглощением тепла, совершением электрической или механической работы.
Изучением энергетических эффектов химических и физико-химических явлений занимается наука, называемая химической термодинамикой.
Количество выделившейся или поглотившейся теплоты в химической реакции называется тепловым эффектом.

Химические реакции, в которых указан тепловой эффект реакции при Р,Т=const называются термохимическими.


Так как тепловой эффект зависит от агрегатного состояния вещества, его обозначают нижними индексами справа у химических формул
(к – кристаллическое, г – газообразное, ж ‑ жидкое).
Н2(г) + Сl2(г) = 2НСl(г) + 185 кДж
Независимость теплового эффекта химической реакции от пути процесса при Р,Т = const была установлена в 1836 г русским ученым Гессом Германом Ивановичем. Закон Гесса гласит.
Тепловой эффект химической реакции не зависит от пути ее протекания, а зависит лишь от природы и агрегатного состояния исходных веществ и продуктов реакции.
1.4.3. Скорость реакции, ее зависимость от различных факторов.
Если рассмотреть две реакции: горения водорода 1. 2Н2 + О2 = 2Н2О(ж) и реакцию нейтрализации 2. Н+ + ОН– = Н2О(ж), то с точки зрения химической термодинамики вероятность протекания первой реакции почти в 3 раза превышает вероятность протекания второй. Однако, скорость первой реакции очень мала:
при 25 С она прореагирует наполовину за 500 млрд лет;
при 300 С прореагирует наполовину за 300 млн лет;
при 600 С прореагирует наполовину за доли секунды.
В то же время реакция нейтрализации с образованием воды, протекающая в растворах, вероятность протекания которой значительно меньше по сравнению с первой реакцией, идет практически мгновенно.
Представление о скоростях химических реакций и факторах, влияющих на скорость, исключительно важно для управления химическими процессами.
Область химии, изучающая молекулярный механизм химических реакций и скорость их протекания, называется ХИМИЧЕСКОЙ КИНЕТИКОЙ.
В зависимости от типа химической реакции, их скорость может определяться по-разному, поэтому необходима классификация химических реакций.
На данном этапе мы ограничимся изучением только гомогенных реакций.
Гомогенные реакции – протекающие в однородной среде без каких-либо границ раздела между реагирующими веществами (газ, раствор). В этом случае молекулы всех реагирующих веществ находятся в одинаковых условиях.
В результате химической реакции происходит изменение количества исходных веществ и образование новых. Поэтому для гомогенных реакций скорость химической реакции измеряется изменением концентрации реагирующих веществ в единицу времени:
![]() ‑средняя
скорость реакции за промежуток времени
Dτ.
‑средняя
скорость реакции за промежуток времени
Dτ.
Скорость химической реакции – величина переменная по времени, т.к. концентрации веществ непрерывно изменяются, поэтому часто используют истинную (мгновенную) скорость реакции.
![]() при
Dτ
®
0.
при
Dτ
®
0.
Скорость реакции можно измерять, зная изменение концентрации хотя бы одного участника реакции. Например, для реакции:
аА + вВ = сС + dD
ее скорость можно определить по любому участнику реакции с учетом стехиометрических коэффициентов (минус для реагентов, т.к. их концентрация в процессе реакции уменьшается, плюс для продуктов, т.к. их концентрация увеличивается):
V
=
![]() .
.
Зависимость скорости реакции от концентрации реагирующих веществ.
Необходимым условием для осуществления акта химического взаимодействия между молекулами должно быть их столкновение, необходимое для разрушения старых и образования новых связей. Столкновение молекул в некотором реакционном пространстве при заданной температуре происходит тем чаще, тем больше этих молекул. Поэтому скорость реакции зависит от концентрации реагирующих веществ.
С этой точки зрения интересно рассмотреть такую задачу.
Пример. Какая реакция протекает с наибольшей скоростью при комнатной температуре?
Zn и HCl (1% р-р)
Zn и HCl (30% р-р)
Zn и HCl (10% р-р)
ZnCl2 (р-р) и AgNO3 (р-р).
В растворе некоторые вещества (сильные электролиты) подвергаются электролитической диссоциации на ионы. Таким образом, в растворах первую задачу – разрушение старых связей – осуществляет полярный растворитель (в водных растворах – вода). Напишем молекулярные и ионные уравнения этих реакций (для 1-3 реакций они будут одинаковы).
Zn + 2HCl = ZnCl2 + Н2; Zn + 2H+ + 2Cl- = Zn2+ + 2Cl- + Н2
4. ZnCl2 + 2AgNO3 = 2AgCl + Zn(NO3)2;
Zn2+ + 2Cl- + 2Ag+ + 2NO3- = 2AgCl + Zn2+ + 2NO3-.
Видно, что для первых трех реакций, чтобы прошла реакция необходимо превратить цинк в ион. На это надо затратить определенную энергию, поэтому скорость этих реакций будет меньше, чем в реакции №4, где эту работу: образование ионов хлора и серебра сделал полярный растворитель – вода.
Реакции, проходящие в растворах без изменения степеней окисления, называются ионообменными и они протекают практически мгновенно.
Если мы рассматриваем скорости 1-3 реакций, то наибольшая среди них будет реакция №2, так как концентрация соляной кислоты больше.
Основным законом химической кинетики является открытый в 1864-1867 г.г. Гульдбергом и Вааге закон действующих масс для скорости химической реакции (ЗДМ).
Скорость элементарной (простой) реакции пропорциональна произведению концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции.

Для условно простой реакции аА +bВ = продукты математическая запись ЗДМ будет иметь вид (обращаю Ваше внимание, что концентрации веществ, входящие в это уравнение неравновесные). Чем дальше от состояния равновесия, тем скорость больше, а в состоянии равновесия скорость реакции равна нулю. Равновесные концентрации обозначаются в квадратных скобках, поэтому запись этого закона в таком виде V=k.[A]a.[B]b не имеет смысла, так как V=0 в состоянии равновесия.
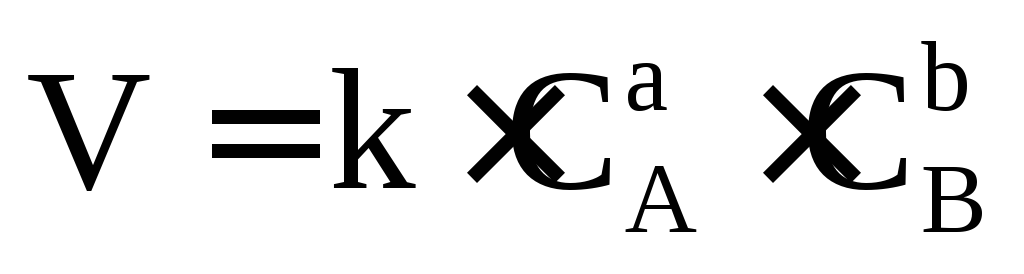 .
.
ЗДМ справедлив только для наиболее простых по своему механизму взаимодействий, протекающих в газах или разбавленных растворах, поэтому все химические реакции делятся на простые (элементарные) и сложные.
Простые реакции идут в одну стадию без образования промежуточных соединений. Они характеризуются молекулярностью реакции. Она определяется числом молекул, одновременным взаимодействием которых осуществляется акт химического взаимодействия. В зависимости от этого простые реакции бывают:
мономолекулярные
– I2
![]() 2I;
2I;![]() ;
реакция первого порядка;
;
реакция первого порядка;
бимолекулярные
– Н2
+ I2
= 2HI;
![]() ;
реакция второго порядка;
;
реакция второго порядка;
тримолекулярные
– 2NO + H2
= N2O
+ H2O;
![]() ;
реакция третьего порядка. Тримолекулярных
реакций известно очень мало.
;
реакция третьего порядка. Тримолекулярных
реакций известно очень мало.
Мы ограничились рассмотрением только гомогенных простых реакций, но большинство реакций сложные и гетерогенные, которые протекают на границе раздела фаз. Математическое выражение для закона действующих масс в этом случае получило название кинетического уравнения.
Интересно рассмотреть задачу, подобные которой встречаются в тестах ЕГЭ.
Пример. От чего зависит скорость химической реакции между медью и азотной кислотой?
Гетерогенными называются реакции, протекающие в среде, разделенной на отдельные части физическими границами раздела, на которых и происходит химическое взаимодействие.
Для гетерогенной реакции ее скорость зависит от величины поверхности раздела между взаимодействующими фазами. Если в реакции участвует твердое тело, то его концентрация не входит в кинетическое уравнение, т.к. она практически не меняется. Роль твердого тела отражается введением его поверхности, на которой протекает данная реакция.
Кинетическое уравнение для нашей реакции: Cu + HNO3 = продукты выглядит так.
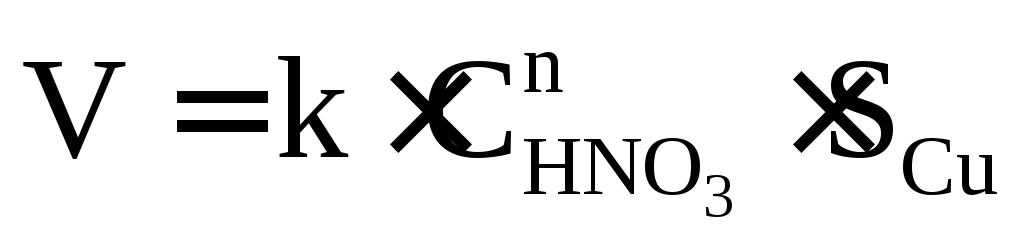
Согласно нашему кинетическому уравнению скорость реакции зависит только от концентрации азотной кислоты, но не зависит от объема колбы, в которой проходит реакция; от объема кислоты и практически не зависит от массы меди, так как поверхность раздела при этом изменяется незначительно. Больший эффект увеличения скорости будет, если применять мелко раздробленную медь, но основным фактором все же остается изменение концентрации кислоты.

Зависимость скорости реакции от температуры
Скорость подавляющего большинства химических реакций при повышении температуры возрастает, причем она очень чувствительна к изменению температуры. Зависимость скорости реакции от температуры старались установить многие ученые. Так в 1884 г. голландский ученый Якоб Вант Гофф, изучив примерно 50 различных реакций, пришел к выводу, что при повышении температуры на каждые 10 градусов скорость гомогенной реакции увеличивается в 2-4 раза. (Правило Вант-Гоффа).
Однако, это чисто эмпирически выведенное правило Вант-Гоффа справедливо не для всех реакций, но оно удобно для примерной оценки изменения скорости химической реакции от температуры, если температурный коэффициент определен.
Химическое взаимодействие между двумя частицами происходит при их столкновении, которое необходимо для разрыва старых и образования новых связей. Однако если бы каждое столкновение частиц приводило к их взаимодействию, то все реакции протекали бы мгновенно. На самом деле не каждое столкновение приводит к взаимодействию, а только такое, при котором энергия сталкивающихся частиц достаточна для возбуждения их связей.
Энергия, необходимая для приведения одного моль реагирующих молекул в реакционноспособное состояние, называется энергией активации. Еа (кДж/моль)
То есть скорость химической реакции носит пороговый характер. Столкновение частиц с Е>Еа приводит к реакции. Энергия активации реакции зависит от природы частиц и пути (механизма) реакции. Энергия активации, наряду с порядком реакции, очень важная кинетическая характеристика химической реакции. В дальнейшем на основе данных молекулярно-кинетической теории с учетом энергии активации Аррениусом было выведено уравнение, связывающее скорость химической реакции с температурой.
Рассмотрение этого материала Вам предстоит уже в ВУЗе.
