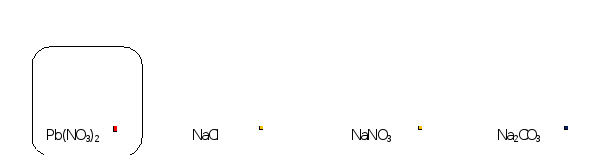- •2. Значения, которые принимают квантовые числа.
- •3. Обозначение состояния электрона в атоме.
- •4. Форма и знаки орбиталей.
- •5. Энергия электрона в многоэлектронном атоме.
- •1.2. Периодический закон и Периодическая система химических элементов д.И. Менделеева
- •1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
- •1.2.2. Общая характеристика металлов iа – iiiа групп в связи с их положением в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •1.2.3. Характеристика переходных металлов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •1.2.4. Общая характеристика неметаллов ivа – viiа групп в связи с их положением в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •Химические свойства.
- •1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи. Ионная, металлическая и водородная связь.
- •Ионная связь
- •Металлическая связь
- •Водородная связь
- •Водородная связь в молекуле воды
- •Виды химической связи
- •1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов.
- •1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
- •1.4. Химическая реакция.
- •1.4.1. Классификация химических реакций в неорганической и органической химии.
- •Классификация органических реакций
- •1.4.2. Тепловой эффект химической реакции. Термохимические уравнения.
- •1.4.3. Скорость реакции, ее зависимость от различных факторов.
- •1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
- •1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты.
- •Сильные электролиты
- •Слабые электролиты
- •1.4.6. Реакции ионного обмена.
- •1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
- •1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее.
- •Коррозия металлов и способы защиты от нее.
- •Защита металлов от коррозии
- •1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот).
- •Закономерности катодного восстановления
- •Закономерности анодного окисления
- •2. Неорганическая химия
- •2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
- •Бинарные соединения
- •Сложные соединения
- •2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, алюминия; переходных металлов (меди, цинка, хрома, железа) Щелочные металлы
- •Щелочноземельные металлы
- •Взаимодействие алюминия с серой при нагревании.
- •2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния.
- •2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
- •2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
- •Свойства оснований
- •2.6. Характерные химические свойства кислот.
- •2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
- •2.8. Взаимосвязь различных классов неорганических веществ.
1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
Гидролиз – это взаимодействие веществ с водой, в результате которого изменяется среда раствора.
Катионы и анионы слабых электролитов способны взаимодействовать с водой с образованием устойчивых малодиссоциируемых соединений или ионов, в результате чего меняется среда раствора. Формулы воды в уравнениях гидролиза обычно записывают в виде Н‑ОН. При реакции с водой катионы слабых оснований отнимают от воды гидроксил ион, и в растворе образуется избыток Н+. Среда раствора становится кислотной. Анионы слабых кислот притягивают из воды Н+, и реакция среды становится щелочной.
В неорганической химии чаще всего приходится иметь дело с гидролизом солей, т.е. с обменным взаимодействием ионов соли с молекулами воды в процессе их растворения. Различают 4 варианта гидролиза.
1. Соль образована сильным основанием и сильной кислотой.
Такая соль гидролизу практически не подвергается. При этом равновесие диссоциации воды в присутствии ионов соли почти не нарушается, поэтому рН=7, среда нейтральная.
Na+
+ H2O
![]() Cl‑
+ H2O
Cl‑
+ H2O
![]()
2. Если соль образована катионом сильного основания и анионом слабой кислоты, то происходит гидролиз по аниону.
![]()
Na2CO3
+ HOH
![]() NaHCO3
+ NaOH
NaHCO3
+ NaOH
Так как в растворе накапливаются ионы ОН‑, то среда – щелочная, рН>7.
3. Если соль образована катионом слабого основания и анионом сильной кислоты, то гидролиз идет по катиону.
Cu2+
+
HOH
![]() CuOH+
+ H+
CuOH+
+ H+
СuCl2
+ HOH
![]() CuOHCl
+ HCl
CuOHCl
+ HCl
Так как в растворе накапливаются ионы Н+, то среда кислая, рН<7.
4. Соль, образованная катионом слабого основания и анионом слабой кислоты, подвергается гидролизу и по катиону и по аниону.
CH3COONH4
+ HOH
![]() NH4OH
+ CH3COOH
NH4OH
+ CH3COOH
CH3COO‑
+
![]() + HOH
+ HOH
![]() NH4OH
+ CH3COOH
NH4OH
+ CH3COOH
Растворы таких солей имеют или слабокислую, или слабощелочную среду, т.е. величина рН близка к 7. Реакция среды зависит от соотношения констант диссоциации кислоты и основания. Гидролиз солей, образованных очень слабыми кислотой и основанием, является практически необратимым. Это, в основном, сульфиды и карбонаты алюминия, хрома, железа.
Al2S3
+ 3HOH
![]() 2Al(OH)3
+ 3H2S
2Al(OH)3
+ 3H2S
При определении среды раствора солей необходимо учитывать, что среда раствора определяется сильным компонентом. Если соль образована кислотой, являющейся сильным электролитом, то среда раствора кислая. Если основание сильный электролит, то – щелочная.
|
кислота |
Сильный электролит |
Сильный электролит |
Слабый электролит |
Слабый электролит |
|
основание |
Сильный электролит |
Слабый электролит |
Сильный электролит |
Слабый электролит |
|
Среда раствора |
Нейтральная рН=7 |
Кислая рН<7 |
щелочная pH>7 |
Примерно нейтральная рН≈7 |
Пример. Щелочную среду имеет раствор
1) Pb(NO3)2; 2) Na2CO3; 3) NaCl; 4) NaNO3
1)Pb(NO3)2 нитрат свинца(II). Соль образована слабым основанием и сильной кислотой, значит среда раствора кислая.
2) Na2CO3 карбонат натрия. Соль образована сильным основанием и слабой кислотой, значит среда раствора щелочная.
3) NaCl; 4) NaNO3 Соли образованы сильным основанием NaOH и сильными кислотами HCl и HNO3 . Среда раствора нейтральная.
Правильный ответ 2) Na2CO3
В растворы солей опустили индикаторную бумажку. В растворах NaCl и NaNO3 она не изменила цвет, значит среда раствора нейтральная. В растворе Pb(NO3)2 окрасилась в красный цвет, среда раствора кислая. В растворе Na2СO3 окрасилась в синий цвет, среда раствора щелочная.