- •2. Значения, которые принимают квантовые числа.
- •3. Обозначение состояния электрона в атоме.
- •4. Форма и знаки орбиталей.
- •5. Энергия электрона в многоэлектронном атоме.
- •1.2. Периодический закон и Периодическая система химических элементов д.И. Менделеева
- •1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
- •1.2.2. Общая характеристика металлов iа – iiiа групп в связи с их положением в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •1.2.3. Характеристика переходных металлов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •1.2.4. Общая характеристика неметаллов ivа – viiа групп в связи с их положением в Периодической системе химических элементов д.И. Менделеева и особенностями строения их атомов
- •Химические свойства.
- •1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи. Ионная, металлическая и водородная связь.
- •Ионная связь
- •Металлическая связь
- •Водородная связь
- •Водородная связь в молекуле воды
- •Виды химической связи
- •1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов.
- •1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
- •1.4. Химическая реакция.
- •1.4.1. Классификация химических реакций в неорганической и органической химии.
- •Классификация органических реакций
- •1.4.2. Тепловой эффект химической реакции. Термохимические уравнения.
- •1.4.3. Скорость реакции, ее зависимость от различных факторов.
- •1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
- •1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты.
- •Сильные электролиты
- •Слабые электролиты
- •1.4.6. Реакции ионного обмена.
- •1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
- •1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее.
- •Коррозия металлов и способы защиты от нее.
- •Защита металлов от коррозии
- •1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот).
- •Закономерности катодного восстановления
- •Закономерности анодного окисления
- •2. Неорганическая химия
- •2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
- •Бинарные соединения
- •Сложные соединения
- •2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, алюминия; переходных металлов (меди, цинка, хрома, железа) Щелочные металлы
- •Щелочноземельные металлы
- •Взаимодействие алюминия с серой при нагревании.
- •2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния.
- •2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
- •2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
- •Свойства оснований
- •2.6. Характерные химические свойства кислот.
- •2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
- •2.8. Взаимосвязь различных классов неорганических веществ.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Современные представления о строении атома
Строение атома.
До конца 19 века полагали, что атом неделимая и неизменяющаяся частица. Это находило подтверждение при проведении химических реакций, в которых вещества реагируют друг с другом в определенных массовых отношениях. Но наука развивалась, накапливались новые данные, которые вынуждали по-другому смотреть на природу и строение атомов. Господствующая сегодня точка зрения об электронном строении атома основывается на ряде экспериментальных и теоретических предпосылок.
Экспериментальные предпосылки теории
Многими научными исследованиями было показано, что атом имеет сложное строение.
а) открытие электронов.
Из электрохимических исследований стало очевидно, что атомы могут нести положительный или отрицательный заряд, поскольку они выделяются на катоде или аноде электролизера. В 1870 году Стони пытался определить величину единичного заряда, связанного с одним одновалентным атомом и названного им электроном. Заряд электрона был определен позже Милликеном (1906-1916 г.г.) qe=1,602.10‑19 кл; а масса покоя m=9,109.10-31 кг.
На основании этих исследований Томсоном была предложена следующая модель строения атома.

б) открытие ядра и его свойства.
В опытах по рассеянию -частиц (Не2+) Э.Резерфордом было показано, что почти вся масса атома сосредоточена в очень малом объеме – положительно заряженном ядре.
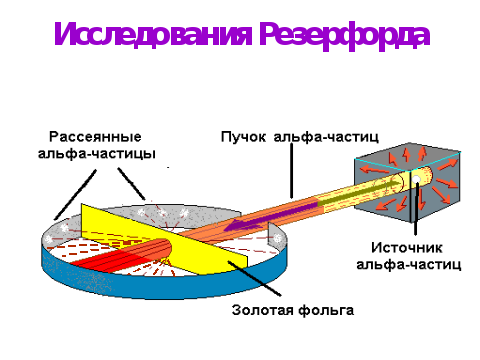
Согласно модели Резерфорда, вокруг ядра на относительно большом расстоянии непрерывно движутся электроны, причем их число таково, что в целом атом электрически нейтрален. Объем ядра примерно в 105 раз меньше атома, а масса одного протона примерно в 2000 раз больше массы электрона.
в) открытие радиоактивности.
Было показано, что атомы не являются неделимыми, в результате радиоактивного распада одни атомы могут превращаться в другие с выделением энергии.
г) Главной предпосылкой электронного строения атомов служат данные, полученные при изучении атомных спектров испускания или поглощения излучения, регистрируемые спектральными методами.
Планетарная модель Резерфорда противоречила факту устойчивости существования атомов. В результате ускоренного движения электрона расходуется энергия его электростатического взаимодействия с ядром и согласно расчетам через 10-8 с электрон должен упасть на ядро. Согласно модели Резерфорда энергия атома должна уменьшаться непрерывно за счет излучения, образующего сплошной спектр. Однако экспериментально установлено, что все атомные спектры имеют дискретный (линейчатый) характер. Спектр является одной из важнейших характеристик атома и отражает его внутреннее строение.
Теоретические предпосылки.
а). Для объяснения особенностей (дискретности) спектров нагретых тел немецким ученым Планком 1900 г. была предложена теория, основанная на предположении, что энергия не излучается атомами непрерывно, а испускается отдельными мельчайшими неделимыми порциями – квантами, величина которых зависит от частоты излучаемого света: Е = h,
где Е – энергия кванта, Дж; ‑ частота, с-1; h = 6,626.10-34 Дж.с – постоянная Планка (мера дискретности), одна из фундаментальных постоянных, она входит во все квантово-механические соотношения.
Согласно уравнению Планка энергия тела может меняться на величину, кратные h. Излучая квант света, атом переходит из одного энергетического состояния в другое.
б) Построенная на этих представлениях модель атома водорода по Бору позволила рассчитать его спектр, результаты хорошо совпали с экспериментальными данными. Однако, она оказалась непригодна для объяснения строения сложных атомов, начиная с гелия. Даже для атома водорода она не смогла объяснить тонкую структуру линейчатого спектра.
В 1924 году Луи де Бройль (Франция) высказал идею о том, что материя обладает как волновыми, так и корпускулярными свойствами. Согласно уравнению де Бройля
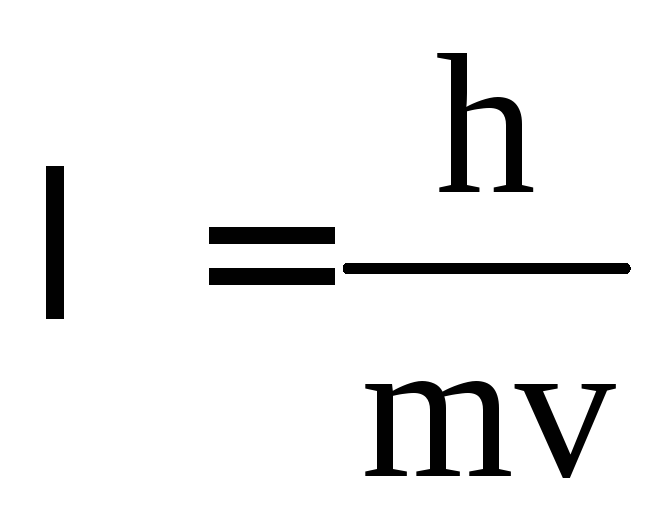 ,
,
т.е. частице массой m, движущейся со скоростью v, соответствует длина волны .
Как правило, встретив две точки зрения, которые диаметрально противоположны, мы полагаем, что если одна из них истинна, то другая – непременно ложна. Нам трудно бывает принять, что возможны и иные уровни понимания: не "или‑или", а "и‑и", когда из двух взаимоисключающих концепций истинными могут оказаться обе, и в равной мере. Современному знанию известны объекты, которые могут быть описаны только как перечнем признаков, исключающих друг друга. Так свет представляет собой одновременно и волну и частицу. То же самое электрон. Он частица и в то же время волна, хотя одно исключает другое. Еще пример: в каждый данный момент электрон находится в определенной точке своей орбиты и в противоположность этому в тот же каждый момент он пребывает во всех точках пути своего движения.
Явление, которое может быть описано только признаками, исключающими друг друга, называется антиномией. Принцип антиномии известен не только в науке. Так по буддийской традиции об одном и том же предмете могут быть высказаны два противоположных суждения, при этом они не должны пониматься как противоречие.
Главное в науке гипотеза, если она правильная. Так и с гипотезой де Бройля уже в 1927 году были обнаружены у электронов как волновые, так и корпускулярные свойства. Было открыто явление дифракции электронов, т.е. при прохождении пучка электронов через дифракционную решетку на фотопленке наблюдается такая же дифракционная картина, как при прохождении излучения с длиной волны , рассчитанной по уравнению де Бройля.
Возникла необходимость изменить представление об электроне как о микроскопической заряженной частице, подчиняющейся тем же законам, каким подчиняются макроскопические тела. Возникла необходимость разработки новой теории, применимой к микрочастицам.
в) В 1925-1926 годах Гейзенберг (Германия) и Шредингер (Австрия) разработали теорию квантовой механики, описывающую движение микрочастиц.
На основании этих предпосылок была построена теория строения атома. Согласно принципу неопределенности невозможно утверждать, что электрон, имеющий определенную скорость, находится в данной точке пространства, здесь можно использовать лишь вероятностное описание.
Современные положения теории строения атома.
Для описания свойств электрона используют волновую функцию (пси). Законы движения микрочастиц в квантовой механике выражаются волновым уравнением Шредингера, которое связывает волновую функцию и энергию атома.
Для изучения химии очень важны результаты решения уравнений Шредингера.
Основные результаты решения уравнений Шредингера
1. Наличие трех квантовых чисел.
n – главное, квантует радиус орбитали, т.е. определяет ее размер.
l – орбитальное, квантует форму орбитали.
ml – магнитное, квантует направление волновой функции в пространстве (угол ).
s – спиновое квантовое число характеризует внутреннее движение электрона в атоме. Квантует собственный внутренний момент количества движения. Оно не вытекает из уравнения Шредингера.
2. Значения, которые принимают квантовые числа.
n
= 1,2........![]() ;
;
l = 0,1,.....n-1} всего n. Орбитальное квантовое число обычно обозначают буквами: 0(s), 1(p), 2(d), 3(f) и т.д. Это сложилось исторически от названий спектральных линий: s – острый (sharp); p – основной (prinzip); d – диффузионный; f – фундаментальный.
ml = 0,±1,±2,....±l } всего 2l+1.
3. Обозначение состояния электрона в атоме.
2р2 – в атоме есть два электрона на орбитале с n = 2 и l = 1, т.к. р-подуровень.
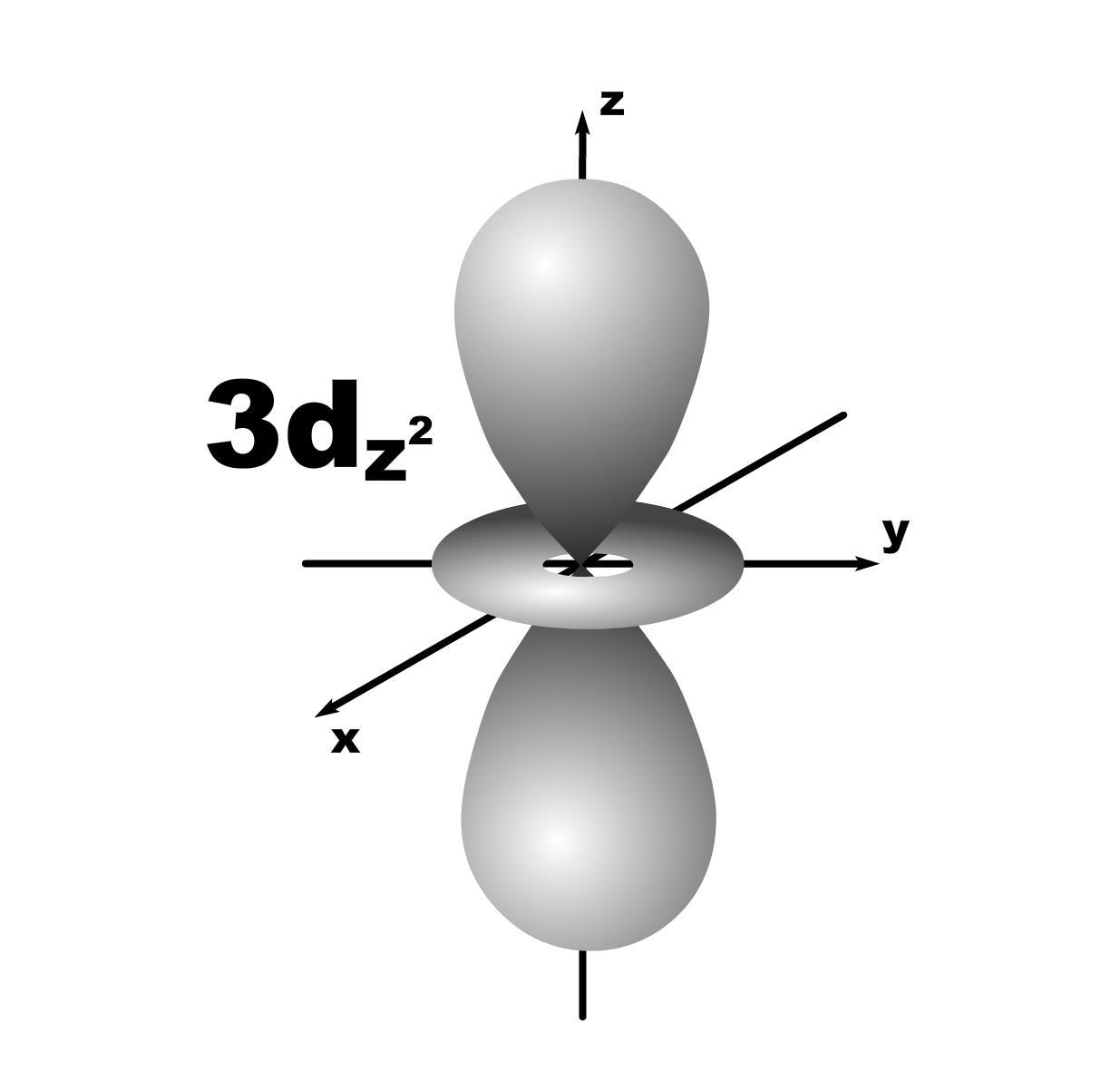
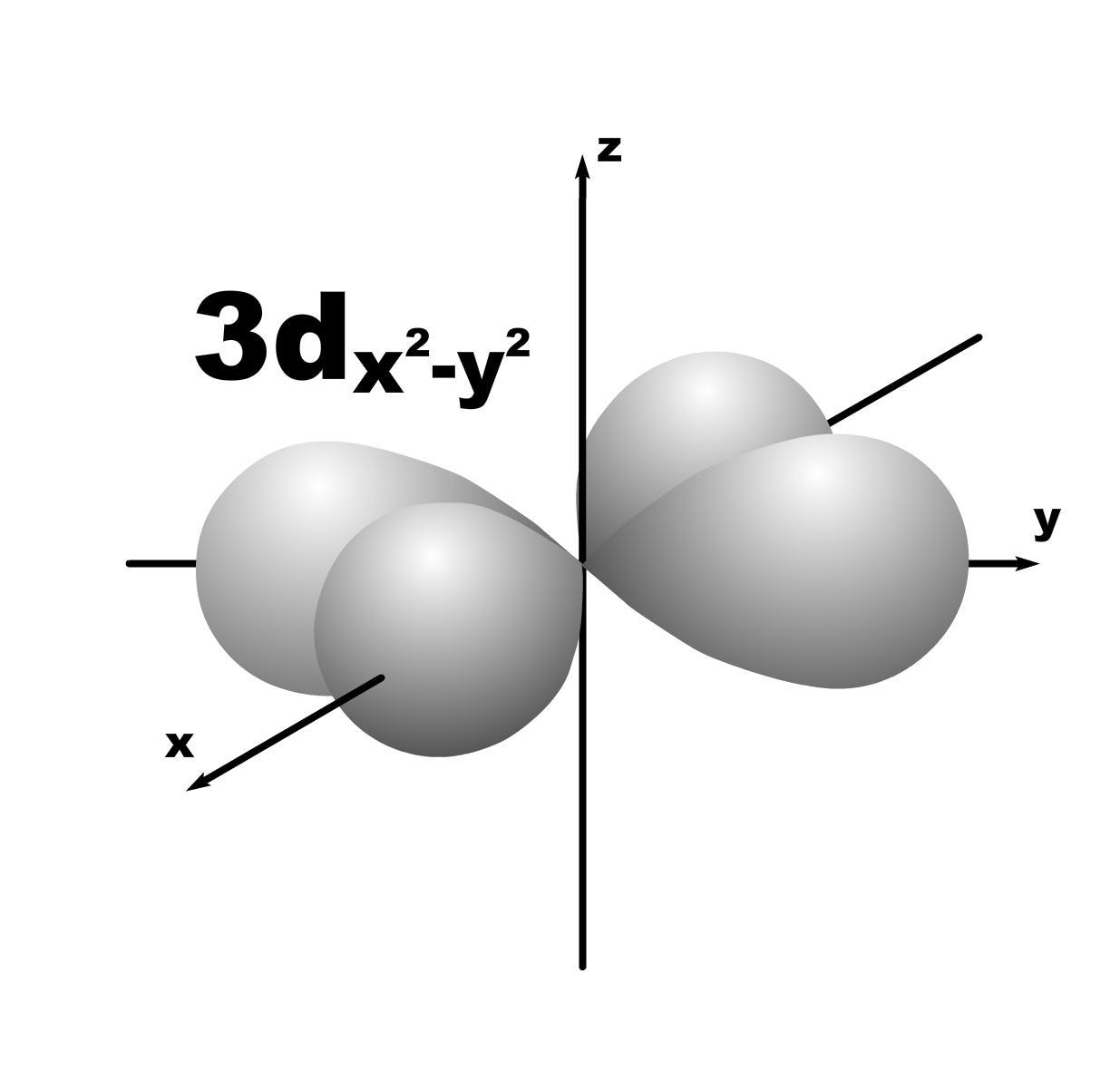
4. Форма и знаки орбиталей.
Атомная орбиталь – отвечающее законам квантовой механики распределение вероятности пребывания электрона в пространтстве, определяемое -функцией.
n – определяет размеры АО;
m – расположение АО в пространстве;
l – конфигурацию, которая от значения n не зависит.
l=0; сфера, m=0; одна орбиталь

l=1; гантель, m=+1,0,-1; три орбитали по осям Х, У, Z.

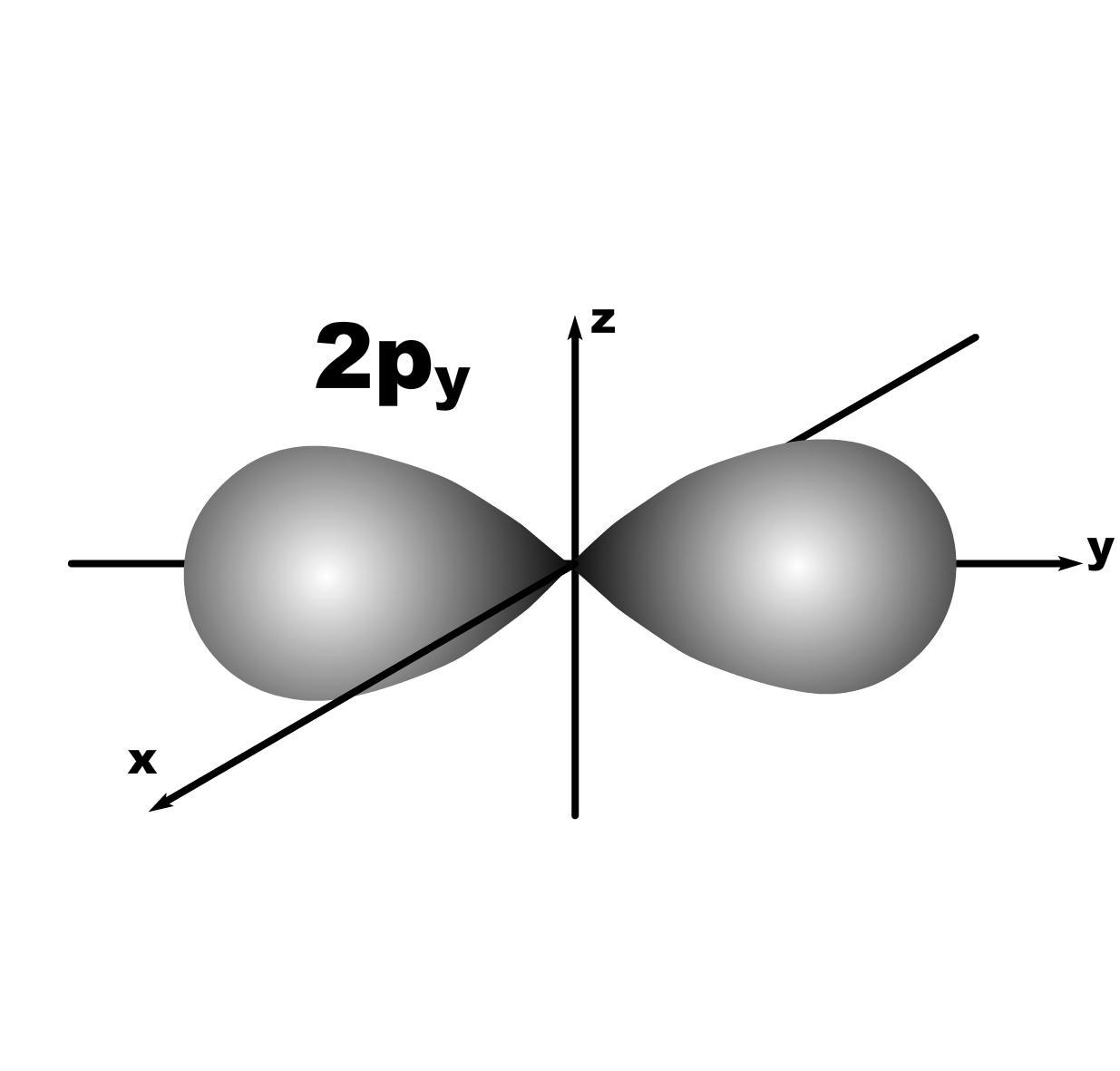

l=2; m=+2,+1,0,-1,-2; пять орбиталей.
|
|
|
|
5. Энергия электрона в многоэлектронном атоме.
Решая уравнение Шредингера, получаем, что:
а) чем больше n+l, тем > энергия электрона в атоме – первое правило Клечковского;
б) если сумма n+l одинакова, то предпочтение отдается главному квантовому числу n. Чем больше n, тем больше энергия электрона в атоме – второе правило Клечковского.
Последовательность расположения атомных орбиталей по мере увеличения энергии электрона в многоэлектронном атоме.
1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
Рисунок, иллюстрирующий правило Клечковского.
Легко запомнить порядок расположения подуровней, если использовать «правило стрелки»

6. Атомной орбиталью (АО) называется совокупность положений электрона в атоме, характеризуемых определенными значениями квантовых чисел n, l, m. Есть и другие определения атомной орбитали. Например, атомной орбиталью называется область пространства, где электрон находится с вероятностью 95%.
А
 томная
орбиталь обычно обозначается . Наs-подуровне
одна атомная орбиталь; на р-подуровне
– три ; на d-подуровне
– 5.
томная
орбиталь обычно обозначается . Наs-подуровне
одна атомная орбиталь; на р-подуровне
– три ; на d-подуровне
– 5.

У каждого атома имеется бесконечный набор атомных орбиталей, которые заполняются электронами по правилам.
а). Принцип наименьшей энергии.
Он отражает стремление любого атома находиться в основном (невозбужденном) состоянии. На практике заполнение по этому принципу определяется 1 и 2 правилами Клечковского.
б). Принцип Паули (в рамках "а").
На каждой орбитали может быть максимум 2 электрона с противоположными спинами.
в). Правило Гунда.
При заполнении p, d, f – подуровней, если на них больше одного электрона, то они заполняются так, чтобы суммарный спин был максимальный.
г). Наиболее устойчивые электронные конфигурации – пустые s0, p0, d0, f0; полностью заполненные s2, p6, d10, f14 и наполовину заполненные p3, d5, f7.
Cr24 1s22s22p63s23p64s23d4 Cr24 1s22s22p63s23p64s13d5
Для атома хрома электроно-графическая формула выглядит так:
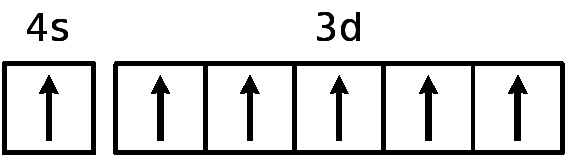
Это явление называется проскок (провал) электрона. Если Вам попадется такой вопрос, то пользуйтесь периодической системой Менделеева, т.к. проскок электрона определяется экспериментально. Например, у хрома (4s13d5) и молибдена (5s14d5) есть проскок электрона, а у их аналога вольфрама нет (6s25d4).
Валентные электроны – электроны, обладающие наибольшей энергией, электроны последних уровней. Они имеют большое значение при образовании химической связи.
|
Семейство элементов |
Электронная формула валентных электронов |
|
s-элементы |
ns n – внешний слой, имеющий максимальное значение n. |
|
p-элементы |
ns и np |
|
d-элементы |
ns и (n-1)d |
|
|
|