
- •3.5. Магнитостатика
- •3.5.1. Природа магнитного поля
- •3.5.2. Свойства магнитного поля. Закон Био-Савара
- •3.5.3. Силы в магнитном поле
- •А. Сила Лоренца
- •Б. Сила Ампера
- •В. Силы, действующие на замкнутый контур с током в однородном магнитном поле. Магнитный момент тока
- •3.5.4. Магнитное поле в веществе. Магнетики
- •3.5.5. Магнитный поток. Теорема Гаусса для магнитного поля. Поле соленоида
- •3.5.6. Электромагнитная индукция
- •3.5.7. Энергия магнитного поля
- •3.6. Уравнения Максвелла для электромагнитного поля.
- •3.6.1. Ток смещения. Возникновение магнитного поля при изменении электрического поля
- •3.6.2. Уравнения Максвелла.
- •IV. Колебания и волны
- •4.1. Механические колебания
- •4.1.1. Гармонические колебания. Осциллятор
- •4.1.2. Сложение колебаний
- •4.2. Электрические колебания
- •4.2.1. Свободные колебания в электрическом контуре
- •4.2.2. Вынужденные колебания. Резонанс
- •4.2.3. Переменный электрический ток
- •4.3. Волновое движение
- •4.3.1. Связанные гармонические осцилляторы. Упругие волны
- •4.3.2. Свойства бегущих волн
- •4.3.3. Энергия, переносимая волной. Стоячие волны
- •4.4. Генерация электромагнитных волн
- •4.4.1. Электромагнитные волны и уравнения Максвелла. Скорость распространения электромагнитных волн
- •4.4.2. Свет как электромагнитная волна. Шкала электромагнитных волн
- •4.4.3. Энергия электромагнитной волны.
- •4.4.4. Импульс электромагнитного поля
- •4.4.6. Заключение
- •Контрольная работа 4.
- •4.5. Равновесное электромагнитное излучение
- •4.5.1. Абсолютно черное тело
- •4.5.2. Классическое рассмотрение излучения черного тела. Ультрафиолетовая катастрофа
- •Глава 5.ОПТИКА.
- •5.1. Геометрическая оптика
- •5.1.1. Принцип Ферма
- •5.2. Волновая оптика
- •5.2.1. Опыт Юнга. Интерференция волн. Принцип Гюйгенса.
- •5.2.2. Метод графического сложения амплитуд. Дифракция от простейших преград.
- •5.2.3. Дифракционная решетка. Дифракция рентгеновских лучей
- •5.3. Физическая оптика
- •5.3.1. Поляризация света
- •5.3.2. Дисперсия света
- •Глава 6. ФОТОНЫ.
- •6.1. Коротковолновая граница рентгеновского спектра
- •6.2. Внешний фотоэффект
- •6.3. Эффект Комптона
- •Контрольная работа №5
- •7.1. Строение атома
- •7.1.1 Планетарная модель
- •7.1.2. Атомные спектры
- •7.1.3 Постулаты Бора
- •7.1.4. Упругие и неупругие столкновения
- •7.1.5. Опыты Франка и Герца
- •7.2. Волновые свойства микрочастиц
- •7.2.1. Гипотеза де Бройля
- •7.2.2. Свойства микрочастиц
- •7.2.3. Соотношение неопределенностей
- •7.2.4. Волна де Бройля.
- •7.3. Уравнение Шредингера.
- •7.3.1. Волновые функции
- •7.3.2. Уравнение Шрёдингера
- •7.3.3 Прохождение частиц через потенциальный барьер
- •7.3.4. Квантование энергии
- •7.3.5. Собственные значения физических величин
- •7.3.6. Квантование момента импульса
- •7.3.7. Гармонический осциллятор
- •7.3.8. Атом водорода
- •Глава 8. АТОМНОЕ ЯДРО
- •8.1. Ядерные силы
- •8.2. Некоторые свойства ядер
- •8.3. Энергия связи ядра
- •8.4. Радиоактивность
- •8.5. Постоянная распада
- •8.6. Период полураспада
- •8.7. Кривая роста дочерних ядер
- •8.8. Радиоактивные семейства ядер
- •8.9. Датировка событий методом радиоактивных распадов
- •Контрольная работа №6

f |
= |
1 |
|
e2 |
|
. |
(7.7) |
2π |
|
4πε0mr3 |
|||||
|
|
|
|
|
|
Подставляя в это выражение r (полученное выше), e и m для электрона, легко найти, что f = 7∙1015 с-1. Это значение также совпадает со значениями f, найденными с помощью других методов.
Несмотря на определенные успехи в объяснении строения атома, достигнутые в рамках планетарной модели и классической теории, перед физиками встал ряд непреодолимых противоречий. Так, согласно законам классической электродинамики:
1)заряженная частица, движущаяся с ускорением, должна непрерывно излучать электромагнитную энергию;
2)частота этого излучения должна быть равна частоте обращения частицы вокруг ядра.
Следовательно, в соответствии с этой моделью полная энергия атома должна уменьшаться (становясь все более отрицательной), тогда как частота обращения (см. 7.7) должна непрерывно возрас-
тать. Простой расчет показывает, что при этих условиях за ничтожное время (~ 10-8 с) электрон упадет на ядро и атом прекратит свое существование. Кроме того, если данная модель верна, то оптический спектр водорода (как и спектры других элементов) должен быть непрерывным, а это означает, что все атомы за очень короткое время будут разрушены.
Оба заключения находятся в полном противоречии с экспериментальными данными: атом является очень устойчивой системой,
аоптические спектры газов имеют вовсе не непрерывное распределение по частоте, а характеризуются набором дискретных частот, т. е. имеют линейчатую структуру. Все эти факты привели к тому, что планетарная модель в классическом изложении вскоре была признана несостоятельной.
7.1.2. Атомные спектры
Электрический разряд в трубке, содержащей одноатомный газ под низким давлением, является источником света, анализ которо-
161
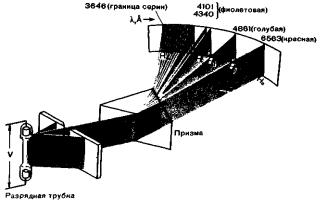
го с помощью призменного спектрографа позволяет обнаружить серию очень отчетливых линий. Эти линии, характеризующие используемый в разрядной трубке газ, называются линейчатым спектром данного газа. Видимая часть спектра водорода, показанная на рисунке, называется серией Бальмера, по имени швейцарского физика И. Бальмера, обнаружившего ее в 1885 г. Если в разрядной трубке используется азот, то получается так называемый полосатый спектр, представляющий собой дискретные группы тесно расположенных линий. Этот полосатый спектр характеризует двухатомные молекулы N2 и имеет другое происхождение по сравнению с линейчатыми спектрами.
Если такой свет пропустить через одноатомный газ, например водород, то возникает спектр поглощения. При этом на спектрограмме получается спектр с темными линиями на светлом фоне. Положение этих линий соответствует длинам волн ярких спектральных линий водорода, т. е. газ поглощает падающее излучение именно с этими длинами волн.
Шведский физик-спектроскопист Ю. Р. Ридберг (1854—1919) получил эмпирическую формулу
1 |
1 |
|
1 |
|
|
|
|||
|
= R |
|
|
− |
|
|
|
, n = 3, 4, 5, ...., |
(7.8) |
λ |
2 |
2 |
n |
2 |
|||||
|
|
|
|
|
|
|
|||
по которой можно рассчитать длины волн спектральных линий в серии Бальмера. Здесь R — так называемая постоянная Ридберга
162
(R = 1,0973731∙10-3 А-1). Для n = 3 λ = 6563 А (красная линия Hα), для n =4 λ = 4861 А (голубая линия Hβ); по мере увеличения и длины волн все больше сближаются, а интенсивности линий ослабевают. Наконец, при n = ∞ мы получаем границу серии, когда λ = 4/R ~ 3646 А.
Помимо серии Бальмера, в спектре водорода в ультрафиолетовой и инфракрасной частях спектра обнаружен ряд других серий (см. табл. ).
Спектральные серии водорода
Серия |
Область спектра |
Формула серии |
|
|
|
Граница се- |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рии |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(n = ∞) |
Серия Лайма- |
Ультрафиолетовая |
1 |
|
1 |
|
1 |
|
|
|
911,27 А |
|||||||||
на |
|
|
|
|
= R |
|
|
|
− |
|
|
|
|
|
|
||||
|
|
λ |
|
2 |
|
n |
2 |
|
|
||||||||||
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
||||||
Серия Бальме- |
Видимая |
n = 2, 3, 4, ... |
|
|
|
|
|
|
|
|
3645,6 А |
||||||||
1 |
|
1 |
|
1 |
|
|
|
|
|||||||||||
ра |
|
|
|
|
= R |
|
|
|
− |
|
|
|
|
|
|
|
|
||
|
|
λ |
2 |
2 |
|
n |
2 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Серия Пашена |
Инфракрасная |
n = 3,4,5,... |
|
|
|
|
|
|
|
|
|
8201 ,4 А |
|||||||
1 |
|
1 |
|
1 |
|
|
|
|
|||||||||||
|
|
|
|
|
= R |
|
|
|
− |
|
|
|
|
|
|
|
|
||
|
|
|
λ |
|
3 |
2 |
|
n |
2 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Серия Брэкета |
Инфракрасная |
n = 4, 5, 6, ... |
|
|
|
|
|
|
|
|
14580 А |
||||||||
1 |
|
1 |
|
1 |
|
|
|
|
|||||||||||
|
|
|
|
|
= R |
|
|
|
− |
|
|
|
|
|
|
|
|
||
|
|
|
λ |
|
4 |
2 |
|
n |
2 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Серия Пфунда |
Инфракрасная |
n = 5, 6, 7, ... |
|
|
|
|
|
|
|
|
22 782 А |
||||||||
1 |
|
1 |
|
1 |
|
|
|
|
|||||||||||
|
|
|
|
|
= R |
|
|
|
− |
|
|
|
|
|
|
|
|
||
|
|
|
λ |
|
5 |
2 |
|
n |
2 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
n = 6, 7, 8, ... |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7.1.3 Постулаты Бора
В1911 г. Нильс Бор в Копенгагене получил степень доктора, и
втом же году он переехал в Англию, где продолжил свои научные исследования под руководством Дж. Дж. Томсона и Эрнеста Ре-
163
зерфорда. После того как Резерфорд предложил свою модель атома, у Бора уже не было сомнений в том, что атом должен состоять из тяжелого ядра, вокруг которого на некотором расстоянии обращаются электроны. В основу развитой им новой модели атома Бор положил ряд постулатов.
Предложенная Бором модель атома, хотя она и заменена сейчас более совершенной квантовой моделью Гейзенберга, Шредингера, Дирака и др., используется и в настоящее время, в частности при введении понятия стационарных состояний, как очень наглядная модель. Модель атома Бора впервые позволила удовлетворительно объяснить строение атома; ее дополняли и уточняли в течение последующих десяти лет Зоммерфельд, Вильсон и др. Несоответствие модели Бора новым открытиям в спектроскопии потребовало разработки новой физической теории и привело к созданию в 1924—1926 гг. квантовомеханической модели атома.
Для исправления недостатков планетарной модели Бор создал свою теорию водородоподобного атома, основанную на следующих постулатах:
1. Электрон обращается вокруг протона в атоме водорода, со-
164
