
- •3.5. Магнитостатика
- •3.5.1. Природа магнитного поля
- •3.5.2. Свойства магнитного поля. Закон Био-Савара
- •3.5.3. Силы в магнитном поле
- •А. Сила Лоренца
- •Б. Сила Ампера
- •В. Силы, действующие на замкнутый контур с током в однородном магнитном поле. Магнитный момент тока
- •3.5.4. Магнитное поле в веществе. Магнетики
- •3.5.5. Магнитный поток. Теорема Гаусса для магнитного поля. Поле соленоида
- •3.5.6. Электромагнитная индукция
- •3.5.7. Энергия магнитного поля
- •3.6. Уравнения Максвелла для электромагнитного поля.
- •3.6.1. Ток смещения. Возникновение магнитного поля при изменении электрического поля
- •3.6.2. Уравнения Максвелла.
- •IV. Колебания и волны
- •4.1. Механические колебания
- •4.1.1. Гармонические колебания. Осциллятор
- •4.1.2. Сложение колебаний
- •4.2. Электрические колебания
- •4.2.1. Свободные колебания в электрическом контуре
- •4.2.2. Вынужденные колебания. Резонанс
- •4.2.3. Переменный электрический ток
- •4.3. Волновое движение
- •4.3.1. Связанные гармонические осцилляторы. Упругие волны
- •4.3.2. Свойства бегущих волн
- •4.3.3. Энергия, переносимая волной. Стоячие волны
- •4.4. Генерация электромагнитных волн
- •4.4.1. Электромагнитные волны и уравнения Максвелла. Скорость распространения электромагнитных волн
- •4.4.2. Свет как электромагнитная волна. Шкала электромагнитных волн
- •4.4.3. Энергия электромагнитной волны.
- •4.4.4. Импульс электромагнитного поля
- •4.4.6. Заключение
- •Контрольная работа 4.
- •4.5. Равновесное электромагнитное излучение
- •4.5.1. Абсолютно черное тело
- •4.5.2. Классическое рассмотрение излучения черного тела. Ультрафиолетовая катастрофа
- •Глава 5.ОПТИКА.
- •5.1. Геометрическая оптика
- •5.1.1. Принцип Ферма
- •5.2. Волновая оптика
- •5.2.1. Опыт Юнга. Интерференция волн. Принцип Гюйгенса.
- •5.2.2. Метод графического сложения амплитуд. Дифракция от простейших преград.
- •5.2.3. Дифракционная решетка. Дифракция рентгеновских лучей
- •5.3. Физическая оптика
- •5.3.1. Поляризация света
- •5.3.2. Дисперсия света
- •Глава 6. ФОТОНЫ.
- •6.1. Коротковолновая граница рентгеновского спектра
- •6.2. Внешний фотоэффект
- •6.3. Эффект Комптона
- •Контрольная работа №5
- •7.1. Строение атома
- •7.1.1 Планетарная модель
- •7.1.2. Атомные спектры
- •7.1.3 Постулаты Бора
- •7.1.4. Упругие и неупругие столкновения
- •7.1.5. Опыты Франка и Герца
- •7.2. Волновые свойства микрочастиц
- •7.2.1. Гипотеза де Бройля
- •7.2.2. Свойства микрочастиц
- •7.2.3. Соотношение неопределенностей
- •7.2.4. Волна де Бройля.
- •7.3. Уравнение Шредингера.
- •7.3.1. Волновые функции
- •7.3.2. Уравнение Шрёдингера
- •7.3.3 Прохождение частиц через потенциальный барьер
- •7.3.4. Квантование энергии
- •7.3.5. Собственные значения физических величин
- •7.3.6. Квантование момента импульса
- •7.3.7. Гармонический осциллятор
- •7.3.8. Атом водорода
- •Глава 8. АТОМНОЕ ЯДРО
- •8.1. Ядерные силы
- •8.2. Некоторые свойства ядер
- •8.3. Энергия связи ядра
- •8.4. Радиоактивность
- •8.5. Постоянная распада
- •8.6. Период полураспада
- •8.7. Кривая роста дочерних ядер
- •8.8. Радиоактивные семейства ядер
- •8.9. Датировка событий методом радиоактивных распадов
- •Контрольная работа №6
Глава 7. ЭЛЕМЕНТЫ АТОМНОЙ ФИЗИКИ
ИКВАНТОВОЙ МЕХАНИКИ
7.1.Строение атома
В1897 г. Дж. Дж. Томсоном был открыт электрон; им же в 1903 г. предложена затем физическая модель атома, известная под названием «пудинг с изюмом». Согласно модели Томсона атом представлял собой положительно заряженную сферу — пудинг, в котором роль изюминок играли отрицательно заряженные электроны, распределенные так, что вся система в целом была нейтральной.
В 1911 г. бывший ассистент Томсона профессор Эрнест Резерфорд с двумя своими студентами Гансом Гейгером и Эрнестом Марсденом провели рад опытов по рассеянию α-частиц очень тонкой золотой фольгой. Эти знаменитые эксперименты показали несостоятельность модели «пудинга с изюмом» и дали основание Резерфорду высказать предположение, что атом состоит из очень ма-
157
ленького ядра (диаметром около 10-14 м), в котором сосредоточен весь положительный заряд атома, а также большая часть его массы; это ядро окружено облаком из отрицательно заряженных электронов. Поскольку размеры атома порядка 10-10 м, то большая часть пространства в атоме является «пустой»; нейтральность атомов обеспечивается равенством отрицательного заряда электронов и положительного заряда ядра.
Чтобы детальнее изучить строение атома, рассмотрим опыт Резерфорда более подробно. Резерфорд предложил бомбардировать тонкую золотую фольгу (Z = 79) быстрыми α-частицами, источником которых служил Ро-214. Исследовав углы рассеяния (отклонения) α-частиц, проходящих через фольгу, можно было определить структуру атомов-мишеней, вызвавших это рассеяние. Сама α- частица представляет собой ядро гелия и состоит из двух протонов и двух нейтронов. В то время не было еще известно о существовании нейтронов, однако Резерфорд и Томас Ройдс уже в 1909 г. определили, что заряд α-частицы равен 2e.
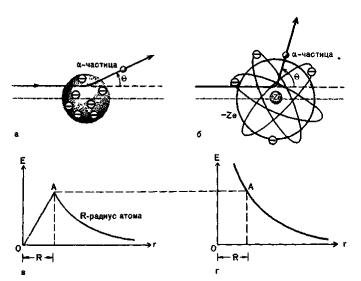
Резерфорд провел теоретические расчеты углов рассеяния Θ в рамках собственной модели и модели Томсона и сравнил полученные результаты с экспериментом. На рисунке схематически изображены модели Резерфорда и Томсона и показано распределение электрического поля для каждого случая. При проникновении в атом, построенный по Томсону (рис. а, в), α-частица будет лишь незначительно отклоняться от первоначального направления, так как электрическое поле внутри такого атома относительно слабое, в особенности если сравнить его с полем в атоме Резерфорда. На одном и том же расстоянии от ядра электрическое поле в атоме Резерфорда значительно сильнее, поскольку весь положительный заряд атома + Ze сосредоточен в малом объеме ядра и, следовательно, угол рассеяния Θ в данном случае будет больше (рис. б, г).
7.1.1 Планетарная модель
Согласно модели Резерфорда атом имеет очень маленькое, но массивное ядро (размером 10-14 м), несущее заряд + Ze. Вокруг этой центральной области расположены Z электронов нейтрального атома. Диаметр атома имеет порядок 10-10 м, что в 10 000 раз
158
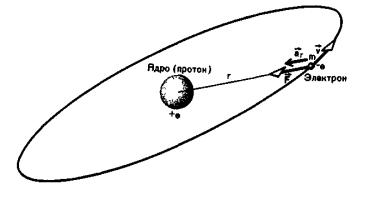
превышает размер ядра. Будем считать эту модель динамической. Если бы модель была статической, то под действием кулоновских сил притяжения все электроны, окружающие ядро, были бы притянуты им. В динамической планетарной модели массивное ядро по существу неподвижно, в то время как электроны движутся вокруг ядра по круговым и эллиптическим орбитам.
Рассмотрим, например, ядерную модель простейшего атома — атома водорода. Для простоты предположим, что электрон (массой m и зарядом —e) движется равномерно по круговой орбите вокруг
протона (с зарядом + e), занимающего центральное положение. В первом приближении движением протона, масса которого почти в 1836 раз больше массы электрона, можно пренебречь.
Сила, удерживающая электрон на орбите, есть сила кулоновского притяжения между протоном и электроном. Эта центральная сила равна:
F = |
1 |
e2 |
, |
(7.1) |
|
4πε0 |
r2 |
||||
|
|
|
где r — радиус круговой орбиты электрона. Из второго закона Ньютона следует, что
1 e2 |
= m |
v2 |
, |
(7.2) |
||
|
|
|
||||
4πε0 r2 |
r |
|||||
|
|
|
||||
159

где ar = v2/r — центростремительное ускорение.
На основании уравнения (7.2) кинетическая энергия электрона в классическом приближении может быть записана как
K = |
1 |
mv |
2 |
= |
1 |
e2 |
. |
(7.3) |
2 |
|
8πε0 |
r |
|||||
|
|
|
|
|
|
Потенциальная энергия системы
U = −eϕ = − |
1 |
e2 |
. |
(7.4) |
|
4πε0 |
r |
||||
|
|
|
Знак «минус» означает, что в данной системе действуют силы притяжения, а не отталкивания, поскольку электрон притягивается к положительно заряженному ядру. Полная энергия системы равна сумме кинетической и потенциальной энергии:
E = K +U = − |
1 |
e2 |
. |
(7.5) |
|
4πε0 |
r |
||||
|
|
|
Знак «минус» показывает, что рассматриваемая система является связанной.
Энергия связи электрона определяется как минимальная энергия, которая требуется для полного удаления электрона из атома, или, другими словами, для ионизации атома. Экспериментальным путем было найдено, что для атома водорода энергия связи равна 13,53 эВ. Подставляя это значение в уравнение (7.5) для E, можно найти радиус r: r = 0,53∙10-10 м = 0,53 А.
Эта величина называется боровским, радиусом (обозначается rb). Ее значение хорошо совпадает со значениями, полученными другими экспериментальными методами.
Линейная скорость v связана с частотой f обращения электрона по орбите соотношением
v =ωr = 2π fr . |
(7.6) |
Подставляя это выражение в уравнение (7.2), получаем:
m(2π fr)2 = 1 e2 ,
4πε0 r
откуда находим частоту обращения электрона вокруг ядра:
160
