
- •Український державний хіміко-технологічний університет
- •2. Математична модель в системі управління
- •2.1. Головні поняття технічної кібернетики
- •2.2.1. Загальні характеристики інформації.
- •2.2.2. Інформаційні процеси
- •2.3.1. Загальні поняття та терміни
- •2.3.2. Графічне відображення оптимізації
- •Var de:text;
- •I,Imin,Imax,dI,р,рc,eps,u,u0 :real;
- •2: Writeln(de); writeln (de, k:3,' I-u-р-dI',I:6:2, u:6:2, р:6:2, dI:10:5);
- •3.3.Масообмінні процеси в системах промивання в гальванотехніці
- •3. Математичне моделювання технологічних процесів в електрохімічних апаратах
- •3.1. Масообмінні процеси в електрохімічних апаратах.
- •3.2 Електрохімічні апарати ідеального змішування
- •3.2.1. Загальна математична модель нестаціонарного масообміну в еха.
- •3.2.2. Математична модель нестаціонарних процесів в непроточних еха ідеального змішування
- •3.2.3. Алгоритми та програма числового моделювання масообміну в еха ідеального змішування.
- •1 Real I,ma,mb,j1,j2
- •2 Data aa,ab,ea,eb,eg,et,t,dt/0.7,0.98,2.18,1.49,0,0,0,0.1/
- •3 Data camin, cbmax, I , ca , cb , V , v0 , j1 , ca1 , cb1
- •23 If(ca.Le.Camin.Or.Cb.Ge.Cbmax) goto 3
- •3.3. Математична модель стаціонарних процесів в проточних еха ідеального змішування
- •1 Real I, j1,j2
- •3.4 Процеси в електрохімічних апаратах ідеального витискування.
- •Var Rom, pR,pO,kap,tok,u,Ut,co,cr,ir,V,h,er,eo,l,dx :real;
- •4. Нестаціонарний масообмін в приелектродному шарі
- •5.5. Моделювання розсіюючої здатності електроліту
- •5. Електричні поля в електрохімічних системах
- •5.1. Двовимірне електричне поле.
- •5.4. Приклади дії електричних полів в системах технічної електрохімії і способи управління полями.
- •6. Моделювання процесів в пористих системах
- •6.1. Об’єкти вивчення
- •6.2. Електричне поле в рідинному пе.
- •6.3. Стаціонарний процес в ріднному пористому електроді. Концентраційні поля.
- •6.4. Стаціонарні транспортні процеси в пористих сепараторах
- •7.Витоки струму в високовольтних електрохімічних пристроях
3.2 Електрохімічні апарати ідеального змішування
В цьому розділі
розглянемо процес в електрохімічному
апараті як в системі з зосередженими
параметрами ,
тобто приймаємо спрощуюче припущення
про те, що локальні швидкості процесів,
потенціали і поляризації однакові по
всій площі кожного з електродів, а
концентрації всіх компонентів електроліту
однакові в усьому об’ємі. Це припущення
справджується тоді, коли розчин добре
перемішується, а сам ЕХА має приблизно
однакові розміри по довжині, висоті
та ширині. В цих умовах можна вважати,
що загальний струм ЕХА підраховується
як добуток густини струму на робочу
площу електрода,
![]() .
.
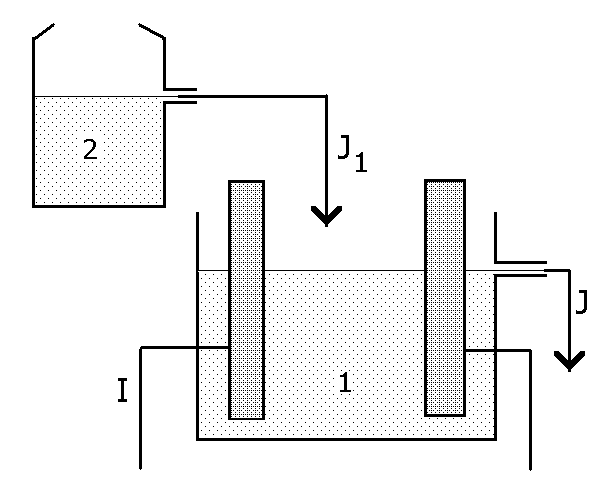
Розглянемо технологічний процес в електрохімічному апараті (ЕХА, рис.1), електролізері або хімічному джерелі струму, з об’ємом електроліту V, л. В ЕХА подається потік розчину реагенту з окремої ємності 2 із швидкістю J1 л/год. Надлишок розчину з ЕХА, в якому є продукт технологічного процесу, витікає із швидкістю JJ1 л/год. В ЕХА здійснюється електрохімічний процес, його швидкість пропорційна заданому значенню струму І, А. Процес нестаціонарний спочатку ЕХА “заповняють” розчином з початковими, довільно обраними концентраціями реагенту і продукту, і розраховують динаміку зміни концентрацій і інших параметрів в процесі роботи.
Якщо реагент безперервно подають в ЕХА потоком J10 , процес в ЕХА через деякий час стає стаціонарним, тобто всі параметри режиму роботи далі не змінюються і залишаються такими протягом необмеженого часу.
П
Рис.1.
Схема технологічного процесу в
проточному електрохімічному апараті
(1). 2- ємність з розчином реагенту, J1
– вхідний потік розчину, J
J1–
вихідний потік продуктів, І – струмове
навантаження.
3.2.1. Загальна математична модель нестаціонарного масообміну в еха.
Математична модель масообміну в ЕХА у найбільш загальному випадку являє собою систему диференційних рівнянь балансу щонайменше двох компонентів: А (реагент) і В (продукт), які приймають участь в процесах, що здійснюються в проточному електрохімічному апараті, наприклад
![]()
![]() (ВТ1),
(3.4)
(ВТ1),
(3.4)
![]() (ВТ2=1-ВТ1)
(3.5)
(ВТ2=1-ВТ1)
(3.5)
В даному прикладі головна реакція має вихід за струмом ВТ1, а в одній побічній реакції (3.5) витрачається реагент А і утворюються твердий (Т) та газофазний (G) продукти. Речовини А та В містяться у вхідному потокові J1, л/год з концентраціями СА1 та СВ1, в самому апараті і в вихідному потокові J- з концентраціями СА та СВ.
Система рівнянь математичної моделі має для вказаних двох реакцій таку загальну форму:
![]() ;
(3.6)
;
(3.6)
![]() ;
(3.7)
;
(3.7)
![]() ;
(3.8)
;
(3.8)
![]() ;
(3.9)
;
(3.9)
![]() ;
(3.10)
;
(3.10)
![]() ;
;
![]() ;
(3.11)
;
(3.11)
![]() -
задана
функція (або константа); (3.12)
-
задана
функція (або константа); (3.12)
![]() -
задана
функція (або константа) (3.13)
-
задана
функція (або константа) (3.13)
Початкові умови на момент початку процесу =0: задані значення концентрацій компонентів А та В в електрохімічному апараті СА = СА0, СВ = СВ0.
Перші два рівняння –це диференційні рівняння балансу реагента, який приймає участь в двох реакціях, і продукта, третє - рівняння сумарного масового балансу потоків. Кількість диференційних рівнянь дорівнює кількості компонентів, які приймають участь у процесах і знаходяться в розчині.
Всі інші вирази – співвідношення між параметрами системи вираз для густини розчину γ г/л як адитивної функції концентрацій компонентів, потоки газофазного gG та твердого gT компонента (г/год , однозначно визначаються за законом Фарадея ), потік води в газову фазу випаровуванням gР .
Речовин в конкретних технічних системах, а також реакцій (хімічних або електрохімічних) може бути більше, ніж в цьому прикладі. Якщо в технологічній системі є додаткові хімічні компоненти, для кожного з них потрібно ввести аналогічні першим двом диференційні рівняння балансу, а також відповідні додаткові доданки в рівнянні (3.11).
Залежності швидкості випаровування та виходів за струмом від умов роботи електрохімічного апарату є характерними для конкретних електрохімічних обєктів, і відповідні формули або графіки можна знайти в описах технологій.
Аналітичні рішення для нестаціонарного процесу в проточному ЕХА ідеального змішування. Диференційне рівняння балансу одного з компонентів реакцій можна записати у спрощеному вигляді, якщо прийняти додаткові умови J1=J2=J, BT=const:
![]() ,
(3.14)
,
(3.14)
де знак «+» третього доданку відповідає накопиченню продукту, а знак «-» – витрачанню реагента.
Це спрощення дозволяє розглядати незалежно окреме диференційне рівняння, і одержати його аналітичне рішення:
![]() .
(3.15)
.
(3.15)
Аналіз рівняння (3.15) дає можливість зробити попередні висновки про характер рішень математичної моделі і виявити деякі технологічні особливості роботи проточних електрохімічних пристроїв. Знання цих положень корисно для аналізу більш точних числових рішень складнішої математичної моделі.
1.
Вираз (3.15) описує динамічну характеристику
процесу, тобто часову залежність
концентрації даного компоненту С=f(),
починаючи з моменту включення =0.
Якщо підставити значення =0
в вираз (3.15), одержимо
![]() ,
тобто початкову умову.
,
тобто початкову умову.
2.
Підставляючи в вираз (3.15) значення
![]() ,
одержимо співвідношення
,
одержимо співвідношення
![]() ,
(3.16)
,
(3.16)
в яке час не входить. Це означає, що вираз вірний для стаціонарного режиму роботи. З виразу (3.16) видно, що значення стаціонарної концентрації С= можна підрахувати як функцію значень вхідних регульованих параметрів С1, І, J.
Вираз (3.16) можна одержати, якщо вирішити рівняння (3.14) з нульовою лівою частиною, як алгебраїчне:
![]() .
(3.17)
.
(3.17)
Таким чином, перший множник другого доданку в рішенні (3.15) є виразом для стаціонарної концентрації, тому рівняння (3.15) можна записати простіше:
![]() .
(3.18)
.
(3.18)
Графіки рішень згідно з (3.15, 3.18) наведені на рис. 3.1.
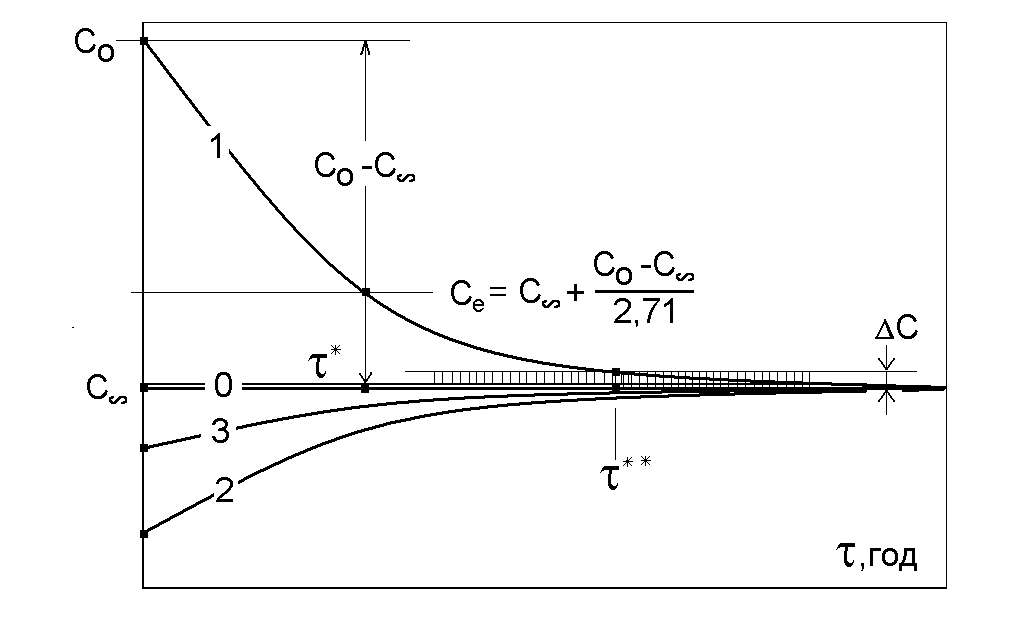
Рис. 3.1. Динамічні характеристики процесу в проточному ЕХА при різних значеннях початкової концентрації компонента.
3.
З виразу (3.16) видно, що для витрачуваного
реагента (перед другим доданком має
бути знак «–») стаціонарна концентрація
менша за С1
і
може виявитись навіть негативною, тобто
розташована в забороненій області
станів. Такий результат моделювання,
не існуючий реально, означає, що були
неправильно «відрегульовані» (задані
в моделі як константи) значення вхідних
параметрів процесу - або занадто малі
значення С1
чи швидкості протікання розчину J,
або підвищене значення струму І.
Інакше кажучи, або мала швидкість
подання реагента в апарат![]() ,
або надмірна швидкість витрачання
реагента в апараті
,
або надмірна швидкість витрачання
реагента в апараті
![]() .
Таким
чином, з (3.16), підставляючи С=
=
0, можна сформулювати умову, яка обмежує
область дозволених станів даної
технологічної системи:
.
Таким
чином, з (3.16), підставляючи С=
=
0, можна сформулювати умову, яка обмежує
область дозволених станів даної
технологічної системи:
![]() .
(3.19)
.
(3.19)
4. Вихід технологічної системи на стаціонарний режим здійснюється асимптотично, тому не існує точного моменту встановлення стаціонарного стану. Момент досягнення стаціонарного стану фіксують умовно.
Найчастіше приймають як масштабну величину перехідного часу вираз, який входить в показник експонеційної функції у рівнянні (3.15) :
![]() ,
(3.20)
,
(3.20)
і
який означає тривалість заповнення
об’єму V
потоком
розчину
J
.
Якщо в (3.17) підставити значення
![]() ,
можна визначити концентрацію в момент
часу*
:
,
можна визначити концентрацію в момент
часу*
:
![]() .
(3.21)
.
(3.21)
Перехідний час * згідно цього виразу можна визначити з динамічної характеристики (рис.3.1, 3.2) як точку Се на графіку, де концентрація змінюється на (1-1/е) = (1- 1/2.71) = 0.63 від максимального інтервалу (С0-С).

Рис. 3.2. Динамічні характеристики процесу в проточному ЕХА при різних значеннях відношення V/J.
Інший спосіб інтерпретації перехідного часу ** показаний на рис.1 : це тривалість перехідної ділянки динамічної характеристики до моменту, коли концентрація, наближаючись до стаціонарного рівня, досягає смуги С, ширина якої розглядається як допустима помилка визначення концентрації. Цей спосіб не дуже зручний, бо значення ** залежить від ширини смуги С.
