
- •Министерство образования и науки Российской федерации
- •Часть I. Механика
- •Тема 1. Кинематика поступательного и вращательного движения. Кинематика поступательного движения
- •Кинематика вращательного движения
- •Тема 2. Динамика поступательного движения. Законы Ньютона
- •Тема 3. Работа. Кинетическая, потенциальная и полная энергия
- •Тема 4. Момент инерции твердого тела. Теорема Штейнера
- •Тема 5. Кинетическая энергия и работа вращательного движения Уравнение динамики вращательного движения твердого тела
- •Тема 6. Момент импульса. Закон сохранения момента импульса
- •Тема 7. Механические колебания. Пружинный маятник
- •Тема 8. Гармонические колебания физического маятника
- •Тема 9. Механические волны
- •Тема 10. Механика жидкости. Уравнение Бернулли
- •Часть II. Молекулярная физика и термодинамика
- •Тема 1. Уравнение состояния идеального газа.
- •Тема 2. Термодинамические процессы. Изопроцессы.
- •Тема 3. Основное уравнение молекулярно-кинетической теории идеального газа.
- •Тема 4. Распределение молекул идеального газа по скоростям.
- •Тема 5. Барометрическая формула. Распределение Больцмана.
- •Тема 6. Явления переноса (диффузия, теплопроводность, вязкость).
- •Тема 7. Первое начало термодинамики. Внутренняя энергия. Работа. Применение первого начала термодинамики к изопроцессам.
- •Тема 8. Теплоемкость газа при изопроцессах. Уравнение Майера.
- •Тема 9. Адиабатический процесс.
- •Тема 10. Обратимый и необратимый процессы. Круговой процесс. Тепловая машина и цикл Карно.
- •Часть III. Электричество и магнетизм
- •Тема 2. Работа сил электростатического поля. Потенциал
- •Циркуляцией вектора напряженности электростатического поляпо произвольному замкнутому контуру l называется интеграл
- •Связь между напряженностью и потенциалом электростатического поля
- •Тема 4. Действие магнитного поля на проводник с током (закон Ампера) и на движущийся заряд (сила Лоренца)
- •Тема. 5. Магнитный поток. Теорема Гаусса для магнитного поля
- •Теорема Гаусса для магнитного поля
- •Тема. 6. Явление электромагнитной индукции. Закон Фарадея
- •Тема 7. Циркуляция вектора магнитной индукции
- •Тема 8. Уравнения Максвелла для стационарных электрического и магнитного полей
- •I. ; II. ;
- •III. ; IV. .
- •Тема 8.Уравнения Максвелла для электромагнитного поля
- •I. ; II. ;
- •Тема 9. Электромагнитные колебания в колебательном контуре
- •Тема 10. Электромагнитные волны
- •Часть IV.Волновая и квантовая оптика
- •Тема 1. Волновая теория света. Интерференция света
- •Условия интерференционного максимума и минимума
- •Тема 2. Дифракция света. Дифракция Френеля
- •Тема 3. Дифракция Фраунгофера
- •Тема 4. Дифракция рентгеновских лучей на кристаллах
- •Глава 5. Дисперсия и поляризация света
- •Тема 6. Корпускулярная оптика
- •Тема7. Тепловое излучение
- •Тема 8. Квантовая физика атома. Постулаты Бора
- •По теории Бора полная энергия электрона на n-ой орбите атома водорода:
Тема 8. Квантовая физика атома. Постулаты Бора
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, находясь в которых атом не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, на которых находятся электроны.
В стационарном состоянии атома для электрона, находящегося на круговой орбите, значения момента импульса могут принимать только определенный набор дискретных квантованных значений, удовлетворяющих условию:
 (
n
= 1, 2, 3, …), где
(
n
= 1, 2, 3, …), где
me – масса электрона, υn – скорость электрона на n-ой орбите радиуса rn,
n – номер орбиты,
ħ
= (h
– постоянная Планка).
(h
– постоянная Планка).
Радиус n-ой орбиты для атома водорода:
 ,
,
где e – заряд электрона, εo – электрическая постоянная,
а– радиус первой орбиты (n = 1), называемыйпервым боровским радиусом, который равен:
 .
.
Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (или поглощается) один фотон с энергией hν, равной разности энергий соответствующих стационарных состояний En и Еm :
 .
.
При переходе атома из состояния большей энергии в состояние меньшей энергии, то есть при переходе электрона на менее удаленную от ядра орбиту, происходит излучение фотона, а при поглощении фотона происходит переход атома из состояния меньшей энергии в состояние большей энергии, что соответствует переходу электрона на более удаленную орбиту.
Дискретность набора значений энергии стационарных состояний En и Еm предопределяет дискретность набора возможных частот ν квантовых переходов между этими состояниями, что обусловливает линейчатость спектра атома.
По теории Бора полная энергия электрона на n-ой орбите атома водорода:
 (
n
= 1, 2 , 3, …),
(
n
= 1, 2 , 3, …),
Из приведенной формулы следует, что энергетические состояния атома водорода образуют последовательность энергетических уровней, изменяющихся в зависимости от значения числа n , которое называетсяглавным квантовым числом.
Энергетическое состояние с n = 1 являетсяосновным состоянием, а состояния сn >1 являютсявозбужденными.
Спектр испускания атома водорода.
Согласно второму постулатуБора, при переходе атома водорода из состоянияn в состояниет с меньшей энергией испускается фотон с энергиейhν :
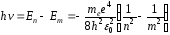 ,
,
откуда частота ν квантового перехода в спектре испускания атома водорода:
 ,
,
где
R
– постоянная Ридберга ( )
,
)
,
Числа m (m = 1, 2, 3 …) и n (n = m + 1, m + 2, m + 3, …) определяют номера электронных орбит в атоме, между которыми происходит квантовый переход.
Приведенная формула описывает серии линий в спектре испускания атома водорода (рис. 13), где m определяет серию (m = 1, 2, 3…), а n определяет отдельные линии соответствующей серии (n = m + 1, m + 2, m + 3, …).

Рис. 13.
В ультрафиолетовой области спектра атома водорода наблюдается
серия
Лаймана (m
= 1):
 (n
= 2, 3, 4, …).
(n
= 2, 3, 4, …).
В видимой области спектра атома водорода наблюдается
серия
Бальмера (m
= 2):
 (n
= 3, 4, 5, …).
(n
= 3, 4, 5, …).
В инфракрасной области спектра атома водорода наблюдаются
серия
Пашена (m
= 3):
 (n
= 4, 5, 6, …);
(n
= 4, 5, 6, …);
серия
Брэкета (m
= 4):
 (n
= 5, 6, 7, …);
(n
= 5, 6, 7, …);
серия
Пфунда (m
= 5):
 (n
= 6, 7, 8, …);
(n
= 6, 7, 8, …);
серия
Хэмфри (m
= 6):
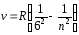 (n
= 7, 8, 9, …).
(n
= 7, 8, 9, …).
Квантовые числа и правила отбора.Состояние электрона в атоме водорода определяется набором квантовых чисел:n, l , ml.
n – главное квантовое число, определяющее энергетические уровни электрона в атоме и принимающее целочисленные значения начиная от единицы:
n= 1, 2 , 3, … .
l –орбитальное квантовое число, определяющее момент импульса электрона в атоме и для заданногоглавного квантового числа nпринимающее следующие значения: l = 0, 1, …, (n– 1), то есть всегоnзначений.
тl –магнитное квантовое число,определяющее проекцию момента импульса электрона на заданное направление и при заданноморбитальном квантовом числе lпринимающее следующие значения:
тl= 0, ±1, ±2, …, ±l,
то есть всего (2l+1) значений, причем вектор момента импульса электрона в атоме может иметь в пространстве (2l + 1) ориентацию.
Если орбитальное квантовыми число l = 0, то состояние электрона называютs-состоянием, дляl = 1 –p-состоянием, дляl = 2 –d-состоянием, дляl = 3 –f-состоянием и т. д. Значение главного квантового числа указывается перед условным обозначением орбитального квантового числа. Например, электроны в состояниях (n = 2,l = 0) и (n = 2,l = 1) обозначаются соответственно символами2s и2р.
Число возможных переходов электронов, связанных с испусканием или поглощением света, ограничено, так называемыми, правилами отбора.
Теоретически доказано и экспериментально подтверждено, что могут осуществляться только такие переходы, для которых:
1) изменение орбитального квантового числа Dlудовлетворяет условию:
∆l = ±1 ;
2) изменение магнитного квантового числа Dml удовлетворяет условию:
∆ml = 0, ±1 .
Учитывая
число возможных состояний, соответствующих
данному значению главного квантового
числа nиправила отбора, спектральные линии
атома водорода (рис. 14) в серии Лаймана
соответствуют переходам: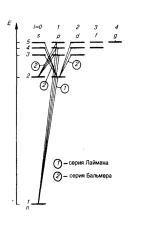
np →1s (n= 2, 3, …) ;
в серии Бальмера – переходам:
np →2s, ns →2p, nd →2p (n = 3, 4,…) и т. д.
Так как поглощающий атом находится обычно в основном состоянии, то спектр поглощения атома водорода состит из линий, соответствующих переходам: 1s→np
Рис. 14
(n = 2, 3, ...), что отражается в эксперименте.


S
α

