
- •Министерство образования и науки Российской федерации
- •Часть I. Механика
- •Тема 1. Кинематика поступательного и вращательного движения. Кинематика поступательного движения
- •Кинематика вращательного движения
- •Тема 2. Динамика поступательного движения. Законы Ньютона
- •Тема 3. Работа. Кинетическая, потенциальная и полная энергия
- •Тема 4. Момент инерции твердого тела. Теорема Штейнера
- •Тема 5. Кинетическая энергия и работа вращательного движения Уравнение динамики вращательного движения твердого тела
- •Тема 6. Момент импульса. Закон сохранения момента импульса
- •Тема 7. Механические колебания. Пружинный маятник
- •Тема 8. Гармонические колебания физического маятника
- •Тема 9. Механические волны
- •Тема 10. Механика жидкости. Уравнение Бернулли
- •Часть II. Молекулярная физика и термодинамика
- •Тема 1. Уравнение состояния идеального газа.
- •Тема 2. Термодинамические процессы. Изопроцессы.
- •Тема 3. Основное уравнение молекулярно-кинетической теории идеального газа.
- •Тема 4. Распределение молекул идеального газа по скоростям.
- •Тема 5. Барометрическая формула. Распределение Больцмана.
- •Тема 6. Явления переноса (диффузия, теплопроводность, вязкость).
- •Тема 7. Первое начало термодинамики. Внутренняя энергия. Работа. Применение первого начала термодинамики к изопроцессам.
- •Тема 8. Теплоемкость газа при изопроцессах. Уравнение Майера.
- •Тема 9. Адиабатический процесс.
- •Тема 10. Обратимый и необратимый процессы. Круговой процесс. Тепловая машина и цикл Карно.
- •Часть III. Электричество и магнетизм
- •Тема 2. Работа сил электростатического поля. Потенциал
- •Циркуляцией вектора напряженности электростатического поляпо произвольному замкнутому контуру l называется интеграл
- •Связь между напряженностью и потенциалом электростатического поля
- •Тема 4. Действие магнитного поля на проводник с током (закон Ампера) и на движущийся заряд (сила Лоренца)
- •Тема. 5. Магнитный поток. Теорема Гаусса для магнитного поля
- •Теорема Гаусса для магнитного поля
- •Тема. 6. Явление электромагнитной индукции. Закон Фарадея
- •Тема 7. Циркуляция вектора магнитной индукции
- •Тема 8. Уравнения Максвелла для стационарных электрического и магнитного полей
- •I. ; II. ;
- •III. ; IV. .
- •Тема 8.Уравнения Максвелла для электромагнитного поля
- •I. ; II. ;
- •Тема 9. Электромагнитные колебания в колебательном контуре
- •Тема 10. Электромагнитные волны
- •Часть IV.Волновая и квантовая оптика
- •Тема 1. Волновая теория света. Интерференция света
- •Условия интерференционного максимума и минимума
- •Тема 2. Дифракция света. Дифракция Френеля
- •Тема 3. Дифракция Фраунгофера
- •Тема 4. Дифракция рентгеновских лучей на кристаллах
- •Глава 5. Дисперсия и поляризация света
- •Тема 6. Корпускулярная оптика
- •Тема7. Тепловое излучение
- •Тема 8. Квантовая физика атома. Постулаты Бора
- •По теории Бора полная энергия электрона на n-ой орбите атома водорода:
Тема 7. Первое начало термодинамики. Внутренняя энергия. Работа. Применение первого начала термодинамики к изопроцессам.
Внутренней энергией газа U называется сумма кинетической энергии хаотического (теплового) движения всех молекул газа и энергии взаимодействия молекул газа между собой. Для идеального газа внутренняя энергия – это только кинетическая энергия всех молекул газа.
Внутренняя энергия идеального газа определяется числом степеней свободы его молекул и температурой газа.
Числом степеней свободы i механической системы называется количество независимых величин, с помощью которых может быть однозначно задано положение системы в пространстве.
Согласно
закону
о равнораспределении
энергии по степеням свободы молекул
для термодинамической системы, находящейся
в равновесии, на каждую поступательную
и вращательную степени свободы приходится
в среднем кинетическая энергия, равная
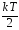 ,
а на каждую колебательную степень
свободы – в среднем энергия, равнаяkT.
Колебательная
степень «обладает» вдвое большей
энергией потому, что на нее приходится
не только кинетическая энергия (как в
случае поступательного и вращательного
движений), но и потенциальная, причем
средние значения кинетической и
потенциальной энергий одинаковы.
,
а на каждую колебательную степень
свободы – в среднем энергия, равнаяkT.
Колебательная
степень «обладает» вдвое большей
энергией потому, что на нее приходится
не только кинетическая энергия (как в
случае поступательного и вращательного
движений), но и потенциальная, причем
средние значения кинетической и
потенциальной энергий одинаковы.
Таким образом, средняя кинетическая энергия молекулы:
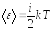 ,
,
где i – сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:
 .
.
Внутренняя энергия N молекул идеального газа:

Так
как число молекул газа
 (NА
– число Авогадро) , где
(NА
– число Авогадро) , где
 ,
,
то,
с учетом соотношения
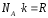 ,
получим:
,
получим:
 .
.
Изменение внутренней энергии ∆U при изменении температуры от Т1 до Т2:
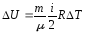 ,
где
,
где
 =Т2
–
Т1
.
=Т2
–
Т1
.
Внутреннюю
энергию газа можно увеличить за счет
сообщения ему некоторого количества
теплоты
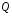 ,
которое может быть израсходовано также
и на совершение механической работыА
по расширению газа. При этом соблюдается
закон сохранения и превращения энергии.
Применительно к термодинамическим
процессам это и есть первое
начало термодинамики:
количество
теплоты
,
которое может быть израсходовано также
и на совершение механической работыА
по расширению газа. При этом соблюдается
закон сохранения и превращения энергии.
Применительно к термодинамическим
процессам это и есть первое
начало термодинамики:
количество
теплоты
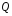 ,
сообщаемое термодинамической системе,
расходуется на изменение ее внутренней
энергии ∆U
и на совершение механической работы
А против внешних сил:
,
сообщаемое термодинамической системе,
расходуется на изменение ее внутренней
энергии ∆U
и на совершение механической работы
А против внешних сил:
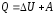 .
.
Работа А, совершаемая газом при изменении его объема от V1 до V2:
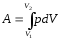 ,
,
где
 –
элементарная работа при изменении
объема газа на
–
элементарная работа при изменении
объема газа на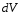 .
.
Работа газа при изопроцессах.
1. Изобарный процесс (p = const). При изобарном процессе работа газа при увеличении объема от V1 до V2 равна:
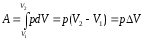 ,
,
а первое начало термодинамики для изобарного процесса примет вид:
 .
.
2. Изохорный процесс (V = const). При изохорном процессе газ не совершает работы против внешних сил, то есть А=0, а первое начало термодинамики для изохорного процесса примет вид:
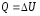 .
.
т. е. все количество теплоты, сообщаемое газу, расходуется на увеличение его внутренней энергии.
3. Изотермический процесс (T=const). Работа при изотермическом расширении газа:
 .
.
Так как при постоянной температуре внутренняя энергия идеального газа не изменяется, то первое начало термодинамики для изотермического процесса:
 ,
,
то есть все количество теплоты Q, сообщаемое газу, расходуется на совершение им работы A против внешних сил.
