
- •12. Азот и фосфор
- •5.1. Общая характеристика. Нахождение в природе. Получение
- •5.2. Простые вещества
- •5.2.1. Структура и физические свойства
- •5.2.2. Химические свойства
- •5.3. Аммиак и соли аммония
- •5.3.1. Получение аммиака
- •5.3.2. Физические и химические свойства
- •5.3.3. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •5.4.3. Нитраты и нитриты
- •5.5. Кислородосодержащие соединения фосфора
- •5.6. Минеральные удобрения
- •14. Общая характеристика. Степени окисления
- •7.3.2. Природные соединения алюминия
- •7.3.3. Физические свойства
- •7.3.4. Химические свойства
- •7.3.5. Оксиды и соли p-элементов
- •7.3.6. Производство алюминия
- •16. Углерод и кремний
- •6.1. Общая характеристика. Нахождение в природе. Получение
- •6.2. Структура и физические свойства простых веществ
- •17. Константа равновесия
- •2.3.2. Сдвиг равновесия
- •19. Строение атома и химическая связь
- •3.1. Электронное строение атома
- •3.1.1. Современная модель атома
- •20. Общая характеристика
- •Получение и свойства s-металлов
- •7.2.4. Сложные вещества s-элементов. Производство соды
- •2.1.1. Термохимия
- •2.1.2. Энтропия. Энергия гиббса
- •2.1.3. Формула гиббса. Разрешенность процессов с позиции термодинамики
- •22. Метан
- •6.5. Кислородосодержащие соединения углерода
- •6.5.1. Общая характеристика и свойства
- •6.6.3. Цемент
- •25. Ионное произведение воды. Водородный показатель. Индикаторы
- •4.2.4. Буферные растворы
- •3.2. Получение простых веществ.
- •3.3. Физические свойства г2
- •27. Кислородосодержащие соединения хлора
- •Взаимодействие г2 с водородом. Получение hCl и ее свойства. Галогеноводородные кислоты
- •32. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •2.1. Распространенность водорода
- •2.2. Сходство водорода с другими элементами
- •2.2.1. Сходство с галогенами
- •2.2.2. Сходство со щелочными металлами
- •40. Особенности водорода
- •2.2.2. Кинетическое уравнение
- •2.2.3. Механизм химических реакций
- •2.2.4. Влияние температуры на скорость
- •2.2.5. Катализ
7.3.6. Производство алюминия
Если олово и свинец – это металлы, известные человечеству еще в древности (наряду с Ag, Au, Cu, Hg и Fe), то металлический алюминий получен только в 19 веке. Впервые его выделил в 1825 году Эрнстед. Пропустив хлор через раскаленную смесь глинозема и угля, он синтезировал хлорид алюминия, из которого восстановил Al амальгамой калия; а затем полученную амальгаму алюминия разложил, отогнав ртуть нагреванием.
Этот способ был очень дорогим и вредным, да и продукт оказывался сильно загрязненным. Достаточно чистый и блестящий металл выделил Девиль в 1855 году, восстановив его натрием из смеси NaCl и хлорида алюминия, полученного сложным способом из глинозема. И этот метод был столь дорог, что Al ценился дороже золота.
Перелом в истории производства алюминия наступил в 1886 году, когда стали применять электролиз расплава смеси Al2O3 с гексафтороалюминатом натрия (Na3 AlF6). Последний назвали криолитом (от греческого слова «криос» – холод), т.к. при добавлении его к глинозему (в соотношении 12:1) температура плавления снижается с 2050°С до 960°С. Это резко удешевило синтез алюминия и открыло ему дорогу в технику. И сейчас он один из наиболее используемых металлов.
Аналогично Al получают и на современных предприятиях, но для повышения электропроводности расплава смеси глинозема и криолита добавляют еще CaF2 и другие соли. Суть электролиза условно можно представить следующими процессами:
– диссоциация в расплаве:
 ,
,
– окисление кислорода аниона на угольном аноде:
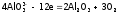 ,
,
– восстановление алюминия на катоде (дно электролитической ванны):
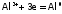 .
.
При этом затраты на 1 т Al: 2 т Al2O3, 40-60 кг криолита, 20-30 кг фторида кальция, 600 кг угля (чтобы наращивать анод, который выгорает под действием выделяющегося на нем кислорода) и 18 тыс. кВт-часов электроэнергии, т.е. производство достаточно дорогое. А выпускают ежегодно более десяти млн. тонн алюминия. Поэтому очень актуально использование вторсырья, что снижает затраты в 10 раз.
Особо подчеркнем, что получение Al из вторсырья экологически безопасно, в то время, как выделение его из бокситов связано с выбросами в атмосферу многих очень вредных веществ: HF, токсичного органического вещества бенз(а)пирена и др., которые необходимо улавливать. Например, HF можно связать, пропуская отходящие газы через щелочной раствор.
Отметим, что описанным выше способом получается т.н. технический алюминий, который содержит 0,3% примесей. А в сверхчистом Al, синтезированном с помощью дополнительных операций, примеси составляют лишь 10-4%. И такой алюминий не тускнеет со временем (ибо оксидная пленка, образующаяся на нем, очень тонкая, но в то же время плотная и равномерная). Он идет, в частности, на изготовление зубных коронок, т.к. пластичен, а после добавления микроколичеств стронция становиться сверхтвердым материалом, при обработке которого «летят» токарные
резцы.
16. Углерод и кремний
6.1. Общая характеристика. Нахождение в природе. Получение
К p-элементам IV группы относятся углерод, кремний, германий, олово и свинец. Причем C – довольно распространенный элемент на Земле (0,14%), а кремний (16,7%) занимает второе место после кислорода. Аналогов кремния несопоставимо меньше (примерно по 10-4%).
Атомы элементов данной группы в невозбужденном состоянии имеют электронную конфигурацию валентного слоя s2p2,а при возбуждении s1p3. Как следствие, они образуют соединения в степенях окисления +2, +4 и –4. Но только углерод достаточно устойчив в ст.ок. –4, чтобы находиться в ней в природе – в виде углеводородов (поскольку лишь он имеет сравнительно высокое значение ЭО, равное 2,5, а у остальных – 1,9 и ниже).
Кроме того, С встречается на Земле и в виде простых веществ (в частности, в составе углей11). Природные же соединения аналогов углерода –сложные вещества, например: SnO2 (минерал касситерит) и PbS (т.н. свинцовый блеск).
Подчеркнем, что, хотя C и назван (в 1797 году) углеродом (углерождающим), но основные его природные запасы – не угли, а карбонаты (известняк, мрамор, мел и т.п.).
Кремний представлен на земле кислородными соединениями, которые составляют 58,3% земной коры. Это кремнеземы SiO2 (песок, кварц12, топаз, аметист),силикаты (асбест MgSiO3, слюда, полевой шпат и другие. А также граниты, сиениты13, т.е. спрессованные природой смеси песка, слюды и полевого шпата. В качестве микроэлемента кремний находится также в человеческом организме и играет важную биологическую роль, причем чем старше человек, тем меньше в немSi.
Технический (т.е. сравнительно грязный) кремний в промышленности получают из природного оксида карботермически , как и его аналоги, но PbS предварительно обжигом переводят в PbO.
