
- •12. Азот и фосфор
- •5.1. Общая характеристика. Нахождение в природе. Получение
- •5.2. Простые вещества
- •5.2.1. Структура и физические свойства
- •5.2.2. Химические свойства
- •5.3. Аммиак и соли аммония
- •5.3.1. Получение аммиака
- •5.3.2. Физические и химические свойства
- •5.3.3. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •5.4.3. Нитраты и нитриты
- •5.5. Кислородосодержащие соединения фосфора
- •5.6. Минеральные удобрения
- •14. Общая характеристика. Степени окисления
- •7.3.2. Природные соединения алюминия
- •7.3.3. Физические свойства
- •7.3.4. Химические свойства
- •7.3.5. Оксиды и соли p-элементов
- •7.3.6. Производство алюминия
- •16. Углерод и кремний
- •6.1. Общая характеристика. Нахождение в природе. Получение
- •6.2. Структура и физические свойства простых веществ
- •17. Константа равновесия
- •2.3.2. Сдвиг равновесия
- •19. Строение атома и химическая связь
- •3.1. Электронное строение атома
- •3.1.1. Современная модель атома
- •20. Общая характеристика
- •Получение и свойства s-металлов
- •7.2.4. Сложные вещества s-элементов. Производство соды
- •2.1.1. Термохимия
- •2.1.2. Энтропия. Энергия гиббса
- •2.1.3. Формула гиббса. Разрешенность процессов с позиции термодинамики
- •22. Метан
- •6.5. Кислородосодержащие соединения углерода
- •6.5.1. Общая характеристика и свойства
- •6.6.3. Цемент
- •25. Ионное произведение воды. Водородный показатель. Индикаторы
- •4.2.4. Буферные растворы
- •3.2. Получение простых веществ.
- •3.3. Физические свойства г2
- •27. Кислородосодержащие соединения хлора
- •Взаимодействие г2 с водородом. Получение hCl и ее свойства. Галогеноводородные кислоты
- •32. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •2.1. Распространенность водорода
- •2.2. Сходство водорода с другими элементами
- •2.2.1. Сходство с галогенами
- •2.2.2. Сходство со щелочными металлами
- •40. Особенности водорода
- •2.2.2. Кинетическое уравнение
- •2.2.3. Механизм химических реакций
- •2.2.4. Влияние температуры на скорость
- •2.2.5. Катализ
5.4.3. Нитраты и нитриты
Соли азотной и азотистой кислот стабильнее самих кислот, но при достаточном нагревании тоже разлагаются. В частности, нитраты ЩМ отщепляют атомарный кислород, переходя в достаточно устойчивые нитриты. А нитриты металлов от Mn до Cu (в ряду напряжений) термически не стабильны, поэтому N-содержащие соли этих М разлагаются с образованием их оксидов:
 ,
,
 .
.
Нитраты благородных М (тем более, их нитриты) дают при нагревании металл вместо оксида:
 ,
,
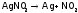 .
.
Термодинамически наименее устойчив из N-содержащих солей – нитрит аммония:
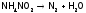 .
.
Нестабилен и его нитрат, причем в зависимости от Т получаются разные продукты:
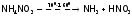 ,
,
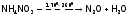 ,
,
 .
.
Последняя реакция идет со взрывом. В ней (как промежуточный продукт) образуется атомарный кислород, поэтому NH4NO3 используют как составляющее аммонала (бездымного пороха) вместе с порошками угля и алюминия.
Качественная
реакция
на нитрат-ионы
– появление бурого газа при действии
на анализируемое вещество концентрированной
серной кислотой в присутствии меди.
(При этом вначале получается диоксид
серы, который восстанавливает
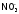 доNO2.)
доNO2.)
Качественной реакцией на нитрит-ионы является обесцвечивание малинового раствора перманганата калия в сернокислой среде. (Основные продукты взаимодействия: нитрат-анионы и катионы марганца (II).)
5.5. Кислородосодержащие соединения фосфора
В отличие от N (оксиды которого термодинамически нестабильны к распаду на азот и кислород) фосфор образует с О очень прочные связи, т.е. его оксиды устойчивы к отщеплению кислорода.
Оксиды фосфора P2O3 и P2O5 синтезируют, сжигая Р при недостатке и избытке О2 соответственно. С водой они дают кислоты: фосфористую H3PO3 и фосфорную H3PO4. (Причем H3PO4 получается через образование вначале метафосфорной кислоты HPO3.)
Все рассмотренные выше фосфорсодержащие вещества – твердые, в отличие от большинства аналогичных соединений азота.
Вследствие невысокой ЭО фосфора его гидроксиды слабы и как кислоты (даже HPO3), и как окислители (с металлами реагируют лишь за счет H+, ибо Р очень устойчив в положительных ст.ок., особенно в высшей.
Поскольку фосфорная кислота трехосновна, то могут быть получены и дигидрофосфаты (в частности, NaH2PO4), и гидрофосфаты (Na2HPO4), и средние соли (Na3PO4).
Из средних
растворимы в воде только фосфаты ЩМ, а
остальные – лишь в кислотах
(как результат образования слабодиссоциирующих
гидро- и дигидрофосфат-ионов). Поэтому
именно в нейтральной
(а не в кислой!) среде нужно проводить
качественную
реакцию на
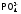 .
(Например, с растворомAgNO3,
дающим с фосфат-анионами желтый
осадок
Ag3PO4.)
.
(Например, с растворомAgNO3,
дающим с фосфат-анионами желтый
осадок
Ag3PO4.)
5.6. Минеральные удобрения
Природные фосфаты кальция при обработке кислотами, в частности, серной, в зависимости от количества кислоты дают или среднерастворимый продукт CaHPO4 (преципитат), или Ca(H2PO4)2 (суперфосфат), или H3PO4. (Последние два вещества хорошо растворяются в воде.)
Если на фосфат кальция действовать фосфорной кислотой, то получается т.н. двойной суперфосфат, т.е. без балласта CaSO4 (который образуется при использовании H2SO4).
Все указанные фосфаты кальция (и кислые, и даже средний Сa3(PO4)2) являются фосфорными удобрениями. Но важно химически грамотно выбирать, какой из них вносить в данную почву.
Например, средний фосфат лучше применять для кислых земель5, т.к. в них он, взаимодействуя с органическими кислотами, переходит в растворимую форму (и т.о. приобретает способность всасываться корнями растений). При этом одновременно снижается кислотность почвы, благодаря чему улучшается ее качество. (В частности, повышается проницаемость для воды и воздуха, что способствует лучшей жизнедеятельности полезных микробов.)
Очевидно, кислые фосфаты кальция можно вносить лишь в достаточно щелочные земли (рН = 7 – 8).
Кроме
фосфорных удобрений используют тоже
очень нужные растениям азотные
(нитраты, соли аммония) и калийные
(соли калия), а также двойные
удобрения (содержащие и Р, и N):
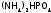 и
и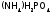 ,.
Причем в кислые почвы вносят не
гидролизующиеся (по катиону) солиKCl,
KNO3,
NaNO3
или аммиачную воду. А некислые земли
можно удобрять, например, нитратом
аммония NH4NO3,
который гидролизуясь понижает рН
природной воды.
,.
Причем в кислые почвы вносят не
гидролизующиеся (по катиону) солиKCl,
KNO3,
NaNO3
или аммиачную воду. А некислые земли
можно удобрять, например, нитратом
аммония NH4NO3,
который гидролизуясь понижает рН
природной воды.
Без вмешательства человека почвенные запасы азота, фосфора, калия (а также кальция и др.) восстанавливаются естественным путем при разложении останков растений и животных. В частности, азот- и фосфорсодержащие органические вещества перерабатываются микробами в неорганические соединения, которые усваиваются растениями. (Так осуществляется естественный оборот Р в природе.)
Но если урожай уносится с полей, то необходимо вносить в землю не только макроудобрения (указанные выше), но и микро-, т.н. витамины полей. Это соединения бора, меди, кобальта, марганца, цинка, молибдена и иода. Они требуются в очень небольших количествах, а превышение нормы вредит растениям.
Передозировка опасна и в случае макроудобрений, т.к. их избыток из почвы вымывается в водоемы и способствует разрастанию водорослей, поглощающих растворенный в воде кислород, поэтому гибнут рыбы и др. К тому же, анаэробное (т.е. без доступа O2) разложение останков организмов приводит к образованию веществ, которые превращают водоемы в болота.
Особенно опасна передозировка нитратов, т.к. с растениями, поглотившими их, нитраты попадают в живые организмы, где превращаются в нитриты. Последние делают гемоглобин неспособным переносить кислород (поэтому возможна даже смерть), а также провоцируют раковые заболевания.
Помимо использования в качестве сельскохозяйственных удобрений фосфаты идут также на приготовление моющих средств и как добавки в корм животным. В последнем случае для синтеза фосфата кальция применяют кислоту Н3РО4, полученную сжиганием чистого фосфора (с последующей гидратацией Р2О5), поскольку природные минералы содержат вредные для скота примеси, например фторид-ионы.
13.
Гидролиз соли
– это обменное взаимодействие ионов
соли с молекулами воды, в результате
которого, как правило, происходит
изменение
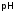 раствора. Гидролиз соли слабой кислоты
и сильного основания (гидролиз по
аниону):
раствора. Гидролиз соли слабой кислоты
и сильного основания (гидролиз по
аниону):
CO32− + H2O = HCO3− + OH−
Na2CO3 + Н2О = NaHCO3 + NaOH
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
Cu2+ + Н2О = CuOH+ + Н+
CuCl2 + Н2О = CuOHCl + HCl
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
3. Гидролиз соли слабой кислоты и слабого основания:
2Al3+ + 3S2− + 6Н2О = 2Al(OH)3(осадок) + ЗН2S(газ)
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
Количественно
процесс гидролиза, а также каждую его
ступень характеризуют степенью гидролиза
(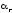 )
и константой равновесия. Величина
)
и константой равновесия. Величина показывает долю гидролизованных частиц
данного сорта (в результате данной
ступени процесса) изависит,
в частности, от концентрации исходной
соли, в отличие от термодинамической
константы равновесия (
показывает долю гидролизованных частиц
данного сорта (в результате данной
ступени процесса) изависит,
в частности, от концентрации исходной
соли, в отличие от термодинамической
константы равновесия ( ).
Выражение последней, например, для
первой ступени гидролиза соли 2-го типа:
).
Выражение последней, например, для
первой ступени гидролиза соли 2-го типа:

запишется
следующим образом: 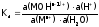 .
.
Считая
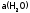 постоянной, получим, что и произведение
постоянной, получим, что и произведение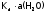 тоже постоянная величина; она называется
константой гидролиза и обозначается
тоже постоянная величина; она называется
константой гидролиза и обозначается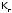 .
.
Итак:
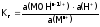 .
.
Величина
константы гидролиза определяется
отношением ионного произведения воды
к константам диссоциации продуктов
гидролиза, являющихся слабыми
электролитами:
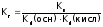 (для солей 4 типа).
(для солей 4 типа).
Для солей 2 и 3 типа зависимость следующая:
 или
или
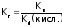
Например, для гидролиза хлорида алюминия по 1-ой ступени:
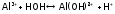 значение
значение
 рассчитывается по формуле:
рассчитывается по формуле:
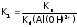 ,
т.е.
,
т.е.
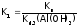 .
.
