
- •12. Азот и фосфор
- •5.1. Общая характеристика. Нахождение в природе. Получение
- •5.2. Простые вещества
- •5.2.1. Структура и физические свойства
- •5.2.2. Химические свойства
- •5.3. Аммиак и соли аммония
- •5.3.1. Получение аммиака
- •5.3.2. Физические и химические свойства
- •5.3.3. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •5.4.3. Нитраты и нитриты
- •5.5. Кислородосодержащие соединения фосфора
- •5.6. Минеральные удобрения
- •14. Общая характеристика. Степени окисления
- •7.3.2. Природные соединения алюминия
- •7.3.3. Физические свойства
- •7.3.4. Химические свойства
- •7.3.5. Оксиды и соли p-элементов
- •7.3.6. Производство алюминия
- •16. Углерод и кремний
- •6.1. Общая характеристика. Нахождение в природе. Получение
- •6.2. Структура и физические свойства простых веществ
- •17. Константа равновесия
- •2.3.2. Сдвиг равновесия
- •19. Строение атома и химическая связь
- •3.1. Электронное строение атома
- •3.1.1. Современная модель атома
- •20. Общая характеристика
- •Получение и свойства s-металлов
- •7.2.4. Сложные вещества s-элементов. Производство соды
- •2.1.1. Термохимия
- •2.1.2. Энтропия. Энергия гиббса
- •2.1.3. Формула гиббса. Разрешенность процессов с позиции термодинамики
- •22. Метан
- •6.5. Кислородосодержащие соединения углерода
- •6.5.1. Общая характеристика и свойства
- •6.6.3. Цемент
- •25. Ионное произведение воды. Водородный показатель. Индикаторы
- •4.2.4. Буферные растворы
- •3.2. Получение простых веществ.
- •3.3. Физические свойства г2
- •27. Кислородосодержащие соединения хлора
- •Взаимодействие г2 с водородом. Получение hCl и ее свойства. Галогеноводородные кислоты
- •32. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •2.1. Распространенность водорода
- •2.2. Сходство водорода с другими элементами
- •2.2.1. Сходство с галогенами
- •2.2.2. Сходство со щелочными металлами
- •40. Особенности водорода
- •2.2.2. Кинетическое уравнение
- •2.2.3. Механизм химических реакций
- •2.2.4. Влияние температуры на скорость
- •2.2.5. Катализ
2.1.2. Энтропия. Энергия гиббса
Связь между различными термодинамическими величинами, характеризующими данное вещество при постоянном давлении, можно изобразить графически в виде соотнесенных отрезков:
где F – химическая энергия, pV – механическая работа (совершенная для придания

данной системе при данном давлении данного объема), G ‑ свободная энергия системы (называется энергией Гиббса), а ST – связанная энергия, ибо ее нельзя перевести в работу (в отличие от свободной) без изменения Т, т.к. это энергия теплового движения.
Связанная
энергия растет с повышением температуры,
поскольку ST – это произведение
коэффициента S на температуру.
Но и сам коэффициент S, называемый
энтропией25,
тоже растет
при
увеличении
T,
ибо является мерой
беспорядка
в веществе: чем менее упорядочено
соединение (в частности, чем интенсивнее
тепловое движение в нем), тем больше
значение S. Энтропия идеального
кристалла при абсолютном
нуле (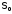 )
равнанулю,
а с повышением
температуры S растет. Причем особенно
значительно она увеличивается при
плавлении вещества и еще более – при
переходе его в газообразное состояние,
когда в нем резко возрастает беспорядок.
)
равнанулю,
а с повышением
температуры S растет. Причем особенно
значительно она увеличивается при
плавлении вещества и еще более – при
переходе его в газообразное состояние,
когда в нем резко возрастает беспорядок.
При данной Т энтропия одного моля данного соединения будет тем больше, чем больше в нем число частиц, чем они разнороднее, чем сложнее сами частицы и чем больше их молекулярная масса. Кроме того, величина S тем выше, чем больший объем занимает 1 моль вещества. А изменение энтропии в ходе реакции будет тем значительнее, чем сильнее различаются реагенты и продукты данной реакции по указанным параметрам.
Для
большинства веществ рассчитали
стандартные26
значения энтропии (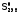 )
и поместили в справочники [1]. А поскольку
S, как и
)
и поместили в справочники [1]. А поскольку
S, как и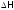 ,
– функция состояния, то ее изменение в
ходе химического процесса (
,
– функция состояния, то ее изменение в
ходе химического процесса ( )
находят по аналогичной формуле:
)
находят по аналогичной формуле:
Например,
для реакции: 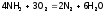 ,
,
имеем:
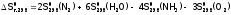 .
.
2.1.3. Формула гиббса. Разрешенность процессов с позиции термодинамики
Из графика
(в виде соотнесенных отрезков), приведенного
выше, видно, что
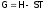 ,
следовательно, G – тоже функция состояния
(при
,
следовательно, G – тоже функция состояния
(при ),
поэтому изменение свободной энергии в
ходе реакции можно рассчитать по формуле
(она называется формулой Гиббса):
),
поэтому изменение свободной энергии в
ходе реакции можно рассчитать по формуле
(она называется формулой Гиббса):
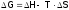 .
(3)
.
(3)
Причем,
если изменение G положительно
(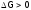 ),
то это означает, что свободная энергия
системы при взаимодействии веществ
должна самопроизвольно возрастать, что
невозможно, поэтому такой процессзапрещен.
Если же изменение G отрицательно
(
),
то это означает, что свободная энергия
системы при взаимодействии веществ
должна самопроизвольно возрастать, что
невозможно, поэтому такой процессзапрещен.
Если же изменение G отрицательно
( )
т.е. энергия Гиббса в ходе реакции
уменьшается, то процессдолжен
идти
самопроизвольно.
)
т.е. энергия Гиббса в ходе реакции
уменьшается, то процессдолжен
идти
самопроизвольно.
Рассмотрим взаимодействия в системах, в которых начальные условия стандартные: Т=298К, р=1атм. и, кроме того, т.н. эффективные концентрации каждой из реагирующих частиц равны по 1моль/л. (Имеются в виду частицы (молекулы, ионы и т.п.) не только исходных веществ, но и продуктов взаимодействия.)
Эффективная концентрация иначе называется активностью 27(обозначается буквой а). Она равна произведениюкоэффициента активности (f) на истинную концентрацию частиц данного сорта (C): a=f∙C.Коэффициент активности показывает долю сравнительно свободных (активных) частиц, не участвующих в «постороннем» межчастичном взаимодействии (ибо оно не приводит к осуществлению данной реакции, поэтому «отвлекает» от нее.) Так, для процесса: А + В = С, «посторонней» является ассоциация частиц А и B не между собой, а с C или со стенками сосуда и т.п.
Подчеркнем, что стандартные значения активностей частиц (ai=1 моль/л) могут соблюдаться лишь в первый момент реакции. А далее, если процесс идет, например, вправо, активности частиц реагентов снижаются, а продуктов – растут.
Для стандартных условий формула Гиббса запишется следующим образом:
 . (3а)
. (3а)
Причем
аналогично рассмотренному выше, при
ст.у. тоже, если
 ,
то процесс должен идтисамопроизвольно,
а при
,
то процесс должен идтисамопроизвольно,
а при
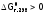 реакциязапрещена.
реакциязапрещена.
Формула
(3а) позволяет оценить
термодинамическую разрешенность
процесса при любой (не только стандартной)
температуре, используя
 и
и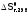 (см. разделы 2.1.1 и 2.1.2), поскольку значения
(см. разделы 2.1.1 и 2.1.2), поскольку значения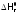 и
и мало зависят отT.
Для простоты будем записывать их,
соответственно, как
мало зависят отT.
Для простоты будем записывать их,
соответственно, как
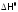 и
и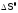 ,
а изменение G при взаимодействии в ст.у.
(кроме значения T, т.е. прилюбой
заданной
температуре) обозначим, как
,
а изменение G при взаимодействии в ст.у.
(кроме значения T, т.е. прилюбой
заданной
температуре) обозначим, как
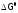 и получим:
и получим:
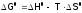 . (3б)
. (3б)
(Подчеркнем,
что в соответствии с формулой (3б) величина
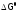 постоянна
при каждой данной
Т для данной
реакции.)
постоянна
при каждой данной
Т для данной
реакции.)
Используя
формулу (3б), проведем оценку знака
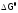 ,
а значит, термодинамическую разрешенность
химического взаимодействия в зависимости
от температуры для четырех возможных
случаев.
,
а значит, термодинамическую разрешенность
химического взаимодействия в зависимости
от температуры для четырех возможных
случаев.
Случай 1.
Если
 (экзопроцесс), а
(экзопроцесс), а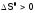 (рост энтропии в ходе реакции), то прилюбой
Т имеем
(рост энтропии в ходе реакции), то прилюбой
Т имеем
 .
И, следовательно, взаимодействие должно
идтисамопроизвольно,
как, например, реакция:
.
И, следовательно, взаимодействие должно
идтисамопроизвольно,
как, например, реакция:
 .
.
Случай 2.
Если
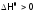 ,
а
,
а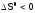 ,
то прилюбой
температуре
,
то прилюбой
температуре
 .
А значит, процесс термодинамическизапрещен
(это реакция, обратная предыдущей).
.
А значит, процесс термодинамическизапрещен
(это реакция, обратная предыдущей).
Случай 3.
Если
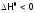 и
и (что соответствует, в частности,
взаимодействию:
(что соответствует, в частности,
взаимодействию: ),
то возможны два варианта:
),
то возможны два варианта:
а)  (это более вероятно принизкой
Т), следовательно,
(это более вероятно принизкой
Т), следовательно,
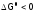 ,
и значит, реакцияразрешена;
,
и значит, реакцияразрешена;
б) 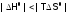 (что более вероятно привысокой
Т), как результат,
(что более вероятно привысокой
Т), как результат,
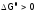 ,
т.е. процессзапрещен.
,
т.е. процессзапрещен.
Температуру
смены
знака
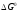 можно рассчитать, приравняв
можно рассчитать, приравняв равным нулю, тогда из формулы (3б) получим:
равным нулю, тогда из формулы (3б) получим: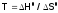 .
.
Случай 4.
Если
 и
и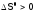 (реакция, обратная предыдущей), то
возможны те же два варианта (рассмотрите
их сами), но выводы обратные.
(реакция, обратная предыдущей), то
возможны те же два варианта (рассмотрите
их сами), но выводы обратные.
Изменение
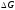 в процессе можно посчитать по формулам,
аналогичным формулам изменения энтальпии
и энтропии, используя табличные значения
в процессе можно посчитать по формулам,
аналогичным формулам изменения энтальпии
и энтропии, используя табличные значения :
:

