
- •12. Азот и фосфор
- •5.1. Общая характеристика. Нахождение в природе. Получение
- •5.2. Простые вещества
- •5.2.1. Структура и физические свойства
- •5.2.2. Химические свойства
- •5.3. Аммиак и соли аммония
- •5.3.1. Получение аммиака
- •5.3.2. Физические и химические свойства
- •5.3.3. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •5.4.3. Нитраты и нитриты
- •5.5. Кислородосодержащие соединения фосфора
- •5.6. Минеральные удобрения
- •14. Общая характеристика. Степени окисления
- •7.3.2. Природные соединения алюминия
- •7.3.3. Физические свойства
- •7.3.4. Химические свойства
- •7.3.5. Оксиды и соли p-элементов
- •7.3.6. Производство алюминия
- •16. Углерод и кремний
- •6.1. Общая характеристика. Нахождение в природе. Получение
- •6.2. Структура и физические свойства простых веществ
- •17. Константа равновесия
- •2.3.2. Сдвиг равновесия
- •19. Строение атома и химическая связь
- •3.1. Электронное строение атома
- •3.1.1. Современная модель атома
- •20. Общая характеристика
- •Получение и свойства s-металлов
- •7.2.4. Сложные вещества s-элементов. Производство соды
- •2.1.1. Термохимия
- •2.1.2. Энтропия. Энергия гиббса
- •2.1.3. Формула гиббса. Разрешенность процессов с позиции термодинамики
- •22. Метан
- •6.5. Кислородосодержащие соединения углерода
- •6.5.1. Общая характеристика и свойства
- •6.6.3. Цемент
- •25. Ионное произведение воды. Водородный показатель. Индикаторы
- •4.2.4. Буферные растворы
- •3.2. Получение простых веществ.
- •3.3. Физические свойства г2
- •27. Кислородосодержащие соединения хлора
- •Взаимодействие г2 с водородом. Получение hCl и ее свойства. Галогеноводородные кислоты
- •32. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •2.1. Распространенность водорода
- •2.2. Сходство водорода с другими элементами
- •2.2.1. Сходство с галогенами
- •2.2.2. Сходство со щелочными металлами
- •40. Особенности водорода
- •2.2.2. Кинетическое уравнение
- •2.2.3. Механизм химических реакций
- •2.2.4. Влияние температуры на скорость
- •2.2.5. Катализ
6.6.3. Цемент
Процесс формирования силикатных полимеров происходит и в случае многих т.н. вяжущих веществ. Это порошкообразные материалы, которые с водой дают пластическую массу, затвердевающую через некоторое время.
К ним относится и цемент. Получают его в силикатной промышленности, прокаливая при 1500°С смесь глины и известняка. При этом за счет частичного разрыва связей Si – O и Al – O в глине образуются силикаты и алюминаты кальция с малополимеризованными анионами. После смешения с водой из-за гидролиза постепенно формируются более полимеризованные анионы, благодаря чему материал твердеет («схватывается»).
Со временем цемент еще сильнее упрочняется из-за постепенного превращения его аморфной структуры в кристаллическую (т.е. с упорядоченной решеткой).
Для повышения прочности в цемент (до его схватывания) добавляют песок или щебень и т.о. получают бетон. А при введении железной арматуры образуется еще более прочный материал – железобетон, из которого строят здания и др.
25. Ионное произведение воды. Водородный показатель. Индикаторы
Полярные молекулы воды обеспечивают диссоциацию на ионы не только растворенных веществ, но и собственных молекул благодаря (в основном) образованию очень прочного иона гидроксония Н3О+ по реакции:
 .
.
Однако
чаще ионизацию воды изображают упрощенно:
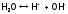 .
.
Константа равновесия этого процесса, т.е. константа диссоциации Н2О:
 .
.
Ее
величина определена по электропроводности
чистой воды и при 220С
равна
 .
Так как степень диссоциации Н2О
очень мала, то можно считать, что
.
Так как степень диссоциации Н2О
очень мала, то можно считать, что
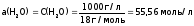 .
.
Подставляя
данное значение а(Н2О)
в выражение
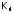 воды, получим:
воды, получим:
 ;
;
здесь
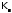 –
ионное произведение воды:
–
ионное произведение воды: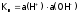 .
.
Перейдем к отрицательным десятичным логарифмам:
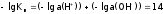 .
.
Отрицательный
логарифм активности ионов водорода
называется водородным
показателем
и обозначается
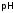 ,
а ионов гидроксила –
,
а ионов гидроксила – ,
таким образом, имеем:
,
таким образом, имеем:
 .
.
Для
чистой
воды (и нейтрального
раствора):
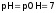 ,
длящелочной
среды:
,
длящелочной
среды:
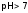 ,
а
,
а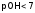 ;
длякислого
раствора – наоборот. Например, в 0,1М
HCl:
;
длякислого
раствора – наоборот. Например, в 0,1М
HCl:
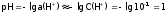 (<7), а
(<7), а (>7).
(>7).
Существуют различные методы определения рН раствора. Простейший – с помощью веществ, которые изменяют свою окраску в зависимости от кислотности или основности среды, поэтому называются кислотно-основными индикаторами.
Это обычно слабые органические кислоты (или основания), молекулы которых обеспечивают один цвет раствора, а их ионы – другой. Например, в случае фенолфталеина (слабая кислота) молекулы НА совсем не окрашивают водный раствор, а анионы (при достаточно высокой концентрации) придают ему малиновый цвет.
В нейтральной
среде равновесие 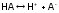 смещеновлево,
и потому раствор бесцветен.
Добавление кислоты
еще более усиливает это смещение.
Введение же щелочи
сдвигает равновесие вправо
(из-за связывания
смещеновлево,
и потому раствор бесцветен.
Добавление кислоты
еще более усиливает это смещение.
Введение же щелочи
сдвигает равновесие вправо
(из-за связывания
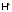 в
в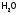 )
и при рН выше 8 концентрация анионов
фенолфталеина оказывается достаточной,
чтобы окраска раствора стала слабо
розовой, а при рН выше 10 – малиновой.
)
и при рН выше 8 концентрация анионов
фенолфталеина оказывается достаточной,
чтобы окраска раствора стала слабо
розовой, а при рН выше 10 – малиновой.
Каждый
индикатор имеет свой интервал
 ,
в котором происходит изменение его
цвета. Благодаря этому оказалось
возможным созданиеуниверсальной
индикаторной бумаги. Она пропитана
различными индикаторами (имеющими
область перехода окраски при разных
,
в котором происходит изменение его
цвета. Благодаря этому оказалось
возможным созданиеуниверсальной
индикаторной бумаги. Она пропитана
различными индикаторами (имеющими
область перехода окраски при разных
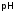 ),
подобранных таким образом, чтобы цвет
бумаги заметно менялся при изменении
),
подобранных таким образом, чтобы цвет
бумаги заметно менялся при изменении наединицу
(в интервале 1÷12).
наединицу
(в интервале 1÷12).
Индикаторной
бумагой удобно пользоваться для
ориентировочных (приблизительных)
измерений. Более точно значение
 растворов определяют с помощью
специального прибора
растворов определяют с помощью
специального прибора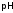 -метра.
-метра.
