
- •12. Азот и фосфор
- •5.1. Общая характеристика. Нахождение в природе. Получение
- •5.2. Простые вещества
- •5.2.1. Структура и физические свойства
- •5.2.2. Химические свойства
- •5.3. Аммиак и соли аммония
- •5.3.1. Получение аммиака
- •5.3.2. Физические и химические свойства
- •5.3.3. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •5.4.3. Нитраты и нитриты
- •5.5. Кислородосодержащие соединения фосфора
- •5.6. Минеральные удобрения
- •14. Общая характеристика. Степени окисления
- •7.3.2. Природные соединения алюминия
- •7.3.3. Физические свойства
- •7.3.4. Химические свойства
- •7.3.5. Оксиды и соли p-элементов
- •7.3.6. Производство алюминия
- •16. Углерод и кремний
- •6.1. Общая характеристика. Нахождение в природе. Получение
- •6.2. Структура и физические свойства простых веществ
- •17. Константа равновесия
- •2.3.2. Сдвиг равновесия
- •19. Строение атома и химическая связь
- •3.1. Электронное строение атома
- •3.1.1. Современная модель атома
- •20. Общая характеристика
- •Получение и свойства s-металлов
- •7.2.4. Сложные вещества s-элементов. Производство соды
- •2.1.1. Термохимия
- •2.1.2. Энтропия. Энергия гиббса
- •2.1.3. Формула гиббса. Разрешенность процессов с позиции термодинамики
- •22. Метан
- •6.5. Кислородосодержащие соединения углерода
- •6.5.1. Общая характеристика и свойства
- •6.6.3. Цемент
- •25. Ионное произведение воды. Водородный показатель. Индикаторы
- •4.2.4. Буферные растворы
- •3.2. Получение простых веществ.
- •3.3. Физические свойства г2
- •27. Кислородосодержащие соединения хлора
- •Взаимодействие г2 с водородом. Получение hCl и ее свойства. Галогеноводородные кислоты
- •32. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •2.1. Распространенность водорода
- •2.2. Сходство водорода с другими элементами
- •2.2.1. Сходство с галогенами
- •2.2.2. Сходство со щелочными металлами
- •40. Особенности водорода
- •2.2.2. Кинетическое уравнение
- •2.2.3. Механизм химических реакций
- •2.2.4. Влияние температуры на скорость
- •2.2.5. Катализ
19. Строение атома и химическая связь
3.1. Электронное строение атома
3.1.1. Современная модель атома
Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и движущихся в его поле отрицательно заряженных электронов (обозначаются е). Заряд ядра (Z), равный числу протонов в нем, определяет число е в атоме элемента, а значит, его химическую индивидуальность, поэтому элементом называют вид атомов с одинаковым зарядом ядра.
Современной атомной моделью является квантово-химическое описание состояний электронов в атоме, которое основано на следующих положениях:
I. Квантование энергии излучения. Причина квантования ‑ наличие строго определенных состояний е в атоме. Разность энергий этих состояний равна кванту энергии, излучаемой (поглощаемой) при переходе е из одного состояния в другое.
II. Принцип неопределенности Гейзенберга. В квантовой химии не определяют траекторию движения е, а лишь рассчитывают вероятность его нахождения в той или иной точке пространства вокруг ядра, т.е. используют вероятностный (статистический) метод описания.
III. Двойственная природа электрона. Хотя е имеет заряд и ненулевую массу покоя, т.е. проявляет свойства корпускулы (материальной частицы), но обладает и явно выраженными волновыми свойствами.
Чтобы
отразить волновой
характер движения е
в атоме, Шредингер в 1926 г. предложил для
описания его состояния использовать
уравнение
сферической стоячей волны,
которое отражает периодические изменения
трехмерной волновой функции е
в пространстве атома. Уравнение
Шредингера16связывает волновые свойства электрона
(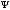 )
и его энергетические характеристики
(E), поэтому коротко может быть записано
следующим образом:
)
и его энергетические характеристики
(E), поэтому коротко может быть записано
следующим образом: ,
где
,
где – оператор Гамильтона, который, в
частности, показывает, что состояниее
в атоме описывается дифференциальным
уравнением (производными
– оператор Гамильтона, который, в
частности, показывает, что состояниее
в атоме описывается дифференциальным
уравнением (производными
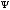 2-го порядка по всем осям координат).Результатом
решения являются, в частности, значениятрех
параметров, т.н. квантовых
чисел:
главного, орбитального и магнитного
(см. раздел 3.1.2). Причем условия решения
уравнения Шредингера (вытекающие из
условий существования е
в атоме) определяют целочисленность
значений указанных параметров.
2-го порядка по всем осям координат).Результатом
решения являются, в частности, значениятрех
параметров, т.н. квантовых
чисел:
главного, орбитального и магнитного
(см. раздел 3.1.2). Причем условия решения
уравнения Шредингера (вытекающие из
условий существования е
в атоме) определяют целочисленность
значений указанных параметров.
Волновая
функция
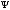 ,
заданная тремя квантовыми числами и
будетатомной
орбиталью (АО).
Ею называют также часть пространства
вокруг ядра, в котором с 90%-ной вероятностью
можно обнаружить электрон.
,
заданная тремя квантовыми числами и
будетатомной
орбиталью (АО).
Ею называют также часть пространства
вокруг ядра, в котором с 90%-ной вероятностью
можно обнаружить электрон.
Вероятность
нахождения е
в том или ином элементарном
объеме пространства ( )
называетсяэлектронной
плотностью
данного объема и равна
)
называетсяэлектронной
плотностью
данного объема и равна
 .
Здесь
.
Здесь – это объем, заключенный между двумя
сферами, имеющими общий центр (в котором
находится ядро атома), причем радиусы
сфер (R1
и R2)
различаются между собой на величину
dR;
а
– это объем, заключенный между двумя
сферами, имеющими общий центр (в котором
находится ядро атома), причем радиусы
сфер (R1
и R2)
различаются между собой на величину
dR;
а
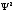 – этоплотность
вероятности
нахождения е
в атоме на расстоянии (R1+dR/2)
от ядра [2].
– этоплотность
вероятности
нахождения е
в атоме на расстоянии (R1+dR/2)
от ядра [2].
Для любой
АО электронная
плотность
(произведение на
на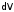 )
в центре атома равна нулю (ибо
)
в центре атома равна нулю (ибо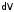 =
0). По мере же увеличения расстояния от
ядра
=
0). По мере же увеличения расстояния от
ядра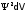 растет от нуля домаксимального
своего значения (из-за роста dV),
а затем снижается (как результат
уменьшения
растет от нуля домаксимального
своего значения (из-за роста dV),
а затем снижается (как результат
уменьшения
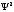 ),
асимптотически приближаясь снова к
нулю.
),
асимптотически приближаясь снова к
нулю.
20. Общая характеристика
Все основные свойства металлов (М): блеск, пластичность, электропроводность и непрозрачность, – обеспечиваются присутствием в их решетке относительно свободных электронов.
Наиболее заметное свойство М – это характерный т.н. металлический блеск; он обусловлен способностью М отражать свет, не рассеивая его17. Другим свойством М являетсяпластичность, т.е. под ударом молота они не дробятся на куски, как, например, алмаз, а лишь расплющиваются.
Хотя все металлы проводят ток, но в разной степени. Наименьшую электропроводность (l) среди М имеет ртуть (ее l принята за единицу), а наибольшую – серебро (l=59). Это значит, что проводимость Ag в 59 раз выше, чем у Hg. Золото же, хотя и является самым пластичным металлом, но по электропроводности (l=40) уступает даже меди (l=57).
Если же сравнивать М по восстановительным свойствам в водной среде, т.е. по значению Е0, то наиболее металлическим окажется литий – именно он возглавляет ряд напряжений М.
Таким образом, абсолютного чемпиона по металличности нет. Кроме того, следует различать понятия «металл» как элемент и «металл» как вещество.
Первое зависит от положения Э в таблице Д.И. Менделеева. И чем левее и ниже он расположен (т.е. чем больше его атомный радиус), тем, как правило, более металлическими свойствами обладает элемент. В частности, тем легче отнять электрон у атома Э и тем с меньшим «желанием» его атом присоединяет е, а значит, тем ниже электроотрицательность элемента. И поскольку цезий обладает наименьшим значением ЭО (0, 70), то он и является самым металлическим Э.
Напоминаем, что к металлам относят элементы, имеющие ЭО менее 1.8. Это все s-, d- и f-Э, а также p-элементы, лежащие ниже диагонали, проходящей в периодической таблице через водород, бериллий, алюминий, германий, сурьму и полоний18. ПричемBe, Al и Po тоже относят к М, которых таким образом насчитывается 92 из 116 элементов, открытых на сегодняшний день.Еще больше металлов-веществ. Ибо к ним относят не только простые соединения, которые обычно образованы металлами-элементами (Fe, Al, Na и т.п.), но и многие сложные вещества. Например, один из образцов алхимического «золота» состава Hg2,86AsF6 (действительно имеющего золотистый цвет) проводит ток, как и М.
Кроме того, даже типичные неметаллы: фосфор, сера и др. при сверхвысоком давлении становятся М. В частности, под давлением 3 млн. атм. металлизируется даже Н2. Это происходит потому, что под таким давлением увеличивается плотность упаковки атомов в решетке вещества, т.е. растет к.ч. элемента, а следовательно, число химических связей каждого атома с другими. Как результат, сами связи ослабевают. А это значит, что электроны менее прочно удерживаются на осях ХС, т.о. становясь свободнее. Вследствие чего и возникает металличность.
И наоборот: разрыхление структуры (из-за снижения к.ч. элемента) приводит к потере имевшихся металлических свойств.
Итак, металличность элемента – это свойство (раз и навсегда данное), а металличность вещества – это его состояние, которое зависит от условий.
Типичные М разделяют на легкие, если их удельная плотность ниже 5 г/см3 (самый легкий – литий (0,53 г/см3)), и тяжелые (например, осмий (22,5 г/см3)); а также на легкоплавкие, если т.пл. ниже 10000С (минимальная – у ртути (-340С)) и тугоплавкие (максимальную т.пл. имеет вольфрам (34200С)).
7.2. s-Металлы и их соединения
7.2.1. Общая характеристика. Нахождение в природе.
К s-элементам относятся щелочные (ЩМ) и щелочноземельные металлы (ЩЗМ), т.е. Э главных подгрупп I и II групп, имеющие конфигурацию s1 и s2 соответственно.
Поэтому ЩМ в соединениях проявляют только ст.ок.+1, а ЩЗМ –+2. И лишь в этих степенях окисления они находятся в природе в виде солей. Это галиды, сульфаты, нитраты, фосфаты, карбонаты, силикаты (например, тальк 3MgO.4SiO2.H2O или асбест CaO.3MgO.4SiO2), алюмосиликаты и др.
В частности, бериллий образует алюмосиликаты состава Be3Al2(SiO3)6, которые являются драгоценными камнями. (Из-за примесей они окрашены в разные цвета: зеленые изумруды, синие аквамарины, фиолетовые александриты и др.)
Больше всего на Земле (из Э данных групп) натрия (2,4%), кальция, магния (по 2%) и калия (1,4%) – они входят в восьмерку самых распространенных. Кларк других – 10-2 -10-3%, а цезия (10-8%), тем более Fr и Ra, значительно ниже.
Основным свойством s-элементов является минимальная прочность связи ядра с валентными е (среди Э каждого данного периода), особенно в случае ЩМ. Это объясняется тем, что при переходе к металлам 1А подгруппы (от соответствующего БЭ) начинается заполнение электронами нового уровня, поэтому атомный радиус резко возрастает. У ЩЗМ он немного меньше, чем у ЩМ (из-за более высокого заряда ядра), но все еще достаточно большой.
Как результат, s-элементы наиболее легко отдают электроны другим Э, а значит, образуют самые ионные соединения, и следовательно, наиболее растворимы в воде. Вот почему многие соли s-металлов входят в состав гидросферы.
Например,
в морской воде – 0,38% хлорида магния,
2,5% хлорида натрия, а солей калия в 40 раз
меньше. Зато в земле наоборот содержание
K+
значительно больше, чем
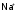 .
Причина в том, что многие алюмосиликаты
(в частности глина)прочнее
удерживают в себе более крупные
(по сравнению с
.
Причина в том, что многие алюмосиликаты
(в частности глина)прочнее
удерживают в себе более крупные
(по сравнению с
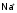 )
ионы калия, которые и накапливаются в
почве при просачивании через нее
природных вод. Благодаря этому К+
становится доступным растениям – им
он нужен для плодоношения.
)
ионы калия, которые и накапливаются в
почве при просачивании через нее
природных вод. Благодаря этому К+
становится доступным растениям – им
он нужен для плодоношения.
В живых
организмах больше ионов натрия (их
массовая доля в крови человека составляет
0,6%, в мышцах – 1,5%), но и К+
необходим. Нужны организму также
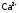 и
и .
Они находятся в крови и в костной ткани
(80% массы которой составляет Са3(РО4)2).
Напротив, Ве2+
и Ва2+
являются для организма ядами.
.
Они находятся в крови и в костной ткани
(80% массы которой составляет Са3(РО4)2).
Напротив, Ве2+
и Ва2+
являются для организма ядами.
