
- •12. Азот и фосфор
- •5.1. Общая характеристика. Нахождение в природе. Получение
- •5.2. Простые вещества
- •5.2.1. Структура и физические свойства
- •5.2.2. Химические свойства
- •5.3. Аммиак и соли аммония
- •5.3.1. Получение аммиака
- •5.3.2. Физические и химические свойства
- •5.3.3. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •5.4.3. Нитраты и нитриты
- •5.5. Кислородосодержащие соединения фосфора
- •5.6. Минеральные удобрения
- •14. Общая характеристика. Степени окисления
- •7.3.2. Природные соединения алюминия
- •7.3.3. Физические свойства
- •7.3.4. Химические свойства
- •7.3.5. Оксиды и соли p-элементов
- •7.3.6. Производство алюминия
- •16. Углерод и кремний
- •6.1. Общая характеристика. Нахождение в природе. Получение
- •6.2. Структура и физические свойства простых веществ
- •17. Константа равновесия
- •2.3.2. Сдвиг равновесия
- •19. Строение атома и химическая связь
- •3.1. Электронное строение атома
- •3.1.1. Современная модель атома
- •20. Общая характеристика
- •Получение и свойства s-металлов
- •7.2.4. Сложные вещества s-элементов. Производство соды
- •2.1.1. Термохимия
- •2.1.2. Энтропия. Энергия гиббса
- •2.1.3. Формула гиббса. Разрешенность процессов с позиции термодинамики
- •22. Метан
- •6.5. Кислородосодержащие соединения углерода
- •6.5.1. Общая характеристика и свойства
- •6.6.3. Цемент
- •25. Ионное произведение воды. Водородный показатель. Индикаторы
- •4.2.4. Буферные растворы
- •3.2. Получение простых веществ.
- •3.3. Физические свойства г2
- •27. Кислородосодержащие соединения хлора
- •Взаимодействие г2 с водородом. Получение hCl и ее свойства. Галогеноводородные кислоты
- •32. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •2.1. Распространенность водорода
- •2.2. Сходство водорода с другими элементами
- •2.2.1. Сходство с галогенами
- •2.2.2. Сходство со щелочными металлами
- •40. Особенности водорода
- •2.2.2. Кинетическое уравнение
- •2.2.3. Механизм химических реакций
- •2.2.4. Влияние температуры на скорость
- •2.2.5. Катализ
2.1.1. Термохимия
Химические
процессы могут протекать с выделением
или поглощением различных видов энергий:
электрической, световой и т.п., но чаще
сопровождаются тепловыми
эффектами20,
которые изучают в особом разделе –термохимии.В
рамках термохимии 1-ое начало термодинамики:
тепловой эффект реакции (Q) складывается
из изменения
внутренней
энергии данной системы (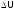 )
иработы
(A), совершенной этой системой (в частности,
работы расширения), т. е.:
)
иработы
(A), совершенной этой системой (в частности,
работы расширения), т. е.:
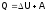 . (2)
. (2)
Внутренняя энергия (U) – это вся энергия системы без учета ее кинетической и потенциальной энергии как макротела, поэтому U – функция состояния системы.
Состояние системы определяется параметрами: T, p, V и x, где x – качественный и количественный состав системы. Причем изменение хотя бы одного параметра называется процессом, а изменение x – химической реакцией.
Если
какая-либо характеристика вещества
является функцией
состояния,
то ее величина определяется только
значениями параметров в данный момент
и не зависит от пути,
каким система пришла в данное состояние.
И если известны значения функции в
«исходной»
точке процесса и в «конечной»,
то изменение функции при переходе
системы из 1-ой точки во 2-ую равно разности
ее значений в этих точках. Поэтому в
формуле (1) изменение внутренней
энергии записано как
 .
.
Напротив, величина A (если это работа расширения) определяется формулой:
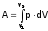 ,
поэтому А – функция пути
процесса21,
а не состояния системы. Следовательно,
и Q в соответствии с равенством (1) –
функция пути.В
изобарном
режиме: p=const и
,
поэтому А – функция пути
процесса21,
а не состояния системы. Следовательно,
и Q в соответствии с равенством (1) –
функция пути.В
изобарном
режиме: p=const и
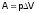 ,
т.е. работа, следовательно, и Q (в
соответствии с формулой (1) становятся
функциями состояния). В этом случае Q
обозначается как
,
т.е. работа, следовательно, и Q (в
соответствии с формулой (1) становятся
функциями состояния). В этом случае Q
обозначается как (где
(где и называетсяэнтальпией,
что в переводе с греческого, означает
теплосодержание
расширенной
(до объема V)
системы).
и называетсяэнтальпией,
что в переводе с греческого, означает
теплосодержание
расширенной
(до объема V)
системы).
Итак,
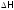 (изменение энтальпии) являетсяфункцией
состояния.
(изменение энтальпии) являетсяфункцией
состояния.
Таким
образом, тепловой
эффект
химической реакции, протекающей при
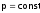 ,
(обозначается
,
(обозначается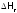 )22не зависит от пути процесса, а определяется
лишь начальным и конечным состоянием
системы. Это формулировказакона
Гесса, из
которого вытекают два следствия:Следствие 1.
В стандартных
условиях
(ст.у.):
)22не зависит от пути процесса, а определяется
лишь начальным и конечным состоянием
системы. Это формулировказакона
Гесса, из
которого вытекают два следствия:Следствие 1.
В стандартных
условиях
(ст.у.):
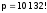 Па23,
T=298 К (или 250С),
– тепловой эффект получения одного
моля данного соединения из исходных
простых веществ есть величина постоянная,
называется стандартной
теплотой образования
(обозначается
Па23,
T=298 К (или 250С),
– тепловой эффект получения одного
моля данного соединения из исходных
простых веществ есть величина постоянная,
называется стандартной
теплотой образования
(обозначается
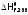 )24и приводится в справочниках. Очевидно,
что
)24и приводится в справочниках. Очевидно,
что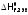 простого вещества из этого же простого
вещества в ст.у. равна 0.Следствие 2.
Тепловой эффект реакции при данной
температуре равен сумме теплот образования
продуктов реакции (п.р.) за вычетом суммы
теплот образования исходных веществ,
т.е. реагентов (р.) (если все указанные
простого вещества из этого же простого
вещества в ст.у. равна 0.Следствие 2.
Тепловой эффект реакции при данной
температуре равен сумме теплот образования
продуктов реакции (п.р.) за вычетом суммы
теплот образования исходных веществ,
т.е. реагентов (р.) (если все указанные
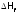 определены приодной
и той
же
данной T).
Для ст.у. это запишется следующим образом:
определены приодной
и той
же
данной T).
Для ст.у. это запишется следующим образом:
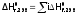 (п.р.)
(п.р.) (р.).
(р.).
Причем
знак
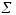 включает суммирование и по числу молей
каждого соединения с учетомстехиометрии
уравнения реакции. Например, для процесса:
включает суммирование и по числу молей
каждого соединения с учетомстехиометрии
уравнения реакции. Например, для процесса:
 имеем:
имеем:

Закон
Гесса позволяет по справочным данным
рассчитать тепловой эффект любого
процесса, даже если он не осуществим
экспериментально, используя схемы
циклов. Например, чтобы рассчитать
энтальпию образования (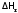 )
кристаллогидрата (
)
кристаллогидрата ( (медного купороса)) из безводного (б/в)
сульфата меди, составляем следующий
цикл:
(медного купороса)) из безводного (б/в)
сульфата меди, составляем следующий
цикл:

где ∆H1 и ∆H2 - энтальпия растворения в воде безводной соли и кристаллогидрата соответственно (их значения есть в справочнике).
По закону
Гесса:
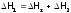 .
Откуда
.
Откуда .
.
Вместо
цикла можно использовать термохимические
уравнения
для отдельных стадий цикла. Чтобы
уравнение являлось термохимическим,
оно должно: содержать указания агрегатных
состояний
всех соединений и включать значение
теплового
эффекта
процесса, причем реакция считается
эндотермической,
т.е. идет с поглощением тепла системой,
если
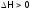 ,
иэкзотермической
(тепло
выделяется) – при
,
иэкзотермической
(тепло
выделяется) – при
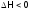 .
.
Пример. Определить экспериментально тепловой эффект превращения графита в алмаз невозможно. Но используя термохимические уравнения, этот эффект можно рассчитать, производя обыкновенные алгебраические действия. Известно, что и графит, и алмаз сгорают в атмосфере кислорода с образованием одного и того же продукта (углекислого газа), но с выделением разного количества тепла:
 ,
,  -393.50
кДж/моль,
-393.50
кДж/моль,
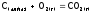 ,
, 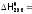 -395.28
кДж/моль.
-395.28
кДж/моль.
Если вычесть из первого термохимического уравнения второе, то получим:
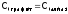 ,
, 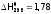 кДж/моль,
кДж/моль,
т.е. с позиции термодинамики графит должен переходить в алмаз с поглощением небольшого количества тепла. Однако известно, как трудно это осуществить.
