
- •12. Азот и фосфор
- •5.1. Общая характеристика. Нахождение в природе. Получение
- •5.2. Простые вещества
- •5.2.1. Структура и физические свойства
- •5.2.2. Химические свойства
- •5.3. Аммиак и соли аммония
- •5.3.1. Получение аммиака
- •5.3.2. Физические и химические свойства
- •5.3.3. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •5.4.3. Нитраты и нитриты
- •5.5. Кислородосодержащие соединения фосфора
- •5.6. Минеральные удобрения
- •14. Общая характеристика. Степени окисления
- •7.3.2. Природные соединения алюминия
- •7.3.3. Физические свойства
- •7.3.4. Химические свойства
- •7.3.5. Оксиды и соли p-элементов
- •7.3.6. Производство алюминия
- •16. Углерод и кремний
- •6.1. Общая характеристика. Нахождение в природе. Получение
- •6.2. Структура и физические свойства простых веществ
- •17. Константа равновесия
- •2.3.2. Сдвиг равновесия
- •19. Строение атома и химическая связь
- •3.1. Электронное строение атома
- •3.1.1. Современная модель атома
- •20. Общая характеристика
- •Получение и свойства s-металлов
- •7.2.4. Сложные вещества s-элементов. Производство соды
- •2.1.1. Термохимия
- •2.1.2. Энтропия. Энергия гиббса
- •2.1.3. Формула гиббса. Разрешенность процессов с позиции термодинамики
- •22. Метан
- •6.5. Кислородосодержащие соединения углерода
- •6.5.1. Общая характеристика и свойства
- •6.6.3. Цемент
- •25. Ионное произведение воды. Водородный показатель. Индикаторы
- •4.2.4. Буферные растворы
- •3.2. Получение простых веществ.
- •3.3. Физические свойства г2
- •27. Кислородосодержащие соединения хлора
- •Взаимодействие г2 с водородом. Получение hCl и ее свойства. Галогеноводородные кислоты
- •32. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •2.1. Распространенность водорода
- •2.2. Сходство водорода с другими элементами
- •2.2.1. Сходство с галогенами
- •2.2.2. Сходство со щелочными металлами
- •40. Особенности водорода
- •2.2.2. Кинетическое уравнение
- •2.2.3. Механизм химических реакций
- •2.2.4. Влияние температуры на скорость
- •2.2.5. Катализ
40. Особенности водорода
Одна из особенностей водорода состоит в том, что его простое вещество Н2 имеет минимальную молекулярную массу (Мr) и, значит, является самым легким газом (в 14,5 раз легче воздуха, поэтому им наполняют стратостаты, дирижабли и т.п.).
Легкостью водорода объясняется низкое его содержание в атмосфере (всего 10‑4%), хотя на Земле постоянно идут процессы образования Н2. Например, при разложении органических веществ без доступа воздуха. Выделяется он и во время извержения вулканов, при бурении нефтяных скважин (в составе природного газа), а также зелеными листьями растений (при их дыхании).
Однако,
почти весь водород улетучивается на
высоту примерно 100 км, где атомизируется
и ионизируется до
 ,
пополняя т.н. «протонный пояс» Земли.
(Именно порывы «протонного ветра»
(считают ученые) являются причиной
северных сияний, а также нарушений
радиосвязи.)
,
пополняя т.н. «протонный пояс» Земли.
(Именно порывы «протонного ветра»
(считают ученые) являются причиной
северных сияний, а также нарушений
радиосвязи.)
Другой
особенностью водорода
является то, что энергия связи Н–Н очень
велика – составляет 435 кДж/моль. (Самая
прочная из всех ординарных ХС.) Это
объясняется тем, что в
 единственные
2 электрона двумя «голыми»
ядрами притягиваются особенно
сильно,
а значит, прочно
фиксируются между ними.
единственные
2 электрона двумя «голыми»
ядрами притягиваются особенно
сильно,
а значит, прочно
фиксируются между ними.
Как следствие:
а) для реакций с участием Н2 высока энергия активного состояния Еа.с., т.е. процессы идут в достаточно жестких условиях. Например, сероводород (H2S) образуется при пропускании струи водорода над кипящей серой. Таким образом, Н2 не только термодинамически, но и кинетически пассивнее, чем Г2 или ЩМ.
б) из-за
большой прочности и, как следствие,
жесткости
связи Н–Н молекулы водорода (неполярные)
обладают незначительной
поляризуемостью. А значит, способны
лишь к очень
слабым
дисперсионным взаимодействиям с другими
частицами, в том числе, с молекулами
растворителей. Поэтому ничтожна
растворимость
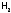 не только в воде, но и в органических
жидкостях.
не только в воде, но и в органических
жидкостях.
в) особенно
слабы дисперсионные взаимодействия
молекул водорода между
собой.
К тому же, частицы
 из-за их малой
из-за их малой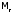 крайне подвижны (наиболее подвижные
среди всех молекул). И потому требуетсяособенно
глубокое
охлаждение для сжижения37водорода. Как следствие (и ничтожной
величины дисперсионных взаимодействий,
и минимального значения Мr),
крайне подвижны (наиболее подвижные
среди всех молекул). И потому требуетсяособенно
глубокое
охлаждение для сжижения37водорода. Как следствие (и ничтожной
величины дисперсионных взаимодействий,
и минимального значения Мr),
 имеет самыенизкие
(после гелия38)
температуры кипения (т.кип.) и плавления
(т.пл.): –252,2°С и –259,1°С соответственно.
Это используется для отделения водорода
от других газов (исключая гелий)cнижением
температуры, достаточным для вымораживания
всех веществ, кроме Н2.
Третья
особенность водорода
состоит в том, что, в отличие от иных
катионов,
имеет самыенизкие
(после гелия38)
температуры кипения (т.кип.) и плавления
(т.пл.): –252,2°С и –259,1°С соответственно.
Это используется для отделения водорода
от других газов (исключая гелий)cнижением
температуры, достаточным для вымораживания
всех веществ, кроме Н2.
Третья
особенность водорода
состоит в том, что, в отличие от иных
катионов,
 не
имеет
электронов.
Следствием этого является следующее:
не
имеет
электронов.
Следствием этого является следующее:
а) ион Н+,
приближаясь к другим атомам, не испытывает
межэлектронного
отталкивания
(ибо нечем отталкиваться от е
другого элемента). Поэтому положительно
заряженный водород одной молекулы может
образовать дополнительную
прочную связь с атомом элемента соседней
молекулы, если этот атом достаточно
отрицательно
заряжен. Как, например, F, O
или N в соединениях HF,
 и
и соответственно (а также в органических
веществах, содержащих эти элементы).
Такие связимежду
молекулами называются водородными.
Они
направлены, насыщаемы
и значительно прочнее,
чем межмолекулярные связи.
соответственно (а также в органических
веществах, содержащих эти элементы).
Такие связимежду
молекулами называются водородными.
Они
направлены, насыщаемы
и значительно прочнее,
чем межмолекулярные связи.
б) являясь
«голым» протоном, катион водорода имеет
повышенную электрофильность
(т.е. любовь к е).
Поэтому в соединениях, в частности, в
кислородосодержащих кислотах,
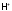 в значительной степени перетягивает
электроны на себя (что на рисунке 1
отражено стрелками). Это, во-первых,ослабляет
связи в анионе,
а во-вторых, делает его несимметричным,
а потому менее устойчивым.
Такое явление называют поляризующим
действием
катиона на анион или поляризацией.
в значительной степени перетягивает
электроны на себя (что на рисунке 1
отражено стрелками). Это, во-первых,ослабляет
связи в анионе,
а во-вторых, делает его несимметричным,
а потому менее устойчивым.
Такое явление называют поляризующим
действием
катиона на анион или поляризацией.
В частности, из-за сильного поляризующего действия Н+ на карбонат-анион угольная кислота настолько нестабильна, что существует только в разбавленных растворах, а при попытке выделить ее в свободном состоянии полностью распадается на оксиды. Механизм распада показан на рис. 1, а в краткой форме этот распад отражается уравнением:
 .
.
В
то же время карбонат натрия ( )
даже плавится (при 8580С)
без разложения, ибо
)
даже плавится (при 8580С)
без разложения, ибо
 очень
слабо
поляризует анион из-за низкой ЭО натрия
(0,9), гораздо меньшей, чем ЭО водорода
(2,1). Другие металлы тоже имеют ЭО ниже,
чем Н, и это одна из причин, по которой
кислоты
менее
устойчивы,
чем их
соли.
очень
слабо
поляризует анион из-за низкой ЭО натрия
(0,9), гораздо меньшей, чем ЭО водорода
(2,1). Другие металлы тоже имеют ЭО ниже,
чем Н, и это одна из причин, по которой
кислоты
менее
устойчивы,
чем их
соли.
41Электролитическая
диссоциация – это распад молекул
растворенного вещества на ионы под
действием растворителя. Количественно
способность распадаться на ионы
характеризуется степенью
диссоциации ( ).
Она показывает, какая доля от общего
количества данного соединения присутствует
в растворе в виде ионов.
).
Она показывает, какая доля от общего
количества данного соединения присутствует
в растворе в виде ионов.
В зависимости
от значения
 различают сильные и слабые электролиты.
различают сильные и слабые электролиты.
Слабыми
электролитами
называют вещества, в 0,1М растворах
которых наряду с ионами существуют и
неионизированные молекулы (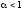 ).
К ним относятся гидрат аммиака, все
органические основания и кислоты; из
неорганических кислот:
).
К ним относятся гидрат аммиака, все
органические основания и кислоты; из
неорганических кислот: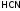 ,
,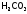 ,
, ,
,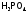 ,
,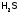 ,
,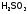 и т.п.
и т.п.
Если 0,1М
раствор не содержит молекул исходного
вещества в недиссоциированном виде,
т.е.
 ,
то электролит называютсильным.
Это почти все растворимые
основания (т.е. щелочи) и соли, а также
неорганические кислоты (в которых, как
правило, анионообразующий элемент,
находясь в высшей ст.ок., имеет достаточно
высокую электроотрицательность):
,
то электролит называютсильным.
Это почти все растворимые
основания (т.е. щелочи) и соли, а также
неорганические кислоты (в которых, как
правило, анионообразующий элемент,
находясь в высшей ст.ок., имеет достаточно
высокую электроотрицательность):
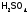 ,
,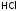 ,
, и т.п.
и т.п.
Отметим,
что кажущаяся
степень
диссоциации сильных электролитов меньше
единицы, хотя
отсутствие молекул в таких растворах
доказано спектральным методом. Указанное
противоречие объясняется наличием в
этих растворах ассоциатов
(в частности, ионных пар), в которых связь
между ионами осуществляется хотя бы
через одну молекулу воды:
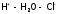 .
Коротко их записывают
.
Коротко их записывают ,
в отличие от недиссоциированных молекул
,
в отличие от недиссоциированных молекул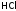 .
.
Более
строгой величиной (чем
 ),
не зависящей от состава раствора,
является термодинамическая константа
равновесия, которая называетсяконстантой
диссоциации
(
),
не зависящей от состава раствора,
является термодинамическая константа
равновесия, которая называетсяконстантой
диссоциации
( ).
Например, для уксусной кислоты, имеем:
).
Например, для уксусной кислоты, имеем:
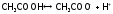 ,
, 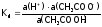 .
.
В случае многоосновных слабых кислот (и аналогичных оснований) диссоциация идет по ступеням. Причем 1-ая ступень протекает в большей степени, чем 2-ая (а 2-ая, чем 3-я), т.к. незаряженная частица, например, молекула сернистой кислоты, легче диссоциирует с отщеплением протона:
 ,
,
чем отрицательно заряженный анион (в соответствии с законом Кулона):
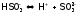 .
.
Многостадийные
процессы характеризуют с помощью т.н.
ступенчатых
 ,
которые индексируются цифрой,
соответствующей номеру ступени, в
частности, для диссоциации ортофосфорной
кислоты с отщеплениемвторого
протона имеем:
,
которые индексируются цифрой,
соответствующей номеру ступени, в
частности, для диссоциации ортофосфорной
кислоты с отщеплениемвторого
протона имеем:
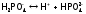 ,
, 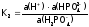 .
.
Подчеркнем,
что
 можно использовать и как характеристикусильных
электролитов. Например, для равновесия,
существующего в растворе
можно использовать и как характеристикусильных
электролитов. Например, для равновесия,
существующего в растворе
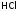 :
:
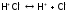 ,
получим:
,
получим:
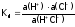 ,
где
,
где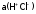 – активность ионных ассоциатов в
растворе
– активность ионных ассоциатов в
растворе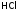 .
В этом случае она называетсякажущейся
константой диссоциации.
.
В этом случае она называетсякажущейся
константой диссоциации.
43.1
закон. В любой изолированной системе
запас энергии остаётся постоянным.
Энтальпи́я, также тепловая функция и
теплосодержание — термодинамический
потенциал, характеризующий состояние
системы в термодинамическом равновесии
при выборе в качестве независимых
переменных давления, энтропии и числа
частиц. (п.р.)
(п.р.) (р.).
(р.).
44. Все основные свойства металлов (М): блеск, пластичность, электропроводность и непрозрачность, – обеспечиваются присутствием в их решетке относительно свободных электронов.
Наиболее заметное свойство М – это характерный т.н. металлический блеск; он обусловлен способностью М отражать свет, не рассеивая его39. Другим свойством М являетсяпластичность, т.е. под ударом молота они не дробятся на куски, как, например, алмаз, а лишь расплющиваются.
Хотя все металлы проводят ток, но в разной степени. Наименьшую электропроводность (l) среди М имеет ртуть (ее l принята за единицу), а наибольшую – серебро (l=59). Это значит, что проводимость Ag в 59 раз выше, чем у Hg. Золото же, хотя и является самым пластичным металлом, но по электропроводности (l=40) уступает даже меди (l=57).
Если же сравнивать М по восстановительным свойствам в водной среде, т.е. по значению Е0, то наиболее металлическим окажется литий – именно он возглавляет ряд напряжений М.
Таким образом, абсолютного чемпиона по металличности нет. Кроме того, следует различать понятия «металл» как элемент и «металл» как вещество.
Первое зависит от положения Э в таблице Д.И. Менделеева. И чем левее и ниже он расположен (т.е. чем больше его атомный радиус), тем, как правило, более металлическими свойствами обладает элемент. В частности, тем легче отнять электрон у атома Э и тем с меньшим «желанием» его атом присоединяет е, а значит, тем ниже электроотрицательность элемента. И поскольку цезий обладает наименьшим значением ЭО (0, 70), то он и является самым металлическим Э.
Напоминаем, что к металлам относят элементы, имеющие ЭО менее 1.8. Это все s-, d- и f-Э, а также p-элементы, лежащие ниже диагонали, проходящей в периодической таблице через водород, бериллий, алюминий, германий, сурьму и полоний40. ПричемBe, Al и Po тоже относят к М, которых таким образом насчитывается 92 из 116 элементов, открытых на сегодняшний день.Еще больше металлов-веществ. Ибо к ним относят не только простые соединения, которые обычно образованы металлами-элементами (Fe, Al, Na и т.п.), но и многие сложные вещества. Например, один из образцов алхимического «золота» состава Hg2,86AsF6 (действительно имеющего золотистый цвет) проводит ток, как и М.
Кроме того, даже типичные неметаллы: фосфор, сера и др. при сверхвысоком давлении становятся М. В частности, под давлением 3 млн. атм. металлизируется даже Н2. Это происходит потому, что под таким давлением увеличивается плотность упаковки атомов в решетке вещества, т.е. растет к.ч. элемента, а следовательно, число химических связей каждого атома с другими. Как результат, сами связи ослабевают. А это значит, что электроны менее прочно удерживаются на осях ХС, т.о. становясь свободнее. Вследствие чего и возникает металличность.
И наоборот: разрыхление структуры (из-за снижения к.ч. элемента) приводит к потере имевшихся металлических свойств.
Итак, металличность элемента – это свойство (раз и навсегда данное), а металличность вещества – это его состояние, которое зависит от условий.
Типичные М разделяют на легкие, если их удельная плотность ниже 5 г/см3 (самый легкий – литий (0,53 г/см3)), и тяжелые (например, осмий (22,5 г/см3)); а также на легкоплавкие, если т.пл. ниже 10000С (минимальная – у ртути (-340С)) и тугоплавкие (максимальную т.пл. имеет вольфрам (34200С)).
45. Химическая кинетика – раздел химии, рассматривающий скорость химических процессов и их механизм. Скорость теоретически определяется числом элементарных актов взаимодействия41 в единицу времени в единице объема (в гомогенных системах) или на единице поверхности (для гетерогенных реакций). На практике независимо от того гомогенной или гетерогенной является система, скоростью процесса считают изменение концентрации какого-либо вещества в единицу времени в жидкой или газовой фазе.
