
- •12. Азот и фосфор
- •5.1. Общая характеристика. Нахождение в природе. Получение
- •5.2. Простые вещества
- •5.2.1. Структура и физические свойства
- •5.2.2. Химические свойства
- •5.3. Аммиак и соли аммония
- •5.3.1. Получение аммиака
- •5.3.2. Физические и химические свойства
- •5.3.3. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •5.4.3. Нитраты и нитриты
- •5.5. Кислородосодержащие соединения фосфора
- •5.6. Минеральные удобрения
- •14. Общая характеристика. Степени окисления
- •7.3.2. Природные соединения алюминия
- •7.3.3. Физические свойства
- •7.3.4. Химические свойства
- •7.3.5. Оксиды и соли p-элементов
- •7.3.6. Производство алюминия
- •16. Углерод и кремний
- •6.1. Общая характеристика. Нахождение в природе. Получение
- •6.2. Структура и физические свойства простых веществ
- •17. Константа равновесия
- •2.3.2. Сдвиг равновесия
- •19. Строение атома и химическая связь
- •3.1. Электронное строение атома
- •3.1.1. Современная модель атома
- •20. Общая характеристика
- •Получение и свойства s-металлов
- •7.2.4. Сложные вещества s-элементов. Производство соды
- •2.1.1. Термохимия
- •2.1.2. Энтропия. Энергия гиббса
- •2.1.3. Формула гиббса. Разрешенность процессов с позиции термодинамики
- •22. Метан
- •6.5. Кислородосодержащие соединения углерода
- •6.5.1. Общая характеристика и свойства
- •6.6.3. Цемент
- •25. Ионное произведение воды. Водородный показатель. Индикаторы
- •4.2.4. Буферные растворы
- •3.2. Получение простых веществ.
- •3.3. Физические свойства г2
- •27. Кислородосодержащие соединения хлора
- •Взаимодействие г2 с водородом. Получение hCl и ее свойства. Галогеноводородные кислоты
- •32. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •2.1. Распространенность водорода
- •2.2. Сходство водорода с другими элементами
- •2.2.1. Сходство с галогенами
- •2.2.2. Сходство со щелочными металлами
- •40. Особенности водорода
- •2.2.2. Кинетическое уравнение
- •2.2.3. Механизм химических реакций
- •2.2.4. Влияние температуры на скорость
- •2.2.5. Катализ
2.2.2. Кинетическое уравнение
Зависимость скорости от различных факторов выражается т.н. кинетическим уравнением. Например, в случае процесса:
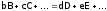 , (4)
, (4)
если
он является гомогенным и одностадийным42,
кинетическое уравнение дляпрямого
взаимодействия:
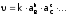 ,
а для обратной реакции:
,
а для обратной реакции: 43Суммарная
же скорость процесса (
43Суммарная
же скорость процесса ( ),
очевидно, равна разности:
),
очевидно, равна разности: .
.
Коэффициенты
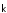 и
и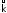 называютсяконстантами
скоростей
прямой и обратной реакций соответственно.
Они отражают влияние природы реагентов44,
температуры и др. – на скорость. Физический
смысл
называютсяконстантами
скоростей
прямой и обратной реакций соответственно.
Они отражают влияние природы реагентов44,
температуры и др. – на скорость. Физический
смысл и
и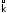 ,
как следует из кинетических уравнений,
– этоскорости
процессов (прямого и обратного) при
стандартных
значениях активностей (равных, напоминаем,
по 1 моль/л). Эти константы имеют
размерность скорости, поскольку в
кинетические уравнения активности
подставляются в относительных
единицах (по отношению к 1 моль/л),
т.е. безразмерными.Показатели степеней
в кинетическом уравнении являются
порядками
процесса по соответствующим реагентам
и отражают степень
влияния
активности каждой из взаимодействующих
частиц на скорость. А сумма этих
показателей называется общим
порядком
процесса. В случае гомогенной одностадийной
реакции общий порядок совпадает с
молекулярностью
(т.е. с числом частиц, сталкивающихся
при элементарном акте взаимодействия),
значение которой не бывает более трех.
,
как следует из кинетических уравнений,
– этоскорости
процессов (прямого и обратного) при
стандартных
значениях активностей (равных, напоминаем,
по 1 моль/л). Эти константы имеют
размерность скорости, поскольку в
кинетические уравнения активности
подставляются в относительных
единицах (по отношению к 1 моль/л),
т.е. безразмерными.Показатели степеней
в кинетическом уравнении являются
порядками
процесса по соответствующим реагентам
и отражают степень
влияния
активности каждой из взаимодействующих
частиц на скорость. А сумма этих
показателей называется общим
порядком
процесса. В случае гомогенной одностадийной
реакции общий порядок совпадает с
молекулярностью
(т.е. с числом частиц, сталкивающихся
при элементарном акте взаимодействия),
значение которой не бывает более трех.
Отметим, что порядок реакции (в отличие от ее молекулярности) может быть дробным, что обычно указывает на многостадийность процесса. А также нулевым, например, для гетерогенной системы:
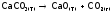 ,
,
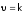 ,
т.к. активности чистыхтвердых
(а также жидких) веществ как постоянные
(при данной T) входят
в константы,
в нашем примере – в значение
,
т.к. активности чистыхтвердых
(а также жидких) веществ как постоянные
(при данной T) входят
в константы,
в нашем примере – в значение
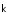 .
И в формулы вместо них подставляют 1.
.
И в формулы вместо них подставляют 1.
2.2.3. Механизм химических реакций
Механизм большинства одностадийных химических взаимодействий, а также отдельных стадий многостадийных процессов, включает формирование т.н. активированного комплекса (а.к.) в качестве промежуточного продукта.
Активированный
(или переходный45)комплекс
– это такая ассоциация
взаимодействующих (в элементарном акте
реакции) частиц, при формировании которой
происходит ослабление
старых химических связей и зарождение
новых (еще относительно слабых). Например,
в случае одностадийного трехмолекулярного
процесса:
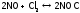 ,
,
при
столкновении двух частиц
 и одной
и одной получается а.к. следующего вида:
получается а.к. следующего вида:
![]() ,
,
в
котором затем рвется связь
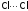 и упрочняются связи
и упрочняются связи (пунктиром показаны ослабленные связи
без уточнения их кратности). При
осуществлении обратной реакции –
наоборот, но а.к.тот
же.
Возможный механизм протекания
одностадийного двухмолекулярного
взаимодействия показан
на рис. 1, линия (а).
(пунктиром показаны ослабленные связи
без уточнения их кратности). При
осуществлении обратной реакции –
наоборот, но а.к.тот
же.
Возможный механизм протекания
одностадийного двухмолекулярного
взаимодействия показан
на рис. 1, линия (а).
Итак, для образования активированного комплекса частицы должны столкнуться при определенной ориентации относительно друг друга (в нашем примере молекулы NO ‑ атомами азота с двух сторон частицы Cl2).
При этом,
чтобы а.к. сформировался, сталкивающиеся
молекулы должны обладать достаточно
высокой энергией,
т.е. соответствующей величине
 (рис.
1). Часто из-за слишком большого значения
(рис.
1). Часто из-за слишком большого значения (практически не достигаемого частицами
в условиях опыта) не идет дажетермодинамически
разрешенный процесс.
(практически не достигаемого частицами
в условиях опыта) не идет дажетермодинамически
разрешенный процесс.
2.2.4. Влияние температуры на скорость
Влияние
Т на скорость процесса отражает формула
Вант-Гоффа:
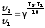 ,
,
где
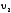 и
и
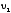 ‑ скорости взаимодействия при
‑ скорости взаимодействия при и
и соответственно, а
соответственно, а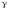 ‑
температурный коэффициент, который
для разных реакций принимает разные
значения в интервале от 2 до 4. Из правила
Вант-Гоффа следует, что при повышении
Т на каждые 100 скорость увеличивается
в 2 – 4 раза.
‑
температурный коэффициент, который
для разных реакций принимает разные
значения в интервале от 2 до 4. Из правила
Вант-Гоффа следует, что при повышении
Т на каждые 100 скорость увеличивается
в 2 – 4 раза.
У правила Вант-Гоффа есть много ограничений. Более полно отражает зависимость константы скорости, а значит и скорости процесса, от температуры уравнение Аррениуса:
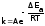 ,
,
где k – константа скорости, А – параметр, учитывающий число удачных столкновений, e – основание натурального логарифма, ∆Еа – энергия активации, R - универсальная газовая постоянная, Т – температура.
