
- •12. Азот и фосфор
- •5.1. Общая характеристика. Нахождение в природе. Получение
- •5.2. Простые вещества
- •5.2.1. Структура и физические свойства
- •5.2.2. Химические свойства
- •5.3. Аммиак и соли аммония
- •5.3.1. Получение аммиака
- •5.3.2. Физические и химические свойства
- •5.3.3. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •5.4.3. Нитраты и нитриты
- •5.5. Кислородосодержащие соединения фосфора
- •5.6. Минеральные удобрения
- •14. Общая характеристика. Степени окисления
- •7.3.2. Природные соединения алюминия
- •7.3.3. Физические свойства
- •7.3.4. Химические свойства
- •7.3.5. Оксиды и соли p-элементов
- •7.3.6. Производство алюминия
- •16. Углерод и кремний
- •6.1. Общая характеристика. Нахождение в природе. Получение
- •6.2. Структура и физические свойства простых веществ
- •17. Константа равновесия
- •2.3.2. Сдвиг равновесия
- •19. Строение атома и химическая связь
- •3.1. Электронное строение атома
- •3.1.1. Современная модель атома
- •20. Общая характеристика
- •Получение и свойства s-металлов
- •7.2.4. Сложные вещества s-элементов. Производство соды
- •2.1.1. Термохимия
- •2.1.2. Энтропия. Энергия гиббса
- •2.1.3. Формула гиббса. Разрешенность процессов с позиции термодинамики
- •22. Метан
- •6.5. Кислородосодержащие соединения углерода
- •6.5.1. Общая характеристика и свойства
- •6.6.3. Цемент
- •25. Ионное произведение воды. Водородный показатель. Индикаторы
- •4.2.4. Буферные растворы
- •3.2. Получение простых веществ.
- •3.3. Физические свойства г2
- •27. Кислородосодержащие соединения хлора
- •Взаимодействие г2 с водородом. Получение hCl и ее свойства. Галогеноводородные кислоты
- •32. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •2.1. Распространенность водорода
- •2.2. Сходство водорода с другими элементами
- •2.2.1. Сходство с галогенами
- •2.2.2. Сходство со щелочными металлами
- •40. Особенности водорода
- •2.2.2. Кинетическое уравнение
- •2.2.3. Механизм химических реакций
- •2.2.4. Влияние температуры на скорость
- •2.2.5. Катализ
2.2.1. Сходство с галогенами
(1)
Роднит водород
с Г (и одновременно резко отличает его
от ЩМ) сравнительно
высокая
электроотрицательность
Н.
(Сравним, у лития ЭО равна 1, в то время
как у водорода – 2,1, а у иода – 2,5.) В
результате чего атомы Н друг с другом
образуют не металлическую связь, как
ЩМ, а ковалентную.
А т.к. она направлена
и
насыщаема, то
при одном неспаренном электроне могут
сформироваться лишь двухатомные
молекулы
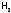 ,
как и в случае галогенов (
,
как и в случае галогенов (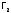 ).
).
(2) И
водород, и галогены, стремясь завершить
валентные уровни своих атомов, проявляют
окислительные
свойства. Однако Н из-за малого Z
ядра имеет меньшее сродство к электрону,
чем даже иод. Поэтому
 как окислитель слабее, чем
как окислитель слабее, чем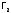 .
(Сравним:
.
(Сравним: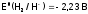 ,
а даже у иода
,
а даже у иода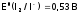 .)
Как следствие, водород реагирует лишь
с достаточносильными
восстановителями; такими, как, например,
ЩМ и щелочно-земельные металлы (ЩЗМ):
.)
Как следствие, водород реагирует лишь
с достаточносильными
восстановителями; такими, как, например,
ЩМ и щелочно-земельные металлы (ЩЗМ):
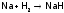 ,
,
 .
.
(3) Продукты
данных реакций (они называются гидридами)
– твердые вещества, имеющие ионную
решетку,
как и галиды (в частности, хлориды NaCl
или
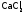 ).
Но гидриды (в отличие от галидов)очень
сильные
восстановители. Поскольку Н–
слишком слабо удерживает электрон
(из-за сравнительно малого сродства к
нему атома водорода). Вследствие этого
гидриды (но не галиды) при обычных
условиях окисляются даже водородом
воды:
).
Но гидриды (в отличие от галидов)очень
сильные
восстановители. Поскольку Н–
слишком слабо удерживает электрон
(из-за сравнительно малого сродства к
нему атома водорода). Вследствие этого
гидриды (но не галиды) при обычных
условиях окисляются даже водородом
воды:
 .
.
Эту
реакцию используют для получения
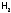 (например, в полевых условиях). А также
для осушки газов (т.е. очистки их от
влаги), для чего газы пропускают через
трубку с гранулами (мелкими кусочками)
гидрида кальция.
(например, в полевых условиях). А также
для осушки газов (т.е. очистки их от
влаги), для чего газы пропускают через
трубку с гранулами (мелкими кусочками)
гидрида кальция.
2.2.2. Сходство со щелочными металлами
(1) Водород и щелочные металлы имеют одинаковые конфигурации внешнего электронного уровня (s1) и, как следствие, похожие оптические спектры.
(2) Со ЩМ
водород объединяет способность отдавать
электроны и, значит, восстанавливать
другие элементы. Однако, из-за малого
радиуса атома Н (и, как следствие, высокой
энергии его ионизации)
 как восстановительгораздо
слабее,
чем ЩМ (сравним:
как восстановительгораздо
слабее,
чем ЩМ (сравним:
 ,
a, например, Е0
(Na+/
Na)=
–2,71 В).
,
a, например, Е0
(Na+/
Na)=
–2,71 В).
Поэтому
реагируют с
 лишьдостаточно
сильные окислители (из простых веществ
это Г2,
О2,
N2
и S).
лишьдостаточно
сильные окислители (из простых веществ
это Г2,
О2,
N2
и S).
Имея дело
с водородом на практике, следует помнить,
что смесь его с О2,
содержащая от 7 до 67% (об.)
 ,взрывоопасна
(причем взрыв может произойти от искры
или при контакте с нагретым предметом).
В то же время струя чистого водорода
спокойно
горит в кислороде. (Продукт и взрыва, и
горения одинаков – вода.)
,взрывоопасна
(причем взрыв может произойти от искры
или при контакте с нагретым предметом).
В то же время струя чистого водорода
спокойно
горит в кислороде. (Продукт и взрыва, и
горения одинаков – вода.)
При горении
скорость реакции сравнительно
небольшая и определяется быстротой
смешивания
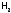 и
и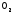 наповерхности
водородной струи. А в смеси
наповерхности
водородной струи. А в смеси
 и
и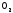 молекулыуже
максимально
перемешаны, поэтому скорость процесса
многократно
выше.
молекулыуже
максимально
перемешаны, поэтому скорость процесса
многократно
выше.
Отметим, что реакции синтеза хлороводорода и аммиака:
 ,
,
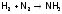
имеют промышленное значение.
Благодаря восстановительным свойствам, водород (как и ЩМ) вытесняет металлы из их оксидов. Это используется в металлургии, например, при получении железа (из руды):
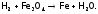
(3) Сходство водорода и ЩМ проявляется также в том, что в водном растворе продукты их окисления присутствуют в виде однозарядных гидратированных катионов (в отличие от галогенов).
39.
Энтропи́я (от греч. ἐντροπία — поворот,
превращение) в естественных науках —
мера беспорядка системы, состоящей из
многих элементов.
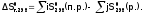 2
закон реакции могут самопроизвольно
идти только с потерей энергии.
2
закон реакции могут самопроизвольно
идти только с потерей энергии.
