
- •12. Азот и фосфор
- •5.1. Общая характеристика. Нахождение в природе. Получение
- •5.2. Простые вещества
- •5.2.1. Структура и физические свойства
- •5.2.2. Химические свойства
- •5.3. Аммиак и соли аммония
- •5.3.1. Получение аммиака
- •5.3.2. Физические и химические свойства
- •5.3.3. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •5.4.3. Нитраты и нитриты
- •5.5. Кислородосодержащие соединения фосфора
- •5.6. Минеральные удобрения
- •14. Общая характеристика. Степени окисления
- •7.3.2. Природные соединения алюминия
- •7.3.3. Физические свойства
- •7.3.4. Химические свойства
- •7.3.5. Оксиды и соли p-элементов
- •7.3.6. Производство алюминия
- •16. Углерод и кремний
- •6.1. Общая характеристика. Нахождение в природе. Получение
- •6.2. Структура и физические свойства простых веществ
- •17. Константа равновесия
- •2.3.2. Сдвиг равновесия
- •19. Строение атома и химическая связь
- •3.1. Электронное строение атома
- •3.1.1. Современная модель атома
- •20. Общая характеристика
- •Получение и свойства s-металлов
- •7.2.4. Сложные вещества s-элементов. Производство соды
- •2.1.1. Термохимия
- •2.1.2. Энтропия. Энергия гиббса
- •2.1.3. Формула гиббса. Разрешенность процессов с позиции термодинамики
- •22. Метан
- •6.5. Кислородосодержащие соединения углерода
- •6.5.1. Общая характеристика и свойства
- •6.6.3. Цемент
- •25. Ионное произведение воды. Водородный показатель. Индикаторы
- •4.2.4. Буферные растворы
- •3.2. Получение простых веществ.
- •3.3. Физические свойства г2
- •27. Кислородосодержащие соединения хлора
- •Взаимодействие г2 с водородом. Получение hCl и ее свойства. Галогеноводородные кислоты
- •32. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •2.1. Распространенность водорода
- •2.2. Сходство водорода с другими элементами
- •2.2.1. Сходство с галогенами
- •2.2.2. Сходство со щелочными металлами
- •40. Особенности водорода
- •2.2.2. Кинетическое уравнение
- •2.2.3. Механизм химических реакций
- •2.2.4. Влияние температуры на скорость
- •2.2.5. Катализ
5.4.2. Свойства и применение
Азотная кислота по сравнению с азотистой, во-первых, сильнее, а во-вторых, более устойчива – даже выделена в свободном состоянии (это бесцветная жидкость с т. кип. 86°С). Однако она (и в виде водного раствора) разлагается при об.у. (хотя и медленно) на NO2, О2 и H2O.
Продукты взаимодействия HNO3 с металлами зависят как от концентрации кислоты, так и от активности М. Например, цинк восстанавливает разбавленную азотную кислоту до ионов аммония, концентрированную – до оксида азота (I), в то время как медь – лишь до оксида азота (II) и оксида азота (IV) соответственно.
Концентрированная азотная кислота, благодаря образованию при ее разложении атомарного кислорода, растворяет даже серебро (но не Au, Pt и т.п.), хотя пассивирует железо, алюминий и хром.
Кроме
того, конц. HNO3
легко окисляет
простые вещества многих неметаллов:
графит до
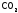 ,
фосфор до
,
фосфор до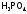 ,
серу до
,
серу до ,
иод до
,
иод до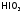 и др., восстанавливаясь при этом, как
правило, до оксида азота (II). Реагирует
она и сорганическими
веществами – основные продукты их
полного окисления: СО2
и Н2О.
и др., восстанавливаясь при этом, как
правило, до оксида азота (II). Реагирует
она и сорганическими
веществами – основные продукты их
полного окисления: СО2
и Н2О.
Очень концентрированная азотная кислота легко воспламеняет опилки и другие горючие материалы, поэтому используется как окислитель ракетного топлива.
Кроме того, азотная кислота применяется для приготовления лекарств, пластмасс, красителей, искусственных волокон и т.п., а также взрывчатых веществ (например, нитроглицерина, который является основой динамита).
Представляет собой жидкость жёлтого цвета, пахнущую хлором и оксидами азота. Сильнейший окислитель, благодаря хлористому нитрозилу (), распадающемуся с выделением хлора:
![]()
![]()
За счёт выделения атомарного хлора растворяет большинство металлов, в том числе золото, поэтому и названа алхимиками царской водкой, так как золото считалось «царём металлов». Не растворяет тантал (Ta), титан (Ti). Рутений (Ru) растворяется в царской водке только в присутствии кислорода воздуха, образуя комплексное соединение — гексахлоро-рутениевую кислоту[1]. Родий (Rh) и иридий (Ir) в компактном состоянии не реагируют с кислотами, в том числе и с царской водкой. В виде тонких порошков (чернь) эти металлы реагируют с царской водкой.
38. Водород
2.1. Распространенность водорода
Водород (Н) – первый элемент Периодической таблицы, т.е. электронная конфигурация Н – 1s1, а его ядро – это лишь один протон. Вследствие своей простоты водород является самым распространенным элементом Космоса (составляет 90% вещества Вселенной). Это и звезды, и межзвездная среда, и газовые туманности. Большинство звезд начинает свой жизненный путь в виде газового водородного шара. Проходят миллионы лет, и Н внутри звезды «выгорает», переходя в другие более сложные элементы. За счет этого светит и Солнце, 70% массы которого составляет водород. (Солнцу светить, по расчетам ученых, еще 30 млрд. лет.)
На Земле водород по распространенности занимает четвертое место. Его кларк (т.е. молярная доля среди других элементов в природе) равен 3%. Причем формы нахождения Н на Земле – это, в основном, вода и органические соединения.
2.2. Сходство водорода с другими элементами
Вследствие того, что водород имеет один валентный электрон, его можно отнести к IА подгруппе Периодической таблицы, т.е. к щелочным металлам (ЩМ).
С другой стороны, поскольку на первом уровне атома может находиться два е, то частице Н до завершения уровня не хватает одного электрона, что делает водород похожим на галогены (Г), относящиеся к VIIА подгруппе.
Кроме того, Н обнаруживает сходство с углеродом (из IVА подгруппы), в частности, близки значения их электроотрицательностей: 2,1 у Н и 2,5 у C (по шкале Поллинга). Причем эти ЭО имеют среднюю величину. Как следствие, водород и углерод одинаково склонны к образованию ковалентных связей. (Именно поэтому они вместе дают многочисленные органические соединения.)
Таким образом, видимо, имеет смысл поместить Н в одну длинную клетку, расположенную над всеми подгруппами с IА по VIIА.
Рассмотрим подробнее, в чем проявляется сходство водорода с Г и ЩМ.
