
- •12. Азот и фосфор
- •5.1. Общая характеристика. Нахождение в природе. Получение
- •5.2. Простые вещества
- •5.2.1. Структура и физические свойства
- •5.2.2. Химические свойства
- •5.3. Аммиак и соли аммония
- •5.3.1. Получение аммиака
- •5.3.2. Физические и химические свойства
- •5.3.3. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •5.4.3. Нитраты и нитриты
- •5.5. Кислородосодержащие соединения фосфора
- •5.6. Минеральные удобрения
- •14. Общая характеристика. Степени окисления
- •7.3.2. Природные соединения алюминия
- •7.3.3. Физические свойства
- •7.3.4. Химические свойства
- •7.3.5. Оксиды и соли p-элементов
- •7.3.6. Производство алюминия
- •16. Углерод и кремний
- •6.1. Общая характеристика. Нахождение в природе. Получение
- •6.2. Структура и физические свойства простых веществ
- •17. Константа равновесия
- •2.3.2. Сдвиг равновесия
- •19. Строение атома и химическая связь
- •3.1. Электронное строение атома
- •3.1.1. Современная модель атома
- •20. Общая характеристика
- •Получение и свойства s-металлов
- •7.2.4. Сложные вещества s-элементов. Производство соды
- •2.1.1. Термохимия
- •2.1.2. Энтропия. Энергия гиббса
- •2.1.3. Формула гиббса. Разрешенность процессов с позиции термодинамики
- •22. Метан
- •6.5. Кислородосодержащие соединения углерода
- •6.5.1. Общая характеристика и свойства
- •6.6.3. Цемент
- •25. Ионное произведение воды. Водородный показатель. Индикаторы
- •4.2.4. Буферные растворы
- •3.2. Получение простых веществ.
- •3.3. Физические свойства г2
- •27. Кислородосодержащие соединения хлора
- •Взаимодействие г2 с водородом. Получение hCl и ее свойства. Галогеноводородные кислоты
- •32. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •2.1. Распространенность водорода
- •2.2. Сходство водорода с другими элементами
- •2.2.1. Сходство с галогенами
- •2.2.2. Сходство со щелочными металлами
- •40. Особенности водорода
- •2.2.2. Кинетическое уравнение
- •2.2.3. Механизм химических реакций
- •2.2.4. Влияние температуры на скорость
- •2.2.5. Катализ
32. Соли аммония
При добавлении кислоты равновесие смещается вправо как результат связывания ОН–-ионов в Н2О, т.е. идет обычная реакция нейтрализации:
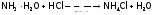 .
.
При
этом образуется соль
NH4Cl,
которая называется нашатырем или
хлоридом аммония.
Все соли, содержащие катионы
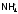 ,
стали называть солями аммония.
,
стали называть солями аммония.
Подчеркнем,
что донорные свойства аммиака из-за
наличия НЭП столь сильны, а следовательно,
ХС азота с 4-м Н+
столь прочна, что
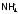 сохраняет своюцелостность
при реакциях обмена солей аммония с
другими солями или с кислотами:
сохраняет своюцелостность
при реакциях обмена солей аммония с
другими солями или с кислотами:
 ,
,
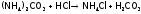 .
.
То
есть в этих реакциях
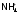 подобенобычному
катиону, например, K+.
Но поскольку соли аммония соответствуют
слабому основанию, то в водных растворах
идет гидролиз
этих солей по катиону
и
подобенобычному
катиону, например, K+.
Но поскольку соли аммония соответствуют
слабому основанию, то в водных растворах
идет гидролиз
этих солей по катиону
и
 разрушается.
Даже сухие соли аммония гидролизуются
под действием влаги воздуха. Например:
разрушается.
Даже сухие соли аммония гидролизуются
под действием влаги воздуха. Например:
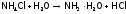 .
.
Образующийся при этом гидрат аммиака легко отщепляет NH3. (Поэтому им пахнут все соли аммония.)
Гидролиз
резко усиливается при добавлении щелочи,
т.к. ионы ОН–,
связывая протоны в молекулы очень
слабого электролита Н2О,
переводят
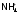 в гидрат аммиака практически полностью:
в гидрат аммиака практически полностью:
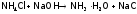 .
.
(Данная
реакция является качественной
на ионы аммония
– их присутствие легко устанавливается
по запаху, характерному для аммиака).
Разрушается
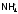 также принагревании
раствора, например, нашатыря, а тем более
сухой соли:
также принагревании
раствора, например, нашатыря, а тем более
сухой соли:
 .
.
При этом разрываются химические связи (между NH3 и H+), поэтому процесс называется химической возгонкой (в отличие от физической возгонки, например, I2, идущей без разрушения ХС). Если получающиеся газы (NH3 и HCl) по газоотводной трубке направить в другой (не нагреваемый) сосуд, то, охлаждаясь в нем, они снова образуют соль NH4Cl.
Возгонка солей аммония используется для отделения их от нелетучих веществ (в частности, NaCl). Кроме того, способность нашатыря разлагаться помогает, например, очищать поверхность медного паяльника от оксида меди. А именно: хлороводород (он образуется из хлорида аммония на горячем паяльнике) реагирует с оксидом меди:
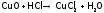 ,
,
а NH3 восстанавливает медь в CuCl2 до Cu0 (другие продукты: N2 и HCl).
5.4. Оксиды и гидроксиды азота. Соли
5.4.1. Получение оксидов и кислот
При нагревании аммиак горит в кислороде (зеленым пламенем) с образованием N2 и воды. По этой реакции при формировании земной атмосферы весь NH3, который был когда-то ее основным компонентом, окислился до азота (кислородом, выделявшимся из раскаленных недр Земли).
Однако если процесс проводить в присутствии катализатора (Pt), то окисление аммиака идет до NO. Это используется в производстве азотной кислоты. Образующийся оксид NO (бесцветный газ) затем легко (при об.у.) окисляется кислородом воздуха до NO2 (бурый газ). А диоксид азота реагирует с водой, насыщенной кислородом под давлением 5 МПа, давая 65%-ый раствор HNO3. (Примерно 1/3 промышленного аммиака идет на производство азотной кислоты, ее солей и др.)
Отметим, что прямое окисление N2 кислородом до NO требует или сильного нагрева или применения электрической дуги, что тоже очень дорого. В атмосфере данная реакция осуществляется под действием разрядов (их на Земле ежесекундно происходит около 100). Эти разряды наряду с азобактериями обеспечивают круговорот N в природе (рисунок 5).

36. Чистую азотную кислоту можно синтезировать гидратацией N2O5 (твердого вещества), поскольку в нем ст.ок. N та же, что и в азотной кислоте. Но это дорогой способ, т.к. сам оксид азота (V) получают, действуя на NO2 очень сильным, а значит, недешевым окислителем (например, озоном). К тому же, N2O5 легко при об.у. отщепляет кислород, переходя снова в устойчивый диоксид.
Характеристики 3-х наиболее стабильных оксидов азота даны в таблице 4.
Характеристики наиболее устойчивых оксидов азота Таблица 4
Оксид
Графическая формула
Характеристика оксида
как окислителя
как восстановителя
N2O36
сильный (до N2)
очень слабый (до NO)
NO
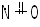
слабый (до N2)
средний (до NOCl)
NO2
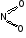
средний (до N2)
слабый (до NO2F)
Раньше HNO3 получали в промышленности, действуя концентрированной серной кислотой на природную селитру (воздушно-сухую):
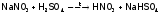 .
.
Однако синтез азотной кислоты из аммиака настолько ее удешевил, что, напротив, стали применять HNO3 в производстве ее солей.
В лаборатории используют готовую (товарную) азотную кислоту или получают реакцией серной кислоты с нитратом бария.
