
- •12. Азот и фосфор
- •5.1. Общая характеристика. Нахождение в природе. Получение
- •5.2. Простые вещества
- •5.2.1. Структура и физические свойства
- •5.2.2. Химические свойства
- •5.3. Аммиак и соли аммония
- •5.3.1. Получение аммиака
- •5.3.2. Физические и химические свойства
- •5.3.3. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •5.4.3. Нитраты и нитриты
- •5.5. Кислородосодержащие соединения фосфора
- •5.6. Минеральные удобрения
- •14. Общая характеристика. Степени окисления
- •7.3.2. Природные соединения алюминия
- •7.3.3. Физические свойства
- •7.3.4. Химические свойства
- •7.3.5. Оксиды и соли p-элементов
- •7.3.6. Производство алюминия
- •16. Углерод и кремний
- •6.1. Общая характеристика. Нахождение в природе. Получение
- •6.2. Структура и физические свойства простых веществ
- •17. Константа равновесия
- •2.3.2. Сдвиг равновесия
- •19. Строение атома и химическая связь
- •3.1. Электронное строение атома
- •3.1.1. Современная модель атома
- •20. Общая характеристика
- •Получение и свойства s-металлов
- •7.2.4. Сложные вещества s-элементов. Производство соды
- •2.1.1. Термохимия
- •2.1.2. Энтропия. Энергия гиббса
- •2.1.3. Формула гиббса. Разрешенность процессов с позиции термодинамики
- •22. Метан
- •6.5. Кислородосодержащие соединения углерода
- •6.5.1. Общая характеристика и свойства
- •6.6.3. Цемент
- •25. Ионное произведение воды. Водородный показатель. Индикаторы
- •4.2.4. Буферные растворы
- •3.2. Получение простых веществ.
- •3.3. Физические свойства г2
- •27. Кислородосодержащие соединения хлора
- •Взаимодействие г2 с водородом. Получение hCl и ее свойства. Галогеноводородные кислоты
- •32. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •2.1. Распространенность водорода
- •2.2. Сходство водорода с другими элементами
- •2.2.1. Сходство с галогенами
- •2.2.2. Сходство со щелочными металлами
- •40. Особенности водорода
- •2.2.2. Кинетическое уравнение
- •2.2.3. Механизм химических реакций
- •2.2.4. Влияние температуры на скорость
- •2.2.5. Катализ
7.3.5. Оксиды и соли p-элементов
Как следствие особой устойчивости алюминия в ст.ок. +3, во-первых, он образует сложные вещества практически всегда только в этой ст.ок., например, Al2O3; а во-вторых, соединения Al(III) обладают крайне слабые окислительными свойствами. Так, Al2O3 проявляет их лишь под действием электротока.
В отличие от Al, олово способно давать два оксида (SnO и SnO2), а свинец – четыре: желтый PbO, коричневый PbO2, оранжевый Pb2O3 и т.н. сурик Pb3O4 (красного цвета), последние два по сути являются солями. Благодаря яркой окрашенности оксиды Pb используют для приготовления красок.
Раньше основой красок были свинцовые белила (PbOH)2CO3. Поэтому старинные картины со временем темнеют под действием сероводорода (являющегося примесью в воздухе) из-за перехода белил в черное вещество PbS. Однако, обрабатывая сульфид свинца раствором пероксида водорода, его можно окислить до PbSO4 белого цвета. Такую обработку проводят для осветления старинных картин и икон при их реставрации, после чего они становятся как новые.
Благодаря неустойчивости свинца в ст.ок. +4 (вследствие f-сжатия) Pb3O4 и PbO2 применяются в качестве очень сильных окислителей: сурик – в производстве спичек (входит в состав и головки, и намазки), а PbO2 – в свинцовых аккумуляторах. В этих аккумуляторах чередуются пластины из свинца и из диоксида свинца, причем они погружены в 40%-ую серную кислоту. Если соединить пластины между собой проводником, то по нему пойдет электроток. Ток возникает как результат того, что PbO2 «отнимает» (через проводник) электроны у Pb, т.е. на пластинах осуществляются реакции:
 ,
,
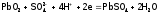 .
.
При зарядке аккумулятора (от внешнего источника тока, чаще от электросети) идут обратные процессы, и восстанавливается способность аккумулятора давать ток.
Как уже говорилось выше, если свинец стремится перейти из ст.ок. +4 в +2, то Sn наоборот. Поэтому соединения олова (II) являются сильными восстановителями. И в этом качестве они широко используются на практике. В частности, для выделения золота и серебра из растворов, например:
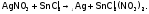
В щелочной среде восстанавливаются и более активные М, такие, как висмут:

Данная реакция сопровождается внешним эффектом – выпадением черного порошка металла Bi, поэтому она может служить качественной реакцией и на олово (II), и на висмут (III).
Из соединений Sn(IV) применяют на практике кристаллический сульфид SnS2. Его блестящие золотистые чешуйки выглядят внешне как золото и химически почти также устойчивы (не растворяются даже в азотной кислоте). Поэтому используются для позолоты дерева и других материалов (под названием «сусальное золото»).
Из алюминийсодержащих веществ издревле применяются (в медицине и при крашении тканей) квасцы или по-латински «алюмен» (отсюда название Al). Их общая формула MAl(SO4)2.12H2O, где М – однозарядные катионы ЩМ. Из-за гидролиза по Al3+ растворы этих соединений имеют кислую среду (отсюда их название «квасцы», что означает «кислые»).
В твердом виде квасцы представляют собой прозрачные октаэдрические кристаллы. Если их осаждать, например, на шерстяную нитку при медленном испарении насыщенного раствора, то кристаллы получаются крупными и настолько красивыми, что могут служить елочными украшениями.
