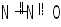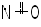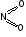- •12. Азот и фосфор
- •5.1. Общая характеристика. Нахождение в природе. Получение
- •5.2. Простые вещества
- •5.2.1. Структура и физические свойства
- •5.2.2. Химические свойства
- •5.3. Аммиак и соли аммония
- •5.3.1. Получение аммиака
- •5.3.2. Физические и химические свойства
- •5.3.3. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •5.4.3. Нитраты и нитриты
- •5.5. Кислородосодержащие соединения фосфора
- •5.6. Минеральные удобрения
- •14. Общая характеристика. Степени окисления
- •7.3.2. Природные соединения алюминия
- •7.3.3. Физические свойства
- •7.3.4. Химические свойства
- •7.3.5. Оксиды и соли p-элементов
- •7.3.6. Производство алюминия
- •16. Углерод и кремний
- •6.1. Общая характеристика. Нахождение в природе. Получение
- •6.2. Структура и физические свойства простых веществ
- •17. Константа равновесия
- •2.3.2. Сдвиг равновесия
- •19. Строение атома и химическая связь
- •3.1. Электронное строение атома
- •3.1.1. Современная модель атома
- •20. Общая характеристика
- •Получение и свойства s-металлов
- •7.2.4. Сложные вещества s-элементов. Производство соды
- •2.1.1. Термохимия
- •2.1.2. Энтропия. Энергия гиббса
- •2.1.3. Формула гиббса. Разрешенность процессов с позиции термодинамики
- •22. Метан
- •6.5. Кислородосодержащие соединения углерода
- •6.5.1. Общая характеристика и свойства
- •6.6.3. Цемент
- •25. Ионное произведение воды. Водородный показатель. Индикаторы
- •4.2.4. Буферные растворы
- •3.2. Получение простых веществ.
- •3.3. Физические свойства г2
- •27. Кислородосодержащие соединения хлора
- •Взаимодействие г2 с водородом. Получение hCl и ее свойства. Галогеноводородные кислоты
- •32. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •2.1. Распространенность водорода
- •2.2. Сходство водорода с другими элементами
- •2.2.1. Сходство с галогенами
- •2.2.2. Сходство со щелочными металлами
- •40. Особенности водорода
- •2.2.2. Кинетическое уравнение
- •2.2.3. Механизм химических реакций
- •2.2.4. Влияние температуры на скорость
- •2.2.5. Катализ
5.4. Оксиды и гидроксиды азота. Соли
5.4.1. Получение оксидов и кислот
При нагревании аммиак горит в кислороде (зеленым пламенем) с образованием N2 и воды. По этой реакции при формировании земной атмосферы весь NH3, который был когда-то ее основным компонентом, окислился до азота (кислородом, выделявшимся из раскаленных недр Земли).
Однако если процесс проводить в присутствии катализатора (Pt), то окисление аммиака идет до NO. Это используется в производстве азотной кислоты. Образующийся оксид NO (бесцветный газ) затем легко (при об.у.) окисляется кислородом воздуха до NO2 (бурый газ). А диоксид азота реагирует с водой, насыщенной кислородом под давлением 5 МПа, давая 65%-ый раствор HNO3. (Примерно 1/3 промышленного аммиака идет на производство азотной кислоты, ее солей и др.)
Отметим, что прямое окисление N2 кислородом до NO требует или сильного нагрева или применения электрической дуги, что тоже очень дорого. В атмосфере данная реакция осуществляется под действием разрядов (их на Земле ежесекундно происходит около 100). Эти разряды наряду с азобактериями обеспечивают круговорот N в природе (рисунок 5).

Рис. 5. Круговорот азота в природе
Подчеркнем, что диоксид азота, реагируя с водой без кислорода, дисмутирует с образованием смеси азотной и азотистой кислот.
Чистую азотистую кислоту получают гидратацией N2O3, который соответствует этой кислоте по ст.ок. N. Данный оксид образуется охлаждением равномолярной смеси NO и NO2. (Но уже при об.у. N2O3 распадается на исходные оксиды.)
Чистую азотную кислоту можно синтезировать гидратацией N2O5 (твердого вещества), поскольку в нем ст.ок. N та же, что и в азотной кислоте. Но это дорогой способ, т.к. сам оксид азота (V) получают, действуя на NO2 очень сильным, а значит, недешевым окислителем (например, озоном). К тому же, N2O5 легко при об.у. отщепляет кислород, переходя снова в устойчивый диоксид.
Характеристики 3-х наиболее стабильных оксидов азота даны в таблице 4.
Характеристики наиболее устойчивых оксидов азота Таблица 4
|
Оксид |
Графическая формула |
Характеристика оксида | |
|
как окислителя |
как восстановителя | ||
|
N2O4 |
|
сильный (до N2) |
очень слабый (до NO) |
|
NO |
|
слабый (до N2) |
средний (до NOCl) |
|
NO2 |
|
средний (до N2) |
слабый (до NO2F) |
Раньше HNO3 получали в промышленности, действуя концентрированной серной кислотой на природную селитру (воздушно-сухую):
 .
.
Однако синтез азотной кислоты из аммиака настолько ее удешевил, что, напротив, стали применять HNO3 в производстве ее солей.
В лаборатории используют готовую (товарную) азотную кислоту или получают реакцией серной кислоты с нитратом бария.
5.4.2. Свойства и применение
Азотная кислота по сравнению с азотистой, во-первых, сильнее, а во-вторых, более устойчива – даже выделена в свободном состоянии (это бесцветная жидкость с т. кип. 86°С). Однако она (и в виде водного раствора) разлагается при об.у. (хотя и медленно) на NO2, О2 и H2O.
Продукты взаимодействия HNO3 с металлами зависят как от концентрации кислоты, так и от активности М. Например, цинк восстанавливает разбавленную азотную кислоту до ионов аммония, концентрированную – до оксида азота (I), в то время как медь – лишь до оксида азота (II) и оксида азота (IV) соответственно.
Концентрированная азотная кислота, благодаря образованию при ее разложении атомарного кислорода, растворяет даже серебро (но не Au, Pt и т.п.), хотя пассивирует железо, алюминий и хром.
Кроме
того, конц. HNO3
легко окисляет
простые вещества многих неметаллов:
графит до
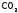 ,
фосфор до
,
фосфор до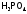 ,
серу до
,
серу до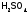 ,
иод до
,
иод до и др., восстанавливаясь при этом, как
правило, до оксида азота (II). Реагирует
она и сорганическими
веществами – основные продукты их
полного окисления: СО2
и Н2О.
и др., восстанавливаясь при этом, как
правило, до оксида азота (II). Реагирует
она и сорганическими
веществами – основные продукты их
полного окисления: СО2
и Н2О.
Очень концентрированная азотная кислота легко воспламеняет опилки и другие горючие материалы, поэтому используется как окислитель ракетного топлива.
Кроме того, азотная кислота применяется для приготовления лекарств, пластмасс, красителей, искусственных волокон и т.п., а также взрывчатых веществ (например, нитроглицерина, который является основой динамита).