
- •12. Азот и фосфор
- •5.1. Общая характеристика. Нахождение в природе. Получение
- •5.2. Простые вещества
- •5.2.1. Структура и физические свойства
- •5.2.2. Химические свойства
- •5.3. Аммиак и соли аммония
- •5.3.1. Получение аммиака
- •5.3.2. Физические и химические свойства
- •5.3.3. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •5.4.3. Нитраты и нитриты
- •5.5. Кислородосодержащие соединения фосфора
- •5.6. Минеральные удобрения
- •14. Общая характеристика. Степени окисления
- •7.3.2. Природные соединения алюминия
- •7.3.3. Физические свойства
- •7.3.4. Химические свойства
- •7.3.5. Оксиды и соли p-элементов
- •7.3.6. Производство алюминия
- •16. Углерод и кремний
- •6.1. Общая характеристика. Нахождение в природе. Получение
- •6.2. Структура и физические свойства простых веществ
- •17. Константа равновесия
- •2.3.2. Сдвиг равновесия
- •19. Строение атома и химическая связь
- •3.1. Электронное строение атома
- •3.1.1. Современная модель атома
- •20. Общая характеристика
- •Получение и свойства s-металлов
- •7.2.4. Сложные вещества s-элементов. Производство соды
- •2.1.1. Термохимия
- •2.1.2. Энтропия. Энергия гиббса
- •2.1.3. Формула гиббса. Разрешенность процессов с позиции термодинамики
- •22. Метан
- •6.5. Кислородосодержащие соединения углерода
- •6.5.1. Общая характеристика и свойства
- •6.6.3. Цемент
- •25. Ионное произведение воды. Водородный показатель. Индикаторы
- •4.2.4. Буферные растворы
- •3.2. Получение простых веществ.
- •3.3. Физические свойства г2
- •27. Кислородосодержащие соединения хлора
- •Взаимодействие г2 с водородом. Получение hCl и ее свойства. Галогеноводородные кислоты
- •32. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •2.1. Распространенность водорода
- •2.2. Сходство водорода с другими элементами
- •2.2.1. Сходство с галогенами
- •2.2.2. Сходство со щелочными металлами
- •40. Особенности водорода
- •2.2.2. Кинетическое уравнение
- •2.2.3. Механизм химических реакций
- •2.2.4. Влияние температуры на скорость
- •2.2.5. Катализ
22. Метан
Метан СН4 (бесцветный газ) можно синтезировать по реакции, используя кроме нагрева еще и катализатор (Ni):
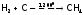 .
.
Однако на практике метан выделяют из природных газов (содержащих 60-90% СН4), что гораздо дешевле.
Природные газы – это, например, рудничные, а также болотные. (Они получаются при разложении останков растений и животных в отсутствии кислорода.) Входит СН4 и в состав коксового газа (образующегося при нагревании угля без доступа воздуха). Во многих странах действуют установки получения метана анаэробной тепловой (40-60°С) переработкой отходов животноводства. При этом одновременно гибнут болезнетворные микробы и исчезает неприятный запах навоза; таким образом, он превращается в безвредное и очень ценное удобрение для полей.
Молекула СН4 является тетраэдром (sp3-гибридизация орбиталей углерода), т.е. симметричной частицей, поэтому (несмотря на полярность связей) неполярной. Как следствие, метан имеет низкую температуру сжижения (–162°С), практически не растворяется в воде и при об.у. химически достаточно инертен – не взаимодействует с растворами кислот и щелочей.
Однако его смеси с воздухом взрывоопасны, что часто бывает причиной несчастных случаев на угольных шахтах. Используется метан, в основном, как топливо, а также для получения водорода реакцией с парами воды (второй продукт – СО).
6.5. Кислородосодержащие соединения углерода
6.5.1. Общая характеристика и свойства
Из множества кислородосодержащих соединений углерода мы рассмотрим лишь СО (угарный газ, т.е. оксид углерода(II)), СО2 (углекислый газ или оксид углерода(IV)), угольную кислоту и ее соли.
Молекулу
угарного газа С формирует в s2p2-состоянии.
При образовании же СО2
атом углерода возбуждается, приобретая
sp3-конфигурацию,
т.е. имеет 4 неспаренных электрона на
4-х орбиталях. Две из них (s- и px-)
дают две
 -связи
с двумя О, а две другие (py-
и рz-)
формируют два
-связи
с двумя О, а две другие (py-
и рz-)
формируют два
 -перекрывания
с р-орбиталями атомов кислорода. Но т.к.
гибридизации подвергаются лишь орбитали,
участвующие в
-перекрывания
с р-орбиталями атомов кислорода. Но т.к.
гибридизации подвергаются лишь орбитали,
участвующие в -связях,
то имеем sp-гибридизацию, а значит,
молекула СО2
линейна (рисунок 7) и потому (несмотря
на полярность ХС в данной частице) она
неполярна.
-связях,
то имеем sp-гибридизацию, а значит,
молекула СО2
линейна (рисунок 7) и потому (несмотря
на полярность ХС в данной частице) она
неполярна.
Тем не менее растворим в воде гораздо лучше углекислый газ (1 л в 1 л при 15°С), чем угарный (0,03 л в 1 л), хотя частица СО полярна. Бóльшая растворимость СО2 объясняется тем, что его молекулы (в отличие от СО) при обычных условиях химически соединяются с водой, образуя угольную кислоту (отсюда название СО2 – «углекислый газ»). Однако СО (в отличие от СО2) при нагревании реагирует с водой по типу ОВР, проявляя восстановительные свойства:
![]() .
.
Оксид углерода (II) восстанавливает также М из их оксидов (что используется в металлургии):
 .
.
Угольная кислота. Слабая двухосновная кислота с химической формулой H2CO3. В чистом виде неустойчива. Образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Карбонаты и их применение. Соли угольной кислоты гораздо устойчивее к отщеплению СО2, чем сама кислота, и все выделены в свободном состоянии. Из средних солей хорошо растворимы лишь карбонаты ЩМ. Причем не только карбонаты, но и гидрокарбонаты ЩМ, гидролизуясь по аниону, создавают щелочную среду. Благодаря, в частности, этому, соли натрия и калия, выпускаемые содовым производством, находят широкое применение.
Например, питьевая сода (NaHCO3) используется в медицине (от изжоги). В еще больших масштабах применяется поташ К2СО3 и особенно (как более дешевый продукт) кальцинированная сода Na2CO3 (получается кальцинацией, т.е. прокаливанием, NaHCO3): в качестве стиральных порошков, для изготовления стекла, мыла и др. Поэтому содовое производство – одно из крупнейших в химической промышленности.
На практике широко используются и малорастворимые природные карбонаты кальция: известняк (для получения СаО и СО2 и в качестве строительного камня), мрамор (как облицовочная плитка), мел (для побелки) и др.
24. Кремниевые кислоты — очень слабые, малорастворимые в воде кислоты. Известны соли метакремниевой кислоты Н2SiO3 (SiO2•H2О) — силикаты, ортокремниевой кислоты H4SiO4 (SiO2•2H2O) — ортосиликаты и других кислот с различным числом SiO2•nH2О. Гидраты кремнезема с содержанием более 2Н2О на каждую молекулу SiO2 в индивидуальном состоянии, по-видимому, не существуют, однако известны многие их соли. В воде кремниевые кислоты образуют коллоидные растворы. Соли кремниевых кислот применяют в производстве бумаги, в текстильной промышленности, для обработки воды, как связующие материалы. Гели кремниевых кислот (силикагели) используют как адсорбенты и как отбеливающие материалы. Соли кремниевых кислот называют силикатами (силикаты широко распространены в природе). Оксид. Гидроксид. Соли
В отличие
от газообразного
СО2
оксид кремния SiO2
– твердое
вещество (т.пл. выше 1700°С). Это объясняется
большим
(по сравнению с С) радиусом атома Si.
Вследствие чего, во-1-ых, его p-орбитали
не дают достаточно эффективного
 -перекрывания,
а во-2-ых, «любимое» координационное
число (к.ч.) кремния (т.е. число «соседей»)
равночетырем.
-перекрывания,
а во-2-ых, «любимое» координационное
число (к.ч.) кремния (т.е. число «соседей»)
равночетырем.
Поэтому
все 4 валентных электрона каждого атома
Si
участвуют в образовании четырех
 -связей
( при sp3-гибридизации
его орбиталей) с четырьмя
атомами кислорода и т.о. к.ч.(Si)
достигает
4. Это происходит благодаря обобществлению
О соседними «молекулами» SiO2,
в результате чего формируются полимеры.
Графическое изображение их фрагмента
выглядит так:
-связей
( при sp3-гибридизации
его орбиталей) с четырьмя
атомами кислорода и т.о. к.ч.(Si)
достигает
4. Это происходит благодаря обобществлению
О соседними «молекулами» SiO2,
в результате чего формируются полимеры.
Графическое изображение их фрагмента
выглядит так:

Из-за
стремления Si
к четырехкратной координации
свежеполученная растворимая
кремниевая кислота H2SiO3
(в молекуле которой к.ч.(Si)
всего лишь 3) тоже быстро полимеризуется.
И как следствие, выпадает в осадок
состава
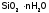 28(где n около 300). После его высушивания
при об.у. получаетсясиликагель
28(где n около 300). После его высушивания
при об.у. получаетсясиликагель
 .
Его можно обезводить (практически
полностью), нагревая при 150°С.Силикагель
очень инертен
(недаром песок – конечный продукт
выветривания29горных пород). Он растворяется лишь во
фтороводородной кислоте (из-за образованиялетучего
SiF4).
А также реагирует со щелочью при
сплавлении, давая т.н. «растворимое
стекло» Na2SiO3.
(Его водный раствор («жидкое
стекло») – это силикатный (канцелярский)
клей – очень щелочная среда).6.6.2.
Нерастворимые стекла
.
Его можно обезводить (практически
полностью), нагревая при 150°С.Силикагель
очень инертен
(недаром песок – конечный продукт
выветривания29горных пород). Он растворяется лишь во
фтороводородной кислоте (из-за образованиялетучего
SiF4).
А также реагирует со щелочью при
сплавлении, давая т.н. «растворимое
стекло» Na2SiO3.
(Его водный раствор («жидкое
стекло») – это силикатный (канцелярский)
клей – очень щелочная среда).6.6.2.
Нерастворимые стекла
Основа нерастворимых силикатных стекол – это тоже диоксид кремния. И сам SiO2, если он имеет аморфную (неупорядоченную) структур, является стеклом, его называют кварцевым. Оно и механически прочное, и не трескается от перепада температур (раскаленный самовар, сделанный из этого стекла, бросали в холодную воду, и он оставался целым).
Однако кварцевое стекло имеет высокую т.пл. (>1500°), поэтому трудно из него готовить изделия. Чтобы этой трудности избежать, SiO2 (песок) сплавляют (при 1400°С) с содой и известняком, получая обычное оконное стекло. Его примерный состав: Na2O.CaO.6SiO2, и такое стекло размягчается уже при 300°С.
Добавляя к нему окрашенные оксиды металлов (например, NiO зеленого цвета), создают цветные стекла; а вводя PbO – хрусталь. Небольшие количества селена или золота, равномерно распределенные в стекле, придают ему вид рубина.
При управляемой кристаллизации стекла образуется ситалл, который по прочности близок к чугуну, поэтому используется в строительстве вместо металла, керамики, бетона или дерева. Получено также пуленепробиваемое бронестекло (толщиной до 40 мм), оно состоит из нескольких слоев стекла, склеенных смолами.
Широко применяют и стеклянные волокна (в частности, оптические – в качестве световодов). В последнее время синтезированы светочувствительные стекла и стекла с саморегулирующейся светопроницаемостью (из них делают, например, светозащитные очки и глазные линзы); а также поглощающие радиацию и полупроводниковые стекла (с регулируемой проводимостью) и многие другие.
