
- •12. Азот и фосфор
- •5.1. Общая характеристика. Нахождение в природе. Получение
- •5.2. Простые вещества
- •5.2.1. Структура и физические свойства
- •5.2.2. Химические свойства
- •5.3. Аммиак и соли аммония
- •5.3.1. Получение аммиака
- •5.3.2. Физические и химические свойства
- •5.3.3. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •5.4.3. Нитраты и нитриты
- •5.5. Кислородосодержащие соединения фосфора
- •5.6. Минеральные удобрения
- •14. Общая характеристика. Степени окисления
- •7.3.2. Природные соединения алюминия
- •7.3.3. Физические свойства
- •7.3.4. Химические свойства
- •7.3.5. Оксиды и соли p-элементов
- •7.3.6. Производство алюминия
- •16. Углерод и кремний
- •6.1. Общая характеристика. Нахождение в природе. Получение
- •6.2. Структура и физические свойства простых веществ
- •17. Константа равновесия
- •2.3.2. Сдвиг равновесия
- •19. Строение атома и химическая связь
- •3.1. Электронное строение атома
- •3.1.1. Современная модель атома
- •20. Общая характеристика
- •Получение и свойства s-металлов
- •7.2.4. Сложные вещества s-элементов. Производство соды
- •2.1.1. Термохимия
- •2.1.2. Энтропия. Энергия гиббса
- •2.1.3. Формула гиббса. Разрешенность процессов с позиции термодинамики
- •22. Метан
- •6.5. Кислородосодержащие соединения углерода
- •6.5.1. Общая характеристика и свойства
- •6.6.3. Цемент
- •25. Ионное произведение воды. Водородный показатель. Индикаторы
- •4.2.4. Буферные растворы
- •3.2. Получение простых веществ.
- •3.3. Физические свойства г2
- •27. Кислородосодержащие соединения хлора
- •Взаимодействие г2 с водородом. Получение hCl и ее свойства. Галогеноводородные кислоты
- •32. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •2.1. Распространенность водорода
- •2.2. Сходство водорода с другими элементами
- •2.2.1. Сходство с галогенами
- •2.2.2. Сходство со щелочными металлами
- •40. Особенности водорода
- •2.2.2. Кинетическое уравнение
- •2.2.3. Механизм химических реакций
- •2.2.4. Влияние температуры на скорость
- •2.2.5. Катализ
Катализ (от греч. katálysis — разрушение), изменение скорости химических реакций в присутствии веществ (катализаторов),вступающих в промежуточное химическое взаимодействие с реагирующими веществами, но восстанавливающих после каждого цикла промежуточных взаимодействий свой химический состав. Реакции с участием катализаторов называются каталитическими.
Гомогенный катализ
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H2О2 + I → H2О + IO
H2О2 + IO → H2О + О2 + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
Гетерогенный катализ
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
Диффузия реагирующих веществ к поверхности твердого вещества
Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
Химическая реакция между реагирующими молекулами
Десорбция продуктов с поверхности катализатора
Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
Автокатализ — катализ химической реакции одним из её продуктов или исходных веществ. Одним из наиболее широко известных примеров автокатализа является окисление щавелевой кислоты перманганатом калия:
2MnO4− + 5C2O42− + 16H+ = 2Mn2+ + 10CO2 + 8H2O
Катализатором этой реакции являются ионы Mn2+. При комнатной температуре эта реакция вначале протекает медленно, но по мере накопления в растворе продукта-катализатора, она ускоряется.
Примеры каталитических реакций:
серная кислота получается из сернистого газа, воды и кислорода воздуха при помощи окислов азота:
2SO2 + N2O3 + О 2 + Н 2O = 2(SO3 H)(NO)O и
2(SO3 H)(NO)O + Н 2O = 2H2SO4 + N2O3
кислород образуется при действии хлора на едкую щелочь в присутствии окиси кобальта:
2NaHO + Cl2 + 2СOО = 2NaC + H 2O + CO2O3 и
СO 2O3 = 2СOО + О
2. Простые вещества- как металлы, так и неметаллы- вступают в реакцию с кислородом, в результате получаются оксиды, а реакции называются реакциями окисления. Реакции соединения кислорода и озона с простыми веществами называются реакциями окисления, а сами кислород и озон называются окислителями. В результате этого взаимодействия образуются оксиды При комнатной температуре обладает малой химической активностью из-за прочной двойной связи в молекулах. Сильный окислитель при нагревании, реагирует с большинством металлов и неметаллов Вызывает ржавление (медленное окисление) железа
O2 + 2Mg = 2MgO
O2 + S = SO2
Кислород проявляет только окислительные свойства, а сера – и окислительные, и восстановительные. С чем это связано? Оказывается, в реакциях с простыми веществами-металлами сера принимает электроны (S0 + 2e ), а в реакциях с активными неметаллами (О2, F2, Cl2, Br2) отдает свои электроны (S0 – 4e и S0 – 6e ).
Нахождение в природе
Кислород — самый распространённый на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47,4 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 % (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,12 % по массе. Более 1500 соединений земной коры в своём составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
Способы получения
Промышленный способ (перегонка жидкого воздуха).
Лабораторный способ (разложение некоторых кислородосодержащих веществ)
2KMnO4 –t°® K2MnO4 + MnO2 + O2
2KClO3 –t°;MnO2® 2KCl + 3O2
2H2O2 –MnO2® 2H2O + O2
Важнейшие природные соединения серы: FeS2 — железный колчедан или пирит, ZnS — цинковая обманка или сфалерит (вюрцит), PbS — свинцовый блеск или галенит, HgS — киноварь, Sb2S3 — антимонит. Кроме того, сера присутствует в нефти, природном угле, природных газах и сланцах. Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды. Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Получение
Промышленный метод - выплавление из руды с помощью водяного пара
Неполное окисление сероводорода (при недостатке кислорода).
2H2S + O2 ® 2S + 2H2O
Реакция Вакенродера
2H2S + SO2 ® 3S + 2H2O
Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами.
Аллотропия кислорода и серы.
У кислорода имеется две аллотропные модификации: кислородО2 и озон О3.Кислород превращается в озон при прохождении электрического разряда через него, например грозового разряда:
3О2 2О3
Озон более активный по сравнению с кислородом, за счёт нестойкости вещества и образовании при разложении атомарного кислорода
О3О2 +О
У серы можно выделить две разновидности: кристаллическую
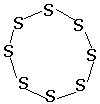
и пластическую
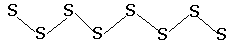
Переход из кристаллической в пластическую происходит при нагревании до температуры кипения при последующем быстром охлаждении. Причина аллотропии кислорода - разное число атомов Причина аллотропии серы заключается в разном строении кристаллов её модификаций. Причина кроется в различных способах соединения атомов между собой.
3. К комплексным относят вещества, имеющие в узлах кристаллической решетки агрегаты атомов (комплексы1), способные к самостоятельному существованию в растворе. То есть диссоциирующие по типу слабых электролитов. Комплекс состоит из центрального атома (ц.а.), являющегося комплексообразователем, который окружен определенным числом других частиц, называемых лигандами (они обозначаются латинской буквой L).
Комплекс
(т.е. центральный атом с окружающими его
лигандами) иначе называют внутренней
сферой. Ее заряд определяется алгебраической
суммой зарядов ц.а. и координированных
с ним L. В качестве лигандов чаще выступают
анионы (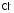 ,
, ,
,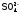 и др.) или нейтральные молекулы (
и др.) или нейтральные молекулы (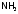 ,
,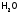 и др.).
и др.).
Классификация
Существует несколько классификации комплексных соединений в основу которых положены различные принципы.
По заряду комплекса
1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
[(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II)
[Co(NH3)6]Cl3 — хлорид гексоамминкобальта(II)
2) Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы.
K2[BeF4] — тетрафторобериллат(II) калия
Li[AlH4] — тетрагидридоалюминат(III) лития
K3[Fe(CN)6] — гексацианоферрат(III) калия
3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а так же при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.
[Ni(CO)4] — тетракарбонилникель
[Pt(NH3)2Cl2] — дихлородиамминплатина(II)
По числу мест занимаемых лигандами в координационной сфере
Структура комплексного иона, образованного катионом металла и анионом ЭДТА
1) Монодентатные лиганды. Такие лиганды бывают нейтральными (молекулы Н2О, NH3, CO, NO и др.) и заряженными (ионы CN−, F−, Cl−, OH−, SCN−, S2O32− и др.).
2) Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной кислоты H2N — CH2 — COO−, оксалатный ион −O — CO — CO — O−, карбонат-ион СО32−, сульфат-ион SO42−.
3) Полидентатные лиганды. Например, комплексоны — органические лиганды, содержащие в своем составе несколько групп −С≡N или −COOH (этилендиаминтетрауксусная кислота — ЭДТА). Циклические комплексы, образуемые некоторыми полидентатными лигандами, относят к хелатным (гемоглобин и др.).
По природе лиганда
1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.
2) Аквакомплексы — в которых лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].
4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6].
5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
Номенклатура
1) В названии комплексного соединения первым указывают анион|отрицательно заряженную часть — анион, затем положительную часть — катион.
2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl− — хлоро, CN− — циано, SCN− — тиоцианато, NO3− — нитрато, SO32− — сульфито, OH− — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил.
3) Число монодентатных лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д.
4) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя.
5) После обозначения состава внутренней сферы называют внешнюю сферу.
6) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса.
Примеры:
K3[Fe(CN)6] — гексацианоферрат(III) калия
(NH4)2[PtCl4(OH)2] — дигидроксотетрахлороплатинат(IV) аммония
[Сr(H2O)3F3] — трифторотриаквахром
[Сo(NH3)3Cl(NO2)2] — динитрохлоротриамминкобальт
[Pt(NH3)4Cl2]Cl2 — хлорид дихлоротетраамминплатины(IV)
[Li(H2O)4]NO3 — нитрат тетрааквалития
Различают следующие виды изомерии:
1) Ионизационная изомерия. При этом наблюдается неодинаковое распределение L между внутренней и внешней сферами КС:
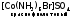 и
и 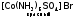 .
.
Частным случаем ионизационной изомерии является гидратная, причина ее в различном распределении молекул воды между внутренней и внешней сферами:
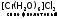 ,
, 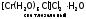 ,
,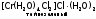 ,
,
Эти комплексы легко различить по количеству ионов хлора, осаждаемых нитратом серебра в расчете на один моль хрома. Для первого комплекса это количество равно 3, для второго – 2, для третьего – 1.
2) Изомерия
связи. Она
наблюдается в случае амбидентатных
лигандов (т. е. монодентатных L с двумя
донорными атомами):
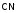 ,
NO,
,
NO,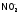 и др. Эти лиганды могут координировать
с ц.а. двумя различными способами.
Например, координация
и др. Эти лиганды могут координировать
с ц.а. двумя различными способами.
Например, координация возможна через атом азота:
возможна через атом азота: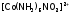 –
нитро-комплекс – желто-коричневый, и
через атом кислорода:
–
нитро-комплекс – желто-коричневый, и
через атом кислорода: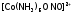 – нитрито-комплекс – розовый.
– нитрито-комплекс – розовый.
3) Координационная изомерия. Она имеет место в случае комплексных соединений, содержащих два комплексообразователя. Проявляется в различном их распределении между катионной и анионной частями КС:
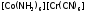 и
и 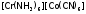 .
.
4) Пространственная (геометрическая) изомерия. В этом случае изомеры отличаются пространственным размещением L во внутренней сфере КС. Как, например, при цис-транс-изомерии, которая имеет место, главным образом, в октаэдрических и квадратных комплексах.
Комплексные соединения широко распространены в природе, играют важную роль в биологически процессах, находят применение в аналитич. практике, производстве металлов, в сельском хозяйстве для нормализации питания растений биометаллами (железом, марганцем, цинком, медью) и лечения болезней, связанных с недостатком биометаллов или невозможностью их усвоения (хлорозы, пятнистости). Комплексные соединения часто являются активными центрами ферментов.
4. Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время. . Вода обладает способностью выступать как в роли окислителя, так и в роли восстановителя. Она окисляет металлы, расположенные в электрохимическом ряду напряжений выше олова. Например, в реакции между натрием и водой происходит следующий окислительный процесс:
Nа(тв.) = Na+(водн.) + е-
В этой реакции вода играет роль восстановителя: 2Н2О(ж.) + 2е- = 2ОН-(водн.) + Н2(г.)
Другим примером подобной реакции является взаимодействие между магнием и водяным паром: Мg(тв.) + Н20(г.) = МgО(тв.) + Н2(г.)
Вода действует как окислитель в процессах коррозии. Например, один из процессов, протекающих при ржавлении железа, заключается в следующем: 2Н2О + О2 + 4е- = 4ОН-
Химические свойства сероводорода
Собственная ионизация жидкого сероводорода ничтожно мала.
В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой:
H2S → HS− + H+ Ka = 6.9×10−7 моль/л; pKa = 6.89.
Реагирует с основаниями:
H2S + 2NaOH = Na2S + 2H2O (обычная соль, при избытке NaOH)
H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
Сероводород — сильный восстановитель. На воздухе горит синим пламенем:
2H2S + ЗО2 = 2Н2О + 2SO2
при недостатке кислорода:
2H2S + O2 = 2S + 2H2O (на этой реакции основан промышленный способ получения серы).
Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или SO42−, например:
3H2S + 4HClO3 = 3H2SO4 + 4HCl
2H2S + SO2 = 2Н2О + 3S
Перекись водорода. Химические свойства
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов и серебра:
2H2O2 → 2H2O + O2
Однако очень чистый пероксид водорода устойчив. Пероксид водорода проявляет слабые кислотные свойства (К = 1,4×10−12), и поэтому диссоциирует по двум ступеням:
![]()
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):
Н2O2 + 2NaOH → Na2O2 + 2H2O
H2O2 + Ba(OH)2 → BaO2↓ + 2H2O
Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:
![]()
В реакции с нитритом калия соединение служит окислителем:
![]()
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5 и пероксидисерная H2S2O8 кислот
Получение: в промышленности H2O2 получают взаимодействием разбавленной серной кислотой с пероксидом бария ВаО2: H2SO4(разб.) + ВаО2= ВаSO4 + H2O2, а также путем перегонки пергидроля в вакууме получается концентрированный пероксид водорода. Пергидроль – 30 %-ный водный раствор H2O2. Окислительная способность и безвредность применения пероксида водорода дала возможность широкого использования его во многих отраслях народного хозяйства: в промышленности – для отбеливания тканей, мехов; в пищевой промышленности – для консервирования продуктов; в сельском хозяйстве – для протравливания семян, в производстве ряда органических соединений, например, в производстве глицерина: промежуточный продукт при получении глицерина – аллиловый спирт СН2 = СН – СН2ОН окисляют при помощи H2O в глицерин С3Н5(ОН)3, используется в ракетной технике как сильный окислитель. 3 %-ный H2O2 применяется в фармацевтике в медицинских целях как дезинфицирующее средство.
5.Окисли́тельно-восстанови́тельные реа́кции (ОВР) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Измерение потенциалов. Практическое значение имеют относительные электродные потенциалы, обычно называемые просто электродные потенциалы, представляющие собой разность электродных потенциалов рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, электродный потенциал которого условно принимается равным нулю (для водных систем).
6. SO2 Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима): SO2 + H2O ↔ H2SO3.Со щелочами образует сульфиты:SO2 + 2NaOH → Na2SO3 + H2O.Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:SO2 + Br2 + 2H2O → H2SO4 + 2HBr,2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°),5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4.Последняя реакция является качественной реакцией на сульфит-ион SO32− и на SO2 (обесцвечивание фиолетового раствора).В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы из отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):SO2 + 2CO → 2CO2 + S↓. 1.
SO3 Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика. При взаимодействии с водой образует серную кислоту:SO3 + H2O → H2SO4.Взаимодействует с основаниями:2KOH + SO3 → K2SO4 + H2O,основными оксидами:CaO + SO3 → CaSO4,c амфотерными оксидами:SO3 + PbO → PbSO4.SO3 растворяется в 100%-й серной кислоте, образуя олеум:H2SO4 (100 %) + SO3 → H2S2O7.2. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается, обычно, до сернистого ангидрида:5SO3 + 2P→ P2O5 + 5SO23SO3 + H2S → 4SO2 + H2O2SO3 + 2KI → SO2 + I2 + K2SO4.3. При взаимодействии с хлороводородом образуется хлорсульфоновая кислота:SO3 + HCl → HSO3ClТакже присоединяет хлор, образуя тионилхлорид:
Сернистая кислота H2SO3 — слабая двухосновная кислота, с средней силы уществует лишь в разбавленных водных растворах:
SO2 + Н2О ↔ H2SO3 ↔ Н+ + HSO3— ↔ 2Н+ + SO32—
Образует два ряда солей: средние — сульфиты и кислые — бисульфиты. Сернистая кислота и ее соли являются восстановителями. При взаимодействии с еще более сильными восстановителями Сернистая кислота играет роль окислителя:
H2SO3 + 2H2S = 3S° + ЗН2О
Вос-ля
![]()
Се́рная кислота́ H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). Серная кислота — довольно сильный окислитель, особенно при нагревании и в концентрированном виде; окисляет HI и частично HBr до свободных галогенов, углерод до CO2, S — до SO2, окисляет многие металлы (Cu, Hg и др.). При этом серная кислота восстанавливается до SO2, а наиболее сильными восстановителями — до S и H2S.
7. Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях
Например, в реакции:
NaOH + HCl = NaCl + H2O
эквивалентом будет реальная частица — ион Na+, в реакции
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
эквивалентом будет являться мнимая частица ½Zn(OH)2.
Под эквивалентом вещества также часто подразумевается количество эквивалентов вещества или эквивалентное количество вещества — число моль вещества эквивалентное одному моль катионов водорода в рассматриваемой реакции.
Закон эквивалентов
все вещества реагируют в эквивалентных отношениях.
формула, выражающая Закон эквивалентов: m1Э2=m2Э1
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
![]()
где:
ν — количество растворённого вещества, моль;
V — общий объём раствора, л;
z — число эквивалентности.
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
8. Концентрированная серная кислота является окислителем за счёт серы. Она окисляет металлы, стоящие в ряду напряжений до серебра включительно. Продукты её восстановления могут быть различными в зависимости от активности металла и от условий (концентрация кислоты, температура). При взаимодействии с малоактивными металлами, например, с медью, кислота восстанавливается до SO2:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O.
При взаимодействии с более активными металлами продуктами восстановления могут быть как SO2, так и свободная сера и сероводород. Так, при взаимодействии с цинком могут протекать реакции:
Zn + 2H2SO4 = ZnSO4 + SO2 + 2H2O
3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O
4ZN + 5H2SO4 = 4ZnSO4 + H2S + 4H2O. Органические вещества серная кислота обугливает, отнимая у них воду.
При получении серной кислоты часть токсичного сернистого газа попадает в атмосферу и приносит большой вред растениям, здоровью человека и животных.
Кроме
того, образование кислотных
дождей на 60% происходит из-за выбросов
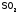 .
ВеличинаpH
дождевой воды доходит до 1,5, т.к. в
атмосфере в присутствии промышленной
пыли сернистый газ окисляется до
триоксида, который под действием влаги
дает H2SO4.
Как следствие, pH
воды в озерах снижается иногда до 4 (а
норма 8). В такой среде невозможна жизнь
не только рыб и водорослей, но даже
микроорганизмов.
.
ВеличинаpH
дождевой воды доходит до 1,5, т.к. в
атмосфере в присутствии промышленной
пыли сернистый газ окисляется до
триоксида, который под действием влаги
дает H2SO4.
Как следствие, pH
воды в озерах снижается иногда до 4 (а
норма 8). В такой среде невозможна жизнь
не только рыб и водорослей, но даже
микроорганизмов.
К тому же, кислотные дожди вызывают коррозию металлических (и не только) изделий. Помимо того, кислая вода растворяет соединения алюминия, ртути, свинца и т.п., которые отравляют гидросферу.
Ежегодно
в мире получают около 100 млн. т H2SO4,
поэтому и вред от отходов ее производства
окружающей среде очень большой. Тем
более что выбросы
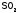 в атмосферу происходят не только на
предприятиях, производящих серную
кислоту, но и на других. В частности, на
Норильском металлургическом комбинате,
где обжигают сульфиды: CoS, NiS и т.п. (чтобы
затем получать соответствующие металлы).
Здесь ПДК (предельно допустимая
концентрация)
в атмосферу происходят не только на
предприятиях, производящих серную
кислоту, но и на других. В частности, на
Норильском металлургическом комбинате,
где обжигают сульфиды: CoS, NiS и т.п. (чтобы
затем получать соответствующие металлы).
Здесь ПДК (предельно допустимая
концентрация)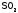 в воздухе превышена многократно, и
вокруг Норильска тундра загублена...
в воздухе превышена многократно, и
вокруг Норильска тундра загублена...
Так что
необходима
очистка газообразных отходов от
сернистого газа, как бы дорого это ни
стоило. Ученые разработали достаточно
эффективные химические методы очистки.
Один из таких способов – пропускание
газов, содержащих S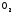 ,
через водную суспензию известняка:
,
через водную суспензию известняка:
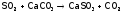 .
.
Предлагается
также исключить обжиг
сульфидов (т.е. пирометаллургический
способ передела руд), а обрабатывать их
водой,
насыщенной кислородом, в вибраторе-смесителе
(это гидрометаллургический
метод). При этом, например, из пирита
сразу получается
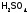 (но разбавленная, и ее надо концентрировать),
а также оксид
(но разбавленная, и ее надо концентрировать),
а также оксид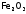 – его можно использовать в металлургии.
Подобныебезотходные
технологии – будущее
промышленности.
– его можно использовать в металлургии.
Подобныебезотходные
технологии – будущее
промышленности.
9. Истинный раствор – это равновесная однофазная система, состав которой можно плавно менять в определенных пределах без изменения числа фаз, причем частицами растворенного вещества являются молекулы, атомы или ионы. Раствор, находящийся в равновесии с растворяемым веществом, является насыщенным, а концентрация раствора, насыщенного по данному соединению, называется его растворимостью (s). Произведение растворимости. Расчет растворимости. Рассмотрим систему, состоящую из осадка малорастворимого электролита, находящегося в равновесии с его насыщенным раствором. Это равновесие записывается в виде:
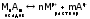
и
характеризуется не только растворимостью
(s),
но и (более строго) с помощью
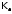 ,
которая называетсяпроизведением
растворимости
(ПР):
,
которая называетсяпроизведением
растворимости
(ПР):
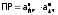 , где,
напомним, a=f∙C.
, где,
напомним, a=f∙C.
10. Неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Могут быть и восстановителями (кроме F) при взаимодействии с более электроотрицательными элементами. Получение простых веществ.
Устойчивость
галогенов в ст.ок. –1 от фтора к иоду
снижается
(из-за роста r).
Поэтому, если
 можно окислить лишьэлектротоком,
то
можно окислить лишьэлектротоком,
то
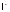 дажебромом:
дажебромом:
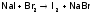 .
.
Но в промышленности для синтеза и I2, и Br2 берут более дешевый реагент – хлор:
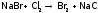 .
.
Хлор
в свою очередь получают из хлорида
натрия электролизом
его расплава,
как и
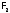 из
из .
Однако с гораздоменьшим
расходом электроэнергии, поскольку
окислить
.
Однако с гораздоменьшим
расходом электроэнергии, поскольку
окислить
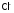 значительно легче, чем
значительно легче, чем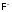 .
. В свободном состоянии галогены
состоят из двухатомных молекул F2, Cl2,
Br2, I2. Атомы в этих молекулах связаны
между собой неполярной ковалентной
связью. На наружном энергетическом
уровне находятся семь электронои ns2np5.
До устойчивого состояния атомов им не
хватает по 1 электрону. Поэтому атомы
галогенов легко присоединяют электрон
и проявляют степень окисления -1, например:
.
. В свободном состоянии галогены
состоят из двухатомных молекул F2, Cl2,
Br2, I2. Атомы в этих молекулах связаны
между собой неполярной ковалентной
связью. На наружном энергетическом
уровне находятся семь электронои ns2np5.
До устойчивого состояния атомов им не
хватает по 1 электрону. Поэтому атомы
галогенов легко присоединяют электрон
и проявляют степень окисления -1, например:
2Na + Cl2 = 2NaCl
Таким образом, галогенам присущи сильные окислительные свойства. Однако галогены (кроме F) могут проявлять и положительные степени окисления. Галогены - типичные неметаллы. Реакционная способность галогенов по отношению к металлам и водороду снижается от F к I. Более реакционноспособный галоген замещает менее реакционноспособнный в соединениях, например:
2KI + Cl2 = 2KCl + I2
2I- + Cl2 = 2Cl- + I2
Водородные соединения - галагеноводороды в воде являются кислотами:
HF - фтороводородная (плавиковая) кислота
HCl - хлороводородная (соляная) кислота
HBr - бромоводородная кислота
HI - иодоводородная кислота
Сила этих кислот повышается от HF (слабая кислота) к HI (сильная кислота), так как в этом же направлении уменьшается энергия связи водород - галоген.
11. Процесс растворения электролитов (т.е. веществ, растворы которых проводят электрический ток) описывается теорией электролитической диссоциации, ее основные положения:
а) при растворении электролит диссоциирует, т.е. распадается на ионы,
б) диссоциируют вещества под действием молекул растворителя,
в) продуктами
растворения электролита являются
сольваты
(частицы, окруженные молекулами
растворителя), в случае водных растворов
– гидраты.
Доказательством образования, в частности,
гидратов служит выделение тепла при
растворении в воде
многих безводных
солей, а также изменение оптических
свойств (например, цвета) веществ после
переведения их в раствор и др.
Слабыми
электролитами
называют вещества, в 0,1М растворах
которых наряду с ионами существуют и
неионизированные молекулы (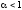 ).
К ним относятся гидрат аммиака, все
органические основания и кислоты; из
неорганических кислот:
).
К ним относятся гидрат аммиака, все
органические основания и кислоты; из
неорганических кислот: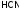 ,
,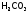 ,
, ,
,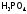 ,
,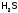 ,
,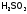 и т.п.
и т.п.
Если
0,1М раствор не содержит молекул исходного
вещества в недиссоциированном виде,
т.е.
 ,
то электролит называютсильным.
Это почти все растворимые
основания (т.е. щелочи) и соли, а также
неорганические кислоты (в которых, как
правило, анионообразующий элемент,
находясь в высшей ст.ок., имеет достаточно
высокую электроотрицательность):
,
то электролит называютсильным.
Это почти все растворимые
основания (т.е. щелочи) и соли, а также
неорганические кислоты (в которых, как
правило, анионообразующий элемент,
находясь в высшей ст.ок., имеет достаточно
высокую электроотрицательность):
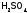 ,
,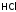 ,
, и т.п Константа равновесия этого процесса,
т.е. константа диссоциации Н2О:
и т.п Константа равновесия этого процесса,
т.е. константа диссоциации Н2О:
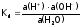 .
.
Ее
величина определена по электропроводности
чистой воды и при 220С
равна
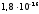 .
Так как степень диссоциации Н2О
очень мала, то можно считать, что
.
Так как степень диссоциации Н2О
очень мала, то можно считать, что
 .
.
Подставляя
данное значение а(Н2О)
в выражение
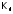 воды, получим:
воды, получим:
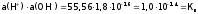 ;
;
здесь
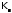 –
ионное произведение воды:
–
ионное произведение воды: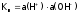 .
.
Перейдем к отрицательным десятичным логарифмам:
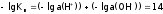 .
.
Отрицательный
логарифм активности ионов водорода
называется водородным
показателем
и обозначается
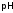 ,
а ионов гидроксила –
,
а ионов гидроксила – ,
таким образом, имеем:
,
таким образом, имеем:
 .
.
Для
чистой
воды (и нейтрального
раствора):
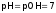 ,
длящелочной
среды:
,
длящелочной
среды:
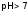 ,
а
,
а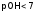 ;
длякислого
раствора – наоборот. Например, в 0,1М
HCl:
;
длякислого
раствора – наоборот. Например, в 0,1М
HCl:
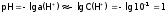 (<7), а
(<7), а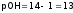 (>7).
(>7).
12. Азот и фосфор
5.1. Общая характеристика. Нахождение в природе. Получение
К р-элементам V группы относятся азот, фосфор, мышьяк, сурьма и висмут. В соответствии с электронной конфигурацией валентного слоя s2p3, они проявляют степени окисления –3, +3 и +5. У азота могут быть еще –2, –1, +1, +2, +4, однако наиболее устойчив N в нулевой ст.ок. – в молекуле N2 вследствие прочной связи в ней.
Высокая
энергия этой связи (945 кДж/моль) объясняется
тем, что атомы N,
благодаря их малому радиусу, образуют
между собой очень эффективные (а потому
и прочные ) как
 -,
так и
-,
так и -перекрывания.
-перекрывания.
На Земле примерно половина азота находиться в виде газа N2 (он составляет 4/5 атмосферы). Остальное – связанный азот – это селитры (т.е. нитраты K, Na, Ca, Cu), а также органические вещества растений, животных и их останков. Причем содержание N в природе (0,025%), значительно меньше, чем в организмах (например, в человеке – 2,56%). Это отражает важнейшую биологическую роль азота.
Получают N2 в промышленности ректификацией воздуха, так что он дешев. В лаборатории азот берут из баллонов, где он находиться под давлением 200 атм. Если же N2 нужен в небольшом количестве, то его обычно синтезируют по реакции:

Содержание фосфора на Земле тоже значительно (0,05%), а в организме человека – еще больше (0,95%!).
Для атомов
Р
 -перекрываниенеэффективно
(как и для серы из-за большого r).
Поэтому простые
вещества фосфора, имея ординарные
ХС, слишком
активны
(в отличие от N2
с тройной
связью). Как следствие, в природе
встречаются только
сложные
соединения Р. Чаще в составе таких горных
пород, как фосфорит (его основа – фосфат
кальция Са3(РО4)2),
или в виде минералов (например, фторапатита
Са5(РО4)3F).
-перекрываниенеэффективно
(как и для серы из-за большого r).
Поэтому простые
вещества фосфора, имея ординарные
ХС, слишком
активны
(в отличие от N2
с тройной
связью). Как следствие, в природе
встречаются только
сложные
соединения Р. Чаще в составе таких горных
пород, как фосфорит (его основа – фосфат
кальция Са3(РО4)2),
или в виде минералов (например, фторапатита
Са5(РО4)3F).
Фторапатит является также компонентом эмали зубов, причем, чем больше его в ней, тем эмаль прочнее и менее растворима. Вот почему в зубные пасты вводят фториды. Процессы, укрепляющие зубы, следующие:
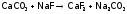 , а
затем:
, а
затем:
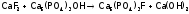 .
.
Для скелета взрослого человека требуется немногим более 1 кг фосфора, но еще меньше – всего 12 г нужно для работы нервных клеток (в том числе головного мозга). Кроме того, нехватка фосфора в организме приводит к утомляемости и раздражительности. Чтобы пополнить его запасы, нужно есть бобы, горох, чечевицу, фасоль, рыбную икру, мозг животных. Подчеркнем, что недостаток в почве фосфора (а также азота) уменьшает урожайность растений, особенно зерновых.
Получают Р в промышленности из фосфатов карботермически, т.е. восстановлением углем («уголь» по-гречески – «карбос» ) при прокаливании. Причем процесс ведут в присутствии песка (SiO2), который снижает т.пл. реакционной смеси и, к тому же, прочно связывает оксид кальция в силикат:
 .
.
Образующиеся пары (Р и СО2) пропускают через воду. В ней фосфор практически не растворятся и (как результат охлаждения) затвердевает.
Остальных р-элементов V группы в природе немного (кларк – 10-4–10-6 %), и находятся они в земной коре в виде сульфидов. Обжигом их переводят в оксиды, а затем восстанавливают до простых веществ, тоже прокаливая с углем.
5.2. Простые вещества
5.2.1. Структура и физические свойства
Азот (в отличие от кислорода) не имеет аллотропных форм, ибо слишком прочна тройная связь в N2. Из-за жесткости этой связи частицы N2 слабо поляризуются. Как следствие:
– незначительна растворимость азота (как и Н2) и в неполярных жидкостях, и в воде (около 15 мл N2 в 1 л Н2О при об.у., что в 2 раза меньше чем в случае О2);
– очень низки его т.пл. (–2100С) и т.кип. (–1960С), поэтому N2 широко используется в качестве эффективного и дешевого охладителя;
– азот не имеет цвета, запаха, вкуса, и в других отношениях биологически достаточно пассивен.
Это отражено и в его названии, которое несет смысл: «не поддерживающий жизни»2. (Ибо при исследовании свойств азота выяснилось, что в его атмосфере животные быстро погибают.)
В отличие
от азота, фосфор, каждый
атом
которого образует по три
 -связи
ссоседними,
имеет больше вариантов
их объединения между собой, поэтому
дает несколько аллотропных форм. Из них
на практике чаще всего используются
т.н. белый
фосфор и красный
(рисунок 3).
-связи
ссоседними,
имеет больше вариантов
их объединения между собой, поэтому
дает несколько аллотропных форм. Из них
на практике чаще всего используются
т.н. белый
фосфор и красный
(рисунок 3).
Белый
фосфор (желтоватое, мягкое, как воск
вещество) получается при конденсации
паров, образующихся по реакции, и состоит
из тетраэдров Р4
(рис. 5а). Это самые
простые
молекулы, которые могут сформироваться
при трех
 -связях
у каждого атома.
-связях
у каждого атома.
Однако в тетраэдрах p-орбитали расположены друг к другу под углом 600, что значительно отличается от естественного угла между ними (900). Поэтому связи напряжены и со временем одна из них в каждой молекуле разрывается.
Благодаря появляющимся при этом неспаренным электронам (на p-орбиталях) тетраэдры связываются друг с другом. (Теперь они уже искажены, ибо в них углы между p-орбиталями гораздо ближе к 900, а значит, состояние фосфора становится более устойчивым.) Так получаются цепи Рn (из искаженных тетраэдров – см. рис. 3б), т.е. формируется волокнистая структура – это красный фосфор (порошок фиолетово-кирпичного цвета).
По описанному механизму Р4 при хранении без доступа воздуха при об.у. медленно переходит в Рn, быстрее при нагревании (но не выше 2400С). Обратный переход (красного фосфора в белый) осуществляется выше 2400С, но тоже в отсутствии О2.
Частицы Рn значительно превосходят молекулы Р4 по числу атомов, и как следствие по величине Мr. Потому и свойства этих аллотропных форм резко различаются. Так, белый фосфор (в отличие от красного) летуч, имеет запах (чесночный), растворим в неполярных жидкостях. Его т.пл. (44,80С) намного ниже, чем у красного (6000С). И если Рn биологически достаточно пассивен, то Р4 – ядовит, а также вызывает долго не заживающие ожоги при попадании на кожу.
