
Калин Физическое материаловедение Том 6 Част 2 2008
.pdf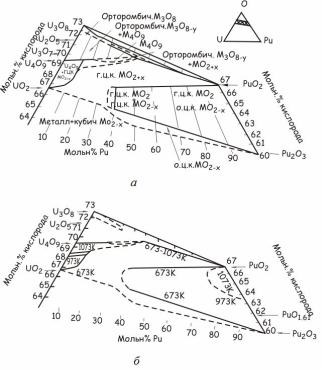
окисление при значениях y < 0,5 вызывает появление однофазной области MeO2+х, которая переходит в двухфазную область, содержащую фазы MeO2+х и Мe4О9. Дальнейшее окисление приводит к исчезновению фазы MeO2+х и появлению двухфазной области, где фаза Мe4О9 находится в равновесии с фазой Me3O8-z.
Рис. 24.132. Участки тройной диаграммы состояния системы
уран–плутоний–кислород между UO1,88-U3O8 и PuO2-PuO1,5:
а – при Ткомн; б – при 1073 К
Кристаллическая структура и межатомная связь. Простые и смешанные оксиды урана и плутония кристаллизуются в гранецентрированную кубическую структуру типа CaF2. В случае смешанных оксидов урана и плутония ионы урана и плутония занимают узлы в центре граней куба. Внутри каждой элементарной ячейки имеется куб, вершины которого заняты ионами кислорода.
231
Основной характер межатомной связи в (U,Pu)О2 – ионный с некоторой долей ковалентной связи.
Фазовое состояние и микроструктура. Оксиды урана и плуто-
ния образуют твердый раствор, т.е. атомы плутония замещают атомы урана в катионной подрешетке в количестве, соответствующем содержанию плутония. В системе UО2 – PuО2 область твердых растворов простирается до содержания оксида плутония ~30 %.
Таблетки МОХ-топлива из (U,Pu)О2 имеют структуру, состоящую из однородных зерен твердого раствора. В то же время при производстве МОХ-топлива из смеси порошков UО2 и PuО2 взаимодействие между ними при спекании таблеток может происходить не полностью, вследствие чего в таблетках обнаруживаются два твердых раствора с различным содержанием плутония. Основу такой структуры составляет твердый раствор (U,Pu)О2, в котором имеются отдельные участки с большим содержанием урана.
Стехиометрия оксидов. Смешанные оксиды урана и плутония относятся к нестехиометрическим оксидам и в зависимости от температуры и парциального давления кислорода в окружающей газовой среде могут в широких пределах изменять содержание кислорода в кристаллической решетке, характеризуемое отношением количества атомов кислорода к количеству атомов металла в оксиде (отношение О/М, где М = U+Pu) или степенью нестехиометрии, определяемой как x = O/M – 2. Напомним, что для застехиометрических смешанных оксидов (О/M > 2) величина x имеет положительное значение, а для достехиометрических (O/M < 2) – отрицательное; при x = 0 состав оксида соответствует стехиометрическому составу. Поэтому в общем виде химическая формула нестехиометрического смешанного оксида имеет вид (U1-y,Puy)О2±x, где y – мольная доля PuО2.
Отклонение смешанных оксидов урана и плутония от стехиометрического состава возможны потому, что эти элементы облада-
ют многими валентными состояниями. У урана наиболее устойчивы валентные состояния U4+, U5+ и U6+, а у плутония – Pu3+ и Pu4+. В
стехиометрическом диоксиде ионы урана и плутония имеют заряд 4+. При удалении или добавлении к стехиометрическому оксиду некоторого количества ионов кислорода определенная часть катионов должна изменить валентность, чтобы сохранить электрическую нейтральность твердого тела. Добавление одного иона О2- требует,
232
чтобы два иона U4+ превратились в ионы U5+, поэтому доля пятивалентного урана в оксиде UO2+х равна 2х. Аналогично, электронейтральность оксидов плутония PuO2-х поддерживается путем превращения части ионов Pu4+ в Pu3+. Доля плутония, находящегося в 3-валентном состоянии в PuO2-х, равна 2х.
Отклонения от стехиометрии сопровождаются появлением дефектов Френкеля в подрешетке ионов кислорода. Избыток кислорода в UO2+х вызывает образование ионов в межузлиях в структуре флюорита. Недостаток кислорода в PuO2-х проявляется как вакансии в подрешетке кислорода. Подрешетка катионов остается идеальной даже если O/М отличается от двух, т.е. ионы урана или плутония распределены по всем имеющимся положениям в подрешетке катионов.
ВМОХ-топливе застехиометрического состава (U,Pu)О2+x присутствие ионов Pu5+ и Pu6+ маловероятно, так как застехиометриче-
ский оксид PuО2+x не образуется даже при температурах выше 2300К. Заряды, вводимые в кристалл (U,Pu)О2+x при добавлении в него кислорода, компенсируются, по-видимому, окислением части ионов урана до валентных состояний +5 или +6 (так же как и в чис-
тых оксидах урана), в то время как плутоний остается в катионной подрешетке в виде Pu4+.
Вдостехиометрическом МОХ-топливе (U,Pu)О2-x восстановление катионов плутония протекает легче, чем катионов урана. По-
этому достехиометрические смешанные оксиды урана и плутония содержат в катионной подрешетке U4+ и смесь катионов Pu3+ и Pu4+.
Средняя валентность ионов плутония VPu в достехиометрическом смешанном оксиде с данными значениями х и y может быть легко определена из условия электрической нейтральности. Также
может быть найдена и средняя валентность ионов урана VU в застехиометрическом оксиде любого состава. Для достехиометрического оксида (U1-y,Puy)О2-x:
VU 4; |
VPu 4 |
2x |
, |
(24.13) |
|
||||
|
|
y |
|
|
а для застехиометрического оксида (U1-y,Puy)О2+x:
VPu 4; |
VU 4 |
2x |
, |
(24.14) |
|
||||
|
|
y |
|
|
где x – в обоих уравнениях считается положительным.
233

В смешанных оксидах урана и плутония до- и стехиометрического состава характерными типами дефектов кристаллической структуры, также как и в PuО2-x, являются, по-видимому, кислородные вакансии и межузельные катионы. Кроме того, возможно также упорядочение кислородных вакансий. В кристаллической структуре застехиометрических смешанных оксидов, по аналогии с UO2+x, естественно предположить доминирование сложных дефектов, образованных междоузельными анионами и вакансиями.
24.3.3. Физико-химические свойства диоксидов
Кислородный потенциал. Простые и смешанные оксиды урана и плутония при заданной температуре характеризуются определенным парциальным давлением газообразного кислорода, находящегося в термодинамическом равновесии с оксидом. Величину, представляющую собой свободную энергию, приходящуюся на моль кислорода в твердом теле, называют кислородным потенциалом и описывают следующим выражением:
|
GO2 |
RT ln pO2 , |
(24.15) |
где pO2 – равновесное парциальное давление кислорода над окси-
дом при температуре T, а R – газовая постоянная.
Кислородный потенциал является весьма важной характеристикой топливных оксидов, так как: определяет интенсивность взаимодействия продуктов деления с оболочкой твэла; контролирует химическое состояние продуктов деления, их взаимодействие с топливом, вклад в распухание, летучесть и перераспределение компонентов топлива; влияет на давление паров компонентов топлива и контролирует, таким образом, перераспределение урана и плутония в МОХ-топливе; оказывает влияние на теплопроводность, ползучесть, диффузионную подвижность и многие другие свойства оксидного топлива.
Связь между парциальными молярными энтальпией HO2 и эн-
тропией SO2 растворения кислорода в твердом теле, которые в первом приближении не зависят от температуры, выражается через
234
кислородный потенциал с помощью известного соотношения (см.
п. 4.1):
|
|
|
|
|
O2 |
T |
|
O2 . |
(24.16) |
GO2 |
H |
S |
|||||||
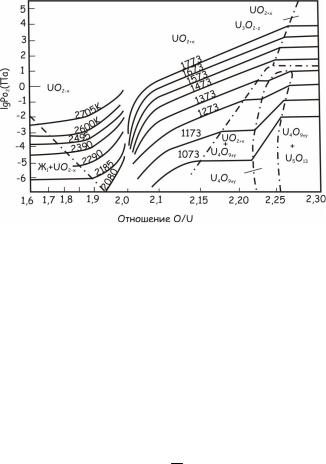
Зависимость равновесного парциального давления кислорода в системе уран – кислород от температуры и отношения O/U показа-
на на рис. 24.133.
Рис. 24.133. Зависимость равновесного парциального давления кислорода
всистеме уран–кислород от отношения O/U при разных температурах
Вдвухфазной области Ж + UO2-х равновесное парциальное давление кислорода от отношения O/U не зависит. В достехиометри-
ческой области UO2-х давление pO2 имеет весьма низкие значения
даже при высоких температурах. В застехиометрической области равновесные парциальные давления существенно выше и они возрастают как с ростом температуры, так и с отношением O/U. В
двухфазных областях UO2+х+U4O9±y и UO2+х+U3O8-z их значения от отношения O/U не зависят. Вблизи стехиометрического состава
парциальные давления кислорода резко изменяются в зависимости от O/U как в до-, так и в застехиометрической областях. Полученное расчетным путем изменение GO2 UO2+х от температуры и O/U
представлено на рис. 24.134.
235
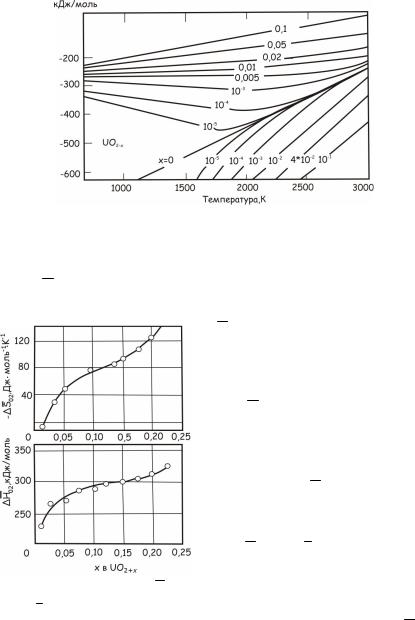
Рис. 24.134. Расчетные зависимости кислородного потенциала UO2 в зависимости от температуры и отношения кислород/уран
Прямая, соответствующая значению х = 0, показывает изменение GO2 диоксида урана стехиометрического состава с ростом
температуры. Линии, лежащие выше ее, описывают изменение
Рис. 24.135. Зависимости HO2
и SO2 застехиометрического диоксида урана от отношения O/U
GO2 застехиометрических, а ли-
нии, лежащие ниже – достехиометрических оксидов. При фиксированных значениях O/U изменение GO2 с ростом температуры
имеет нелинейный характер (см. рис. 24.134), что не позволяет экстраполировать низкотемператур-
ные значения GO2 в область вы-
соких температур, и наоборот. Экспериментальные зависимо-
сти HO2 и SO2 застехиометри-
ческого диоксида урана от отношения O/U показаны на рис. 24.135. Они могут быть использованы для расчетов значений GO2
236
по уравнению (24.16) в широком интервале температур. Вблизи стехиометрического состава на этих зависимостях при O/U ≈ 2,0018 установлено существование резко очерченных максимумов (на рис. 24.135 не показаны), что, по-видимому, связано с изменением концентраций сложных дефектов кристаллической структуры диоксида урана в зависимости от отношения O/U.
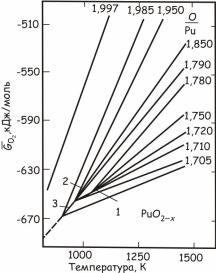
Зависимости химических потенциалов кислорода оксидов плутония от температуры и отношения O/Pu показаны на рис. 24.136. Из рисунка видно, что с увеличением отношения O/Pu химические потенциалы кислорода возрастают и имеют максимальные значения для диоксида плутония около стехиометрического состава
(O/Pu=1,997).
Рис. 24.136. Зависимости кислородного потенциала PuO2 от температуры и отношения O/Pu (цифры 1, 2 и 3 на нем обозначают кривые, построенные для двухфазных областей диаграммы состояния плутоний–кислород
на рис. 24.131, отмеченных теми же самыми цифрами)
Типичные изотермические зависимости кислородного потенциала от отношения О/М смешанного оксида, содержащего 30 мас.% PuО2, показаны на рис. 24.137.
237
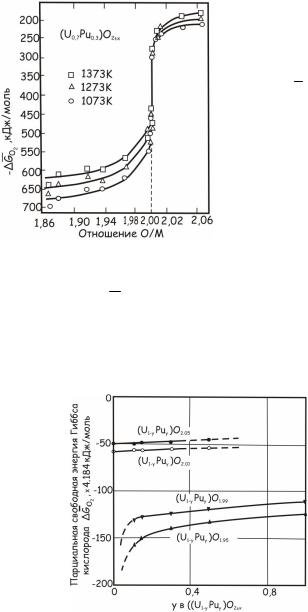
Рис. 24.137. Изотермические зависимости кислородного
потенциала GO2 смешанного
оксида (U0,7Pu0,3)O2±x
от отношения кислород/металл
Таким образом, с ростом температуры кислородный потенциал увеличивается, а вблизи стехиометрического состава происходит
резкое изменение GO2 . Это свойство кислородного потенциала
МОХ-топлива, которое также присуще и кислородному потенциалу диоксида урана, оказывает влияние на его поведение в реакторе. Возрастание отношения О/М и концентрации диоксида плутония в МОХ-топливе повышает его кислородный потенциал (рис. 24.138).
Рис. 24.138. Зависимость кислородного потенциала смешанного оксида (U1-yPuy)O2±х от содержания плутония при температуре 1000 °С
238
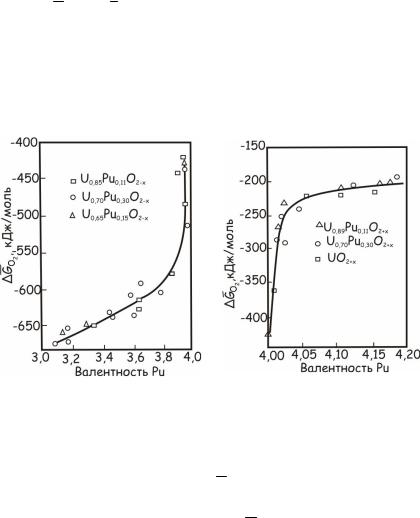
Хотя кислородные потенциалы смешанных оксидов урана и плутония изменяются в зависимости от температуры линейно, зна-
чения HO2 и SO2 зависят, как показывают экспериментальные
данные, главным образом от валентности тяжелых металлов в оксидах. В достехиометрических оксидах парциальные молярные термодинамические свойства зависят только от средней валентности катионов плутония, определяемой по уравнению (24.13), а в застехиометрических – от средней валентности катионов урана, рассчитываемой по уравнению (24.14) (рис. 24.139 и рис. 24.140).
Рис. 24.139. Зависимость кислородного |
Рис. 24.140. Зависимость кислородного |
потенциала смешанных оксидов урана |
потенциала смешанных оксидов урана |
и плутония в достехиометрической |
и плутония, а также диоксида урана |
области от валентности плутония |
в застехиометрической области |
при 1273 К |
от валентности урана при 1273 К |
Такой характер зависимости GO2 от валентности катионов тя-
желых металлов получил название правила Маркина – Мак-Ивера. Оно позволяет оценивать величины GO2 для любых однофазных
смешанных уран-плутониевых оксидов. Рассчитанные с его помощью кислородные потенциалы смешанных оксидов урана и плутония в до- и застехиометрической областях составов изображены на рис. 24.141.
239
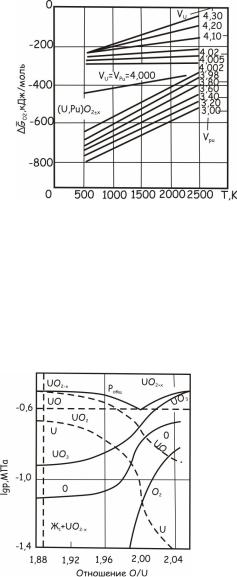
Рис. 24.141. Температурная зависимость кислородного потенциала оксида (U1-yPuy)O2±х в до- и застехиометрических областях составов
Испарение оксидного топлива. Учитывая высокие рабочие температуры оксидного топлива, важно знать величины равновесных давлений пара и его компонентов над смешанными оксидами, которые определяют многие процессы, происходящие в топливе при выгорании и, в первую очередь, такие, как перестройка структуры, перераспределение актиноидов и т.п., за счет механизма ис- парение-конденсация. Испарение диоксида урана стехиометрического состава до 2300 К имеет конгруэнтный характер. С увеличением температуры этот состав обедняется кислородом, достигая
при ~2650 К значения UO1,949.
|
Зависимость состава конгруэнт- |
|
но испаряющейся фазы от темпе- |
|
ратуры описывается уравнением: |
|
x·lnx = (–,850 ± 0,100) + |
|
+ (3,832 ± 0,396)·10-4·T, (24.17) |
|
где х определяет состав оксида |
|
UO2+х. |
|
В случае нестехиометрических |
|
соединений парциальные давления |
|
компонентов пара зависят от со- |
|
става твердой фазы, а состав газо- |
|
вой фазы обычно отличается от |
Рис. 24.142. Зависимость состава |
состава твердой фазы. Следова- |
равновесного пара над UO2±х |
тельно, в такой фазе процесс испа- |
от отношения O/U при 2185 К |
рения вызывает постепенное изме- |
|
240 |
