
Калин Физическое материаловедение Том 5 2008
.pdf4.Фазы со структурой никель-арсенида NiAs (гексагональная решетка). Обычно образуются между переходными металлами и другими элементами, обладающими свойствами металлов и металлоидов. Примеры: FeSb, NiSb.
5.Фазы внедрения, образующиеся при взаимодействии переходных металлов с углеродом, азотом, водородом и другими элементами. Структура карбидов, нитридов и гидридов зависит от соотношения атомных размеров металла и металлоида. Если отношение
rметаллоида/rметалла 0,59, то фазы внедрения имеют простые решетки (ОЦК, ГЦК, а иногда ГПУ). В этих фазах атомы металлоида зани-
мают пустоты кристаллической решетки металла. Если отношение атомных радиусов больше 0,59, то образуются фазы со сложной кристаллической решеткой.
6.Сигма-фаза ( -фаза) встречается в сплавах переходных металлов и имеет тетрагональную решетку. Примеры: FeCr, FeV.
7.Упорядоченные твердые растворы на основе решетки одного из компонентов – так называемые сверхструктуры. Эти твердые растворы занимают промежуточное положение между обычными твердыми растворами и интерметаллическими соединениями.
Примеры: CuAu, Cu3Au.
8.Оставшиеся химические соединения типа Fe3С, Fe3Al, Fe7W6. Оценка устойчивости химических соединений, как указано выше,
производится по величинам H или G, то есть по величинам изменения энтальпии или свободной энергии образования соединения. Если, например, изменение свободной энергии образования соеди-
нения в расчете на один атом соединения |
G 2 |
|
G |
1 |
, то |
|
MemOn |
|
MemOn |
|
|
соединение Me2mOn более стабильно при данной температуре.
По предложению Н.С. Курнакова химические соединения делят на дальтониды и бертоллиды. Если дальтониды характеризуются стехиометрическим соотношением компонентов, максимумом свойств при стехиометрическом составе и обычным отсутствием заметной области растворимости компонентов в соединении, то бертоллиды не имеют точно выраженного состава и максимума свойств и обычно имеют широкую концентрационную область растворимости компонентов в химическом соединении.
81
Подчеркнем, что наличие растворимости одних химических элементов в других и возможность их взаимодействия с образованием различных химических соединений в твердом состоянии открывают перед материаловедами широкие возможности по формированию заданного фазового состояния материала.
Электроотрицательность. Величины электроотрицательности элементов, их сравнение или разности позволяют предсказать тенденции взаимодействия атомов основы и легирующего элемента. Разность электроотрицательностей основы и легирующего элемента по Полингу равна = 0,208 0,5, где – разность между энергией диссоциации соединения АВ – двух химических элементов (основы – А и легирующего элемента – В) и полусуммой энергий диссоциации молекул АА и ВВ в отдельности, т.е.
= DAB – (DAA + DBB)/2,
где Dij – соответствующие энергии диссоциации.
Полинг составил шкалу электроотрицательностей разных элементов. Если выражать значения электроотрицательностей в относительных единицах, то металлы имеют значения от 0,8 (K) до 2,6 (Pd); металлоиды и полупроводники от 1,9 (Si) до 2,9 (Br); газы от 2,15 (H) до 3,9 (F).
Установлено, что чем дальше в таблице электроотрицательностей отстоят элементы друг от друга (и тем больше разница электроотрицательности), тем прочнее связь между ними. На основании этого по разности электроотрицательностей элементов можно судить о температурной устойчивости фаз, образованных элементами. Кроме этого установлено, что большим разностям электроотрицательностей обычно соответствуют низкие значения взаимной растворимости обычных металлов. Исключение составляет, например, система Au–Mg, для которой существует относительно большая разность электроотрицательностей ( = 1,3), а растворимость тоже большая (25 %). Тем не менее, разность электроотрица-
тельностей является количественной характеристикой элек-
трохимического взаимодействия элементов основы и легирующих элементов. Для образования твердых растворов необходимо, чтобы эта разность была малой.
82

Состояние сплава теоретически можно описать уравнениями Шредингера, составленными для каждого атома с учетом окружения из всех атомов. Но в настоящий момент реально применить такой подход невозможно из-за слишком большого порядка системы уравнений математической физики, которую необходимо решить хотя бы численно. Поэтому используют усредненные методы, и, прежде всего методы термодинамики. Обычно учитывается, что атомы имеют конечные размеры и обмениваются электронами, т.е. принимаются во внимание механические эффекты (деформация), кулоновское и химическое взаимодействие. Для упрощения подхода часто применяют квазихимическое приближение1: межатомные связи устанавливаются только между атомами, находящимися в первой координационной сфере. Поэтому квазихимический подход не дает абсолютно точных результатов, но позволяет оценить тенденции, понять процесс формирования структуры сплава.
Например, используя методы термодинамики и квазихимический подход, можно провести оценку устойчивости твердого раствора по знаку и величине параметра взаимодействия2 , однозначно связанного с энергией парного взаимодействия атомов:
= z·NA·[ AB – 1/2( AA + BB)],
где z – координационное число, NA – число Авогадро, ij – энергия, приходящаяся на одну связь атомов типа i и j, отрицательная по термодинамическому правилу знаков.
Если | AB| > |1/2( AA + BB)|, то взаимодействие разнородных атомов сильнее, параметр взаимодействия отрицателен. В этом случае образуется устойчивый твердый раствор или раствор, склонный к упорядочению3.
Если | AB| < |1/2( AA + BB)|, то взаимодействие однородных атомов сильнее, параметр взаимодействия положителен. Такие твердые растворы при охлаждении подвержены распаду на двухфазную смесь4. В случае, если жидкий раствор близок к идеальному – па-
1Физическое материаловедение. Т. 2. – М.: МИФИ, 2007. Пп. 4.6.3, 4.9.4.
2Там же, п. 4.6.3.
3Там же, п. 4.9.
4Там же, п. 4.8.
83

раметр взаимодействия в жидкой фазе мал
– то образование двухфазной системы происходит по эвтектическому механизму (рис. 16.5,а). Если жидкий раствор не идеален, а его параметр взаимодействия по величине близок к таковому для твердой фазы, то расслоение идет по перитектической реакции (рис. 16.5,б).
Кроме этого необходимо учитывать роль упругих напряжений и сжимаемость атомов. Чем больше различие в атомных радиусах и чем больше
модуль сдвига, тем выше температура распада и меньше растворимость. Максимум кривой распада смещается к элементу с меньшей сжимаемостью.
Физико-химический анализ и легирование основы. Характер физико-химического взаимодействия компонентов в сплаве описывают диаграммами состояния взаимодействующих систем (ДСС). Большим опытом физико-химических исследований доказано, что ДСС, описывая равновесные фазовые состояния и структуры сплавов, позволяют качественно описать изменения ряда свойств сплава при изменении состава. Это обусловлено существенным влиянием СФС сплавов на свойства. В работах Н.С. Курнакова, А.А. Бочвара и других исследователей показано, что ряд механических и физических свойств изменяется при изменении состава (и, следовательно, СФС) по определенным для каждого типа диаграмм состояния закономерностям.
Примеры таких качественных закономерностей показаны на рис. 16.6, на котором изображены различные типы двойных ДСС, а под ними – качественные изменения, например, предела прочности от состава. Аналогичную качественную зависимость от состава имеет и удельное электросопротивление. Например, сопротивление пластической деформации непрерывного ряда твердых растворов при низких (комнатных) температурах изменяется по кривой второго порядка с максимумом, лежащим обычно вблизи 50 % (ат.) второго (легирующего) компонента, что отвечает наибольшему искажению решетки твердого раствора. Однако необходимо подчеркнуть, что при комнатной температуре малые добавки вызыва-
84
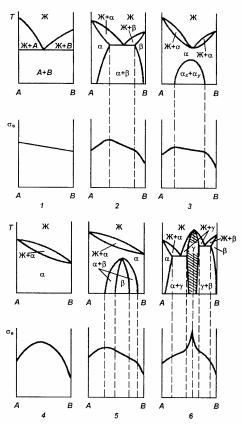
ют наибольшее искажение решетки растворителя; влияние последующих добавок тем слабее, чем выше концентрация легирующего элемента. Подчеркнем, что с повышением температуры характер кривой изменения прочности от состава будет изменяться.
Рис. 16.6. Качественные изменения предела прочности в от состава бинарного сплава А–В
Таким образом, имея диаграммы состав–свойства для ДСС основы с различными легирующими элементами, можно выбрать и вид легирующего элемента, и приблизительную его концентрацию для получения необходимого эффекта. При этом чаще всего необходимо знать начальные участки таких диаграмм (относительно основы) и, прежде всего, величины растворимости, температуры
85
фазовых превращений, фазовое состояние. На рис. 16.6 видно, что максимальную прочность дают химические соединения. При образовании эвтектик наблюдается практически линейная зависимость предела прочности от состава.
Кстати, следует отметить, что, во-первых, данные на рис. 16.6 свидетельствуют о том, что одним из важных факторов упрочнения основы (А) при легировании (В) является искажение ее решетки – решетки твердого раствора. Возникающие при этом упругие искажения (упругие поля) создают препятствия для движения дислокаций, имеющих собственные упругие поля (взаимодействие упругих полей).
Во-вторых, необходимо учитывать сильное влияние на прочностные характеристики сплавов структурных факторов (дисперсности избыточных фаз, величины зерна и блоков мозаичности (субзерен), текстуры и др.), формируемых в процессе обработки (механической, термической) литых сплавов.
Вработах профессора В.К. Григоровича убедительно показано, что, зная фазовые равновесия в различных ДСС, можно прогнозировать жаропрочные свойства сплавов, включая предел длительной прочности и предел ползучести. На рис. 16.7 показаны изотермы пределов длительной прочности сплавов для четырех типов бинарных ДСС.
Всистемах с непрерывным рядом твердых растворов по мере роста температуры и приближения ее к температуре перехода в жидкое состояние (начиная с температуры рекристаллизации) доминирующим с точки зрения прочности становится не искажение решетки твердого раствора, а активация атомов и развитие диффузионных процессов. Из-за этого с ростом температуры концентрационная зависимость изотерм жаропрочности изменяется таким образом, что максимум жаропрочности смещается в область более тугоплавкого компонента. При наличии минимума на кривой соли-
дуса (это частое явление при близкой Тпл компонентов и их изоморфных решетках) происходит раздвоение максимума свойств. В этом случае более жаропрочными являются малолегированные сплавы. Раздвоение максимума на кривых изотермической жаропрочности по мере повышения температуры наблюдается в эвтектических системах.
86

Рис. 16.7. Изотермы жаропрочности бинарных сплавов:
с непрерывными рядами твердых растворов (а, б); с эвтектиками со значительной (в) и малой (г) растворимостью в твердом состоянии;
сперитектиками (д, е); с промежуточными конгруэнтными соединениями
сширокой (ж), узкой (з) и очень узкой (и) областью гомогенности
(сплошные линии отжиг, пунктир закалка)
87

В случае перитектики, по мере роста температуры, наблюдается смещение максимума жаропрочности в сторону более тугоплавкого компонента. В системах, содержащих химические соединения, с ростом температуры максимум жаропрочности локализуется вблизи состава, отвечающего химическому соединению.
Из анализа графиков на рис. 16.7 можно сделать вывод о том, что легирование усиливает жаропрочность, при этом необходимо оптимальное легирование, обеспечивающее максимальную жаропрочность.
Растворимость и распределение легирующих элементов, их влияние на свойства. Хорошо известно, что любой конструкционный материал является сплавом, обладающим определенными, часто основными механическими свойствами. При создании нового материала приходится решать задачу о соотношении его прочности, пластичности и стоимости. Постоянно стоит вопрос об экономно легированных сплавах, т.е. сплавах, обладающих минимальной стоимостью при заданных прочности и пластичности. Механические свойства существенно зависят от количества введенных легирующих элементов и от соотношения количества введенного элемента к его равновесной растворимости в основе. Выше было показано, как изменяются прочность и жаропрочность в зависимости от состава бинарных сплавов. Во всех случаях важную роль играет величина равновесной растворимости легирующего элемента. Более того, важны величины растворимости легирующего элемента в твердой и жидкой фазах и соотношение этих растворимостей. Если обозначим через предельную растворимость В в А в твердой фазе при температуре фазового превращения (или фиксированной температуре), а через – предельную растворимость В в
А в жидкой фазе при той же температуре, то величина kr αβ опи-
сывает соотношения растворимостей и называется коэффициентом распределения легирующего элемента в твердой фазе. Как будет показано ниже, величины и kr можно использовать для оценки влияния легирующих элементов на механические свойства разрабатываемого сплава.
88

С точки зрения оценки коэффициента распределения kr большинство известных бинарных систем сплавов (рис. 16.8) можно разбить на две группы: kr 1 (эвтектики, твердые растворы с ниспадающей линией солидуса при легировании) и kr 1 (перитектики, твердые растворы с возрастающей линией солидуса при легировании).
а |
б |
в |
г |
Рис. 16.8. Соотношения растворимостей и в различных бинарных системах: а – эвтектика, б – перитектика, в, г – непрерывные твердые растворы
Рассмотрим характер распределения легирующей добавки в основе при затвердевании сплавов для случая kr 1 на примере эвтектической системы с ограниченной растворимостью компонентов в твердом состоянии. Характер изменения концентрации растворенного компонента В в жидкой и твердой фазах при охлаждении расплава показан на рис. 16.9, а. Концентрация В в жидкой фазе при охлаждении возрастает (линия ликвидуса) в большей степени, чем в твердой (линия солидуса) и, следовательно, при реальном (неравновесном) затвердевании периферийная часть кристаллитов (зерен) будет обогащена элементом В.
A |
%B A |
%B |
аб
Рис. 16.9. Изменение концентрации легирующего элемента В при затвердевании сплавов
89
Наоборот, в случае kr > 1, как видно на рис.16.9, б, при реальном затвердевании перитектики, компонентом В будет обогащена центральная, а не периферийная часть кристаллитов – зерен.
Аналогичное распределение легирующего компонента будет происходить и в сплавах с непрерывной растворимостью компонентов в твердом растворе, диаграммы которых приведены на рис.16.8, б и в.
Характер распределения легирующего элемента, т.е. величина коэффициента распределения kr определяет уровень механических свойств сплавов. Например, при kr << 1 компонент В распределяется в основном вблизи границ. При этом зерно слабо упрочняется, но сплав в целом из-за сегрегации В вблизи границ может охрупчиваться. В данном случае компонент В – скорее вредная примесь, нежели легирующий элемент. Наоборот, при kr 1 компонент В распределен в основном в теле зерна. При этом зерно значительно упрочняется и даже возможно некоторое улучшение пластичности или ее сохранение на уровне пластичности основы из-за отсутствия сегрегаций на границах зерна.
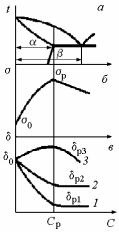
Таким образом, тенденции изменения механических свойств основы при легировании можно спрогнозировать на основе значений и kr в данной бинарной системе элементов. Многочисленные исследования, обобщенные Б.Б. Гуляевым, показали, что для двойных систем, имеющих схожие начальные участки (углы) диаграмм состояния, можно сделать некоторые обобщающие построения в координатах «пределы растворимости в основе –и механические свойства на пределе растворимости», показанные на примере диаграммы состояния эвтектического типа (рис. 16.10,а) с ограниченной растворимостью компонента В в основе А.
На рис.16.10, б временное сопротивление (предел прочности) основы – 0, а
90
