
- •Основные законы химии
- •Моль. Молярная масса
- •Относительная атомная и молекулярная массы
- •Газовые законы
- •1. Закон о суммарном давлении смеси газов: давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений газов, составляющих смесь
- •Закон эквивалентов
- •Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Строение атома
- •Модели Томсона и Резерфорда
- •Закон Мозли
- •Электронная оболочка атомов по Бору
- •Представления квантовой механики
- •Современная модель состояния электрона в атоме
- •Строение электронных оболочек атомов
- •Способы записи электронных конфигураций атомов и ионов
- •Периодический закон и периодическая система элементов д.И. Менделеева в свете учения о строении атомов
- •Свойства атомов. Их периодичность
- •Химическая связь и строение молекул
- •Ковалентная связь
- •Метод валентных связей
- •Сигма () и пи ()-связи
- •Донорно-акцепторная связь
- •Свойства ковалентной связи
- •Полярные и неполярные молекулы
- •Относительная электроотрицательность атомов
- •Ионная связь
- •Гибридизация атомных орбиталей
- •Гибридизация орбиталей и пространственная конфигурация молекул
- •Металлическая связь
- •Водородная связь
- •Типы кристаллических решеток
- •Валентность
- •Степень окисления
- •Комплексные соединения (комплементарность) Структура комплексных соединений
- •Хелаты и внутрикомплексные соединения
- •Реакции образования комплексных соединений
- •Номенклатура комплексных соединений
- •Пространственное строение и изомерия комплексных соединений
- •Диссоциация комплексных соединений в растворах. Константа нестойкости. Константа устойчивости
- •Связь в комплексных ионах
- •Реакции с участием комплексных соединений
- •1) Реакции обмена
- •2) Окислительно-восстановительные реакции
- •Элементы химической термодинамики Основные понятия
- •Внутренняя энергия. Первый закон термодинамики. Энтальпия
- •Закон Гесса. Следствия из него
- •Второй закон термодинамики. Энтропия
- •Термодинамические потенциалы
- •14 Типы реакций, различающиеся возможностьюи условиями протекания в зависимости от характера изменения ∆н и ∆s
- •Химическая кинетика Основные понятия
- •Скорость химической реакции
- •Зависимость скорости реакции от концентрации реагентов
- •Влияние температуры на скорость реакции
- •Дисперсные системы
- •Классификация дисперсных систем
- •Классификация дисперсных систем
- •Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •Количественные характеристики дисперсных систем
- •Устойчивость дисперсных систем
- •Применение
- •Растворы Растворы в природе. Теории растворов
- •Механизм процесса растворения
- •Тепловые эффекты при растворении
- •Ненасыщенные, насыщенные и пересыщенные растворы
- •Растворимость различных веществ в воде
- •Выражение количественного состава растворов
- •Разбавленные растворы неэлектролитов и их свойства
- •Эбуллиоскопическая и криоскопическая константы
- •Растворы электролитов и их свойства
- •Диссоциация воды. Водородный показатель
- •Гидролиз солей
- •Буферные растворы
- •Водородный показатель (рН) растворов
- •Свойства кислотно-основных индикаторов
- •Применение
- •Окислительно-восстановительные реакции
- •Распространенные окислители и их продукты
- •Важнейшие восстановители и окислители
- •Методы составления уравнений окислительно-восстановительных реакций
- •Влияние среды на протекание окислительно-восстановительных реакций
- •Эквивалентные массы окислителя и восстановителя
- •Классификация окислительно-восстановительных реакций
- •4) Особые случаи овр:
- •Электрохимические системы Общая характеристика
- •Электродный потенциал. Измерение электродных потенциалов
- •Ряд стандартных электродных потенциалов (напряжений). Уравнение Нернста
- •Ряд напряжений металлов
- •Гальванические элементы, их электродвижущая сила
- •Аккумуляторы
- •Характеристики аккумулятора Эдисона и свинцового аккумулятора
- •Топливные элементы
- •Электролиз
- •Законы электролиза
- •Применение электролиза
- •Высокомолекулярные соединения (вмс) или полимеры
- •Физические свойства
- •Классификация
- •Полимеризационные полимеры
- •Поликонденсационные полимеры
- •Применение
- •Олигомеры
Ряд стандартных электродных потенциалов (напряжений). Уравнение Нернста
Располагая металлы в порядке возрастания их стандартных электродных потенциалов, получают ряд напряжений Николая Николаевича Бекетова (1827-1911), или ряд стандартных электродных потенциалов. Числовые значения стандартных электродных потенциалов для ряда технически важных металлов приведены в таблице.
Ряд напряжений металлов
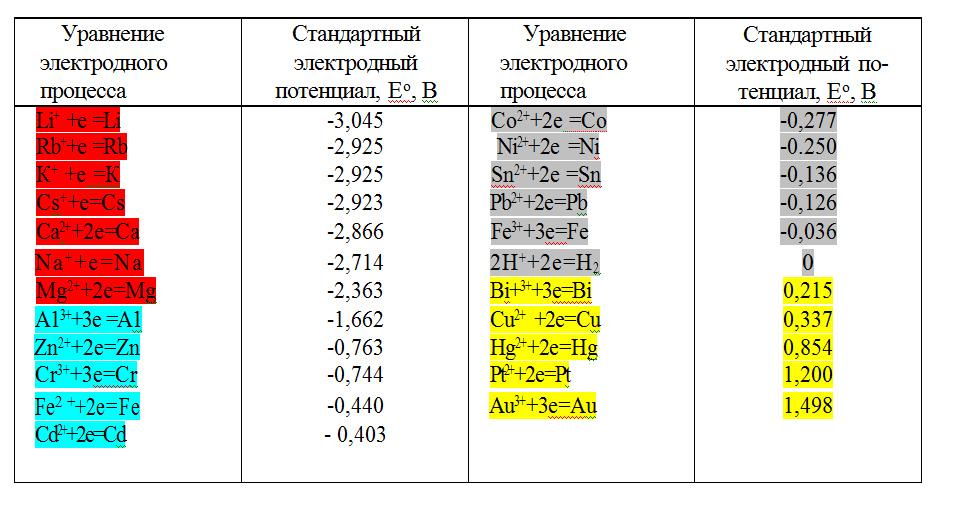
Ряд напряжений характеризует некоторые свойства металлов:
|
Николай Николаевич Бекетов(1827-1911) |
1. Чем меньшее значение имеет электродный потенциал металла, тем он химически активнее, легче окисляется и труднее восстанавливается из своих ионов. Активные металлы в природе существуют только в виде соединений Na, K, ..., встречаются в природе, как в виде соединений, так и в свободном состоянии Cu, Ag, Hg; Au, Pt - только в свободном состоянии;
2. Металлы, имеющие более отрицательный электродный потенциал, чем магний, вытесняют водород из воды;
3. Металлы, стоящие в ряду напряжений до водорода, вытесняют водород из растворов разбавленных кислот (анионы которых не проявляют окислительных свойств);
4. Каждый металл ряда, не разлагающий воду, вытесняет металлы, имеющие более положительные значения электродных потенциалов из растворов их солей;
5. Чем больше отличаются металлы значениями электродных потенциалов, тем большее значение э.д.с. будет иметь построенный из них гальванический элемент.
Зависимость величины электродного потенциала (Е) от природы металла, активности его ионов в растворе и температуры выражается уравнением Нернста
ЕМе = ЕоМе + RTln(aМеn+)/nF,
где ЕоМе – стандартный электродный потенциал металла, aMen+ – активность ионов металла в растворе. При стандартной температуре 25 оС, для разбавленных растворов заменяя активность (а) концентрацией (с), натуральный логарифм десятичным и подставляя значения R , T и F, получим
ЕМе = ЕоМе + (0,059/n )lgс.
Например, для цинкового электрода, помещенного в раствор своей соли, концентрацию гидратированных ионов Zn2+× mH2O сокращенно обозначим Zn2+ , тогда
ЕZn = ЕоZn + (0,059/n) lg[ Zn2+].
Если [Zn2+] = 1 моль/дм3, то ЕZn = Е оZn.
Гальванические элементы, их электродвижущая сила
Два металла, погруженные в растворы своих солей, соединенные проводником, образуют гальванический элемент. Первый гальванический элемент был изобретен Александром Вольтом в 1800 г. Элемент состоял из медных и цинковых пластинок, разделенных сукном, смоченным раствором серной кислоты. При последовательном соединении большого числа пластинок элемент Вольта обладает значительной электродвижущей силой (э.д.с.).
Возникновение электрического тока в гальваническом элементе обусловлено разностью электродных потенциалов взятых металлов и сопровождается химическими превращениями, протекающими на электродах. Рассмотрим работу гальванического элемента на примере медно-цинкового элемента (Дж. Даниэля – Б.С. Якоби).

Схема медно-цинкового гальванического элемента Даниэля-Якоби
|
Борис Семенович Якоби (Мориц Герман)(1801-1874) |
На цинковом электроде, опущенном в раствор сульфата цинка (с = 1 моль/дм3), происходит окисление цинка (растворение цинка) Znо - 2e = Zn2+. Электроны поступают во внешнюю цепь. Zn – источник электронов. Источник электронов принято считать отрицательным электродом – анодом. На электроде из меди, погруженном в раствор сульфата меди (с = 1 моль/дм3) происходит восстановление ионов металла. Атомы меди осаждаются на электроде Cu2+ + 2e = Cuо. Медный электрод положительный. Он является катодом. Одновременно часть ионов SO42- переходят через солевой мостик в сосуд с раствором ZnSO4. Сложив уравнения процессов, протекающих на аноде и катоде, получим суммарное уравнение
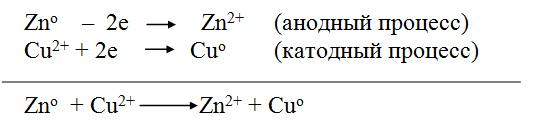
или в молекулярной форме
![]()
Это обычная окислительно - восстановительная реакция, протекающая на границе металл-раствор. Электрическая энергия гальванического элемента получается за счёт химической реакции. Рассмотренный гальванический элемент можно записать в виде краткой электрохимической схемы
(-) Zn/Zn2+//Cu2+/Cu (+).
Необходимым условием работы гальванического элемента является разность потенциалов, она называется электродвижущей силой гальванического элемента (э.д.с.). Э.д.с. всякого работающего гальванического элемента величина положительная. Для вычисления э.д.с. гальванического элемента надо из величины более положительного потенциала отнять величину менее положительного потенциала. Так э.д.с. медно–цинкового гальванического элемента при стандартных условиях (t = 25 оС, с = 1 моль/дм3, Р = 1 атм ) равна разности между стандартными электродными потенциалами меди (катода) и цинка (анода), то есть
э.д.с. = ЕоСu2+/Cu - ЕoZn2+/Zn = +0,34 В – (-0,76 В) = +1,10 В.
В паре с цинком ион Cu2+ восстанавливается.
Необходимую для работы разность электродных потенциалов можно создать, используя один и тот же раствор разной концентрации и одинаковые электроды. Такой гальванический элемент называется концентрационным, а работает он за счет выравнивания концентраций раствора. Примером может служить элемент, составленный из двух водородных электродов
Pt, H2 / H2SO4 (с`) // H2SO4 (с``) /H2, Pt,
где с` = [H+]`; с`` = [H+]``.
Если р = 101 кПа, с` < с``, то его э.д.с. при 25 оС определяется уравнением
Е = 0,059lg(с``/с`).
При с` = 1 моль-ион/дм3 э.д.с. элемента определяется концентрацией водородных ионов во втором растворе, то есть Е = 0,059lgс`` = -0,059 pH.
Определение концентрации ионов водорода и, следовательно, рН среды измерением э.д.с. соответствующего гальванического элемента называется потенциометрией.
