
- •Основные законы химии
- •Моль. Молярная масса
- •Относительная атомная и молекулярная массы
- •Газовые законы
- •1. Закон о суммарном давлении смеси газов: давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений газов, составляющих смесь
- •Закон эквивалентов
- •Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Строение атома
- •Модели Томсона и Резерфорда
- •Закон Мозли
- •Электронная оболочка атомов по Бору
- •Представления квантовой механики
- •Современная модель состояния электрона в атоме
- •Строение электронных оболочек атомов
- •Способы записи электронных конфигураций атомов и ионов
- •Периодический закон и периодическая система элементов д.И. Менделеева в свете учения о строении атомов
- •Свойства атомов. Их периодичность
- •Химическая связь и строение молекул
- •Ковалентная связь
- •Метод валентных связей
- •Сигма () и пи ()-связи
- •Донорно-акцепторная связь
- •Свойства ковалентной связи
- •Полярные и неполярные молекулы
- •Относительная электроотрицательность атомов
- •Ионная связь
- •Гибридизация атомных орбиталей
- •Гибридизация орбиталей и пространственная конфигурация молекул
- •Металлическая связь
- •Водородная связь
- •Типы кристаллических решеток
- •Валентность
- •Степень окисления
- •Комплексные соединения (комплементарность) Структура комплексных соединений
- •Хелаты и внутрикомплексные соединения
- •Реакции образования комплексных соединений
- •Номенклатура комплексных соединений
- •Пространственное строение и изомерия комплексных соединений
- •Диссоциация комплексных соединений в растворах. Константа нестойкости. Константа устойчивости
- •Связь в комплексных ионах
- •Реакции с участием комплексных соединений
- •1) Реакции обмена
- •2) Окислительно-восстановительные реакции
- •Элементы химической термодинамики Основные понятия
- •Внутренняя энергия. Первый закон термодинамики. Энтальпия
- •Закон Гесса. Следствия из него
- •Второй закон термодинамики. Энтропия
- •Термодинамические потенциалы
- •14 Типы реакций, различающиеся возможностьюи условиями протекания в зависимости от характера изменения ∆н и ∆s
- •Химическая кинетика Основные понятия
- •Скорость химической реакции
- •Зависимость скорости реакции от концентрации реагентов
- •Влияние температуры на скорость реакции
- •Дисперсные системы
- •Классификация дисперсных систем
- •Классификация дисперсных систем
- •Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •Количественные характеристики дисперсных систем
- •Устойчивость дисперсных систем
- •Применение
- •Растворы Растворы в природе. Теории растворов
- •Механизм процесса растворения
- •Тепловые эффекты при растворении
- •Ненасыщенные, насыщенные и пересыщенные растворы
- •Растворимость различных веществ в воде
- •Выражение количественного состава растворов
- •Разбавленные растворы неэлектролитов и их свойства
- •Эбуллиоскопическая и криоскопическая константы
- •Растворы электролитов и их свойства
- •Диссоциация воды. Водородный показатель
- •Гидролиз солей
- •Буферные растворы
- •Водородный показатель (рН) растворов
- •Свойства кислотно-основных индикаторов
- •Применение
- •Окислительно-восстановительные реакции
- •Распространенные окислители и их продукты
- •Важнейшие восстановители и окислители
- •Методы составления уравнений окислительно-восстановительных реакций
- •Влияние среды на протекание окислительно-восстановительных реакций
- •Эквивалентные массы окислителя и восстановителя
- •Классификация окислительно-восстановительных реакций
- •4) Особые случаи овр:
- •Электрохимические системы Общая характеристика
- •Электродный потенциал. Измерение электродных потенциалов
- •Ряд стандартных электродных потенциалов (напряжений). Уравнение Нернста
- •Ряд напряжений металлов
- •Гальванические элементы, их электродвижущая сила
- •Аккумуляторы
- •Характеристики аккумулятора Эдисона и свинцового аккумулятора
- •Топливные элементы
- •Электролиз
- •Законы электролиза
- •Применение электролиза
- •Высокомолекулярные соединения (вмс) или полимеры
- •Физические свойства
- •Классификация
- •Полимеризационные полимеры
- •Поликонденсационные полимеры
- •Применение
- •Олигомеры
Химическая связь и строение молекул
Учение о химической связи – центральный вопрос современной химии. Без него нельзя понять причины многообразия химических соединений, механизм их образования, строение и реакционную способность.
Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное. Учение о строении атомов объясняет механизм образования молекул, а также природу химической связи.
У атома на внешнем энергетическом уровне может содержаться от одного до восьми электронов. Если число электронов на внешнем уровне атома максимальное, которое он может вместить, то такой уровень называется завершенным. Завершенные уровни характеризуются большой прочностью. Таковы внешние уровни атомов благородных газов: у гелия на внешнем уровне два электрона (s2), у остальных – по восемь электронов (ns2np6). Внешние уровни атомов других элементов незавершенные и в процессе химического взаимодействия они завершаются. Чтобы добиться этого состояния соответствующим атомам приходится разменивать свои электроны. И, как часто случается в жизни, «те, которые имеют меньше, отдают тем, кто имеет больше».
Ковалентная связь
В 1907 г. Н.А. Морозов и позднее в 1916-1918 г.г. американцы Дж. Льюис и И. Ленгмюр ввели представление об образовании химической связи общей электронной парой и предложили обозначать валентные электроны точками

Связь, образованная электронами, принадлежащими двум взаимодействующим атомам, называется ковалентной. По представлениям Морозова-Льюиса-Ленгмюра:
при взаимодействии атомов между ними формируются поделенные – общие – электронные пары, принадлежащие обоим атомам;
за счет общих электронных пар каждый атом в молекуле приобретает на внешнем энергетическом уровне восемь электронов, s2p6;
3) конфигурация s2 p6 – это устойчивая конфигурация инертного газа и в процессе химического взаимодействия каждый атом стремится ее достигнуть;
4) количество общих электронных пар определяет ковалентность элемента в молекуле и равно оно числу электронов у атома, недостающих до восьми;
5) валентность свободного атома определяется числом неспаренных электронов.
Изображать химические связи принято по разному:
с помощью электронов в виде точек, поставленных у химического символа элемента. Тогда образование молекулы водорода можно показать схемой
Н + Н Н : Н;
с помощью квантовых ячеек (орбиталей) как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке
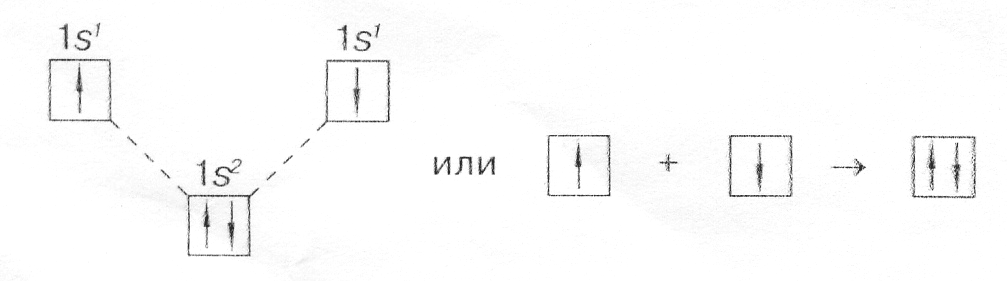
Схема расположения, показывает, что молекулярный энергетический уровень ниже исходных атомных уровней, а значит, молекулярное состояние вещества более устойчиво, чем атомное;
часто, особенно в органической химии, ковалентную связь изображают черточкой (например, Н-Н), которая символизирует пару электронов.
Ковалентная связь в молекуле хлора также осуществляется с помощью двух общих электронов, или электронной пары.

Как видно, каждый атом хлора имеет три неподеленные пары и один неспаренный электрон. Образование химической связи происходит за счет неспаренных электронов каждого атома. Неспаренные электроны связываются в общую пару электронов, называемую также поделенной парой.
