
- •Основные законы химии
- •Моль. Молярная масса
- •Относительная атомная и молекулярная массы
- •Газовые законы
- •1. Закон о суммарном давлении смеси газов: давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений газов, составляющих смесь
- •Закон эквивалентов
- •Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Строение атома
- •Модели Томсона и Резерфорда
- •Закон Мозли
- •Электронная оболочка атомов по Бору
- •Представления квантовой механики
- •Современная модель состояния электрона в атоме
- •Строение электронных оболочек атомов
- •Способы записи электронных конфигураций атомов и ионов
- •Периодический закон и периодическая система элементов д.И. Менделеева в свете учения о строении атомов
- •Свойства атомов. Их периодичность
- •Химическая связь и строение молекул
- •Ковалентная связь
- •Метод валентных связей
- •Сигма () и пи ()-связи
- •Донорно-акцепторная связь
- •Свойства ковалентной связи
- •Полярные и неполярные молекулы
- •Относительная электроотрицательность атомов
- •Ионная связь
- •Гибридизация атомных орбиталей
- •Гибридизация орбиталей и пространственная конфигурация молекул
- •Металлическая связь
- •Водородная связь
- •Типы кристаллических решеток
- •Валентность
- •Степень окисления
- •Комплексные соединения (комплементарность) Структура комплексных соединений
- •Хелаты и внутрикомплексные соединения
- •Реакции образования комплексных соединений
- •Номенклатура комплексных соединений
- •Пространственное строение и изомерия комплексных соединений
- •Диссоциация комплексных соединений в растворах. Константа нестойкости. Константа устойчивости
- •Связь в комплексных ионах
- •Реакции с участием комплексных соединений
- •1) Реакции обмена
- •2) Окислительно-восстановительные реакции
- •Элементы химической термодинамики Основные понятия
- •Внутренняя энергия. Первый закон термодинамики. Энтальпия
- •Закон Гесса. Следствия из него
- •Второй закон термодинамики. Энтропия
- •Термодинамические потенциалы
- •14 Типы реакций, различающиеся возможностьюи условиями протекания в зависимости от характера изменения ∆н и ∆s
- •Химическая кинетика Основные понятия
- •Скорость химической реакции
- •Зависимость скорости реакции от концентрации реагентов
- •Влияние температуры на скорость реакции
- •Дисперсные системы
- •Классификация дисперсных систем
- •Классификация дисперсных систем
- •Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •Количественные характеристики дисперсных систем
- •Устойчивость дисперсных систем
- •Применение
- •Растворы Растворы в природе. Теории растворов
- •Механизм процесса растворения
- •Тепловые эффекты при растворении
- •Ненасыщенные, насыщенные и пересыщенные растворы
- •Растворимость различных веществ в воде
- •Выражение количественного состава растворов
- •Разбавленные растворы неэлектролитов и их свойства
- •Эбуллиоскопическая и криоскопическая константы
- •Растворы электролитов и их свойства
- •Диссоциация воды. Водородный показатель
- •Гидролиз солей
- •Буферные растворы
- •Водородный показатель (рН) растворов
- •Свойства кислотно-основных индикаторов
- •Применение
- •Окислительно-восстановительные реакции
- •Распространенные окислители и их продукты
- •Важнейшие восстановители и окислители
- •Методы составления уравнений окислительно-восстановительных реакций
- •Влияние среды на протекание окислительно-восстановительных реакций
- •Эквивалентные массы окислителя и восстановителя
- •Классификация окислительно-восстановительных реакций
- •4) Особые случаи овр:
- •Электрохимические системы Общая характеристика
- •Электродный потенциал. Измерение электродных потенциалов
- •Ряд стандартных электродных потенциалов (напряжений). Уравнение Нернста
- •Ряд напряжений металлов
- •Гальванические элементы, их электродвижущая сила
- •Аккумуляторы
- •Характеристики аккумулятора Эдисона и свинцового аккумулятора
- •Топливные элементы
- •Электролиз
- •Законы электролиза
- •Применение электролиза
- •Высокомолекулярные соединения (вмс) или полимеры
- •Физические свойства
- •Классификация
- •Полимеризационные полимеры
- •Поликонденсационные полимеры
- •Применение
- •Олигомеры
Эквивалентные массы окислителя и восстановителя
Эквивалентная масса окислителя - это отношение молярной массы окислителя к количеству электронов, принятых одним молем окислителя.
Мэ(окисл.) = М/число принятых электронов.
Эквивалентная масса восстановителя - это отношение молярной массы восстановителя к числу потерянных электронов одним молем восстановителя.
Мэ(восст.) = М/число потерянных электронов.
Классификация окислительно-восстановительных реакций
В зависимости от того между какими атомами и в каких веществах происходит переход электронов все окислительно-восстановительные реакции можно разделить на: 1) межмолекулярные окислительно-восстановительные реакции. Реакции, в ходе которых окислитель и восстановитель находятся в разных молекулах, называются межмолекулярными. Это реакции, в ходе которых переход электронов происходит между частицами различных веществ
Mn+4O2 + 4HCl-1 = Cl02 ↑ + Mn+2Cl2 + 2H2O
электронный баланс
Mn4+
+ 2e = Mn2+
1
2Cl-
-
2e = Cl2о
1
2) внутримолекулярные. Реакции, в ходе которых окислитель и восстановитель (атомы разных элементов) находятся в составе одной и той же молекулы, называются внутримолекулярными
(N-3H4)2 Cr2+6O7 = N02 + Cr2+3O3 + 4H2О
электронный баланс
2Cr6+
+
6e
=2Cr3+
1
2N3- -6e = N02 1
2КCl+5O3-2 = 2KCl- + 3O2о
электронный баланс
Cl5+
+ 6e
= Cl-
1
6O2-
– 6e
= 3O2о
1
3) дисмутационные (диспропорционирования). Реакции, в ходе которых происходит изменение степеней окисления одного и того же элемента в одной и той же молекуле, называются реакциями диспропорционирования (дисмутации, самоокисления-самовосстановления), то есть атомы или ионы одного и того и того же элемента, содержащиеся в одной молекуле, являются и окислителем и восстановителем.
4KCl+5O3
= KCl-
+ 3KCl+7O4
электронный баланс
Cl5+ + 6e = Cl- 1 Cl5+ – 2e = Cl7+ 3
Диспропорционировать могут вещества, один из элементов которых находится в промежуточной степени окисления, так как степень окисления одной части атомов понижается за счет другой части таких же атомов, степень окисления которых повышается. Примером может служить превращение манганата калия (Mn+4O2 → K2Mn+6O4→ KMn+7O4); азотистой кислоты (N+2O¬HN+3O2 → HN+5O3); хлората калия (KCℓ- → KCℓ+5O3 → KСℓ+7O4) и др.
4) Особые случаи овр:
- восстановитель и среда одно и то же вещество
6HCℓ + K2Cr2O7 + 8HCℓ = 3Cℓ2 + 2KCℓ + 2CrCℓ3 + 7H2O
восстановитель окислитель среда
электронный баланс
2Cr6+
+ 6e
= 2Cr3+
2 1
2Cl- - 2e = Cl2o 6 3
- окислитель и среда одно и то же вещество.
а) реакции с азотной кислотой
Азотная кислота, как правило, является окислителем. Окислителем в молекуле азотной кислоты является N+5, а H+ не принимает участие в окислительно-восстанови-тельных реакциях, поэтому из азотной кислоты металлы не вытесняют молекулярный водород. Окислительная способность HNO3 усиливается с ростом ее концентрации. При взаимодействии HNO3 с металлами образуются нитраты соответствующих металлов. Состав остальных продуктов восстановления HNO3 зависит от активности восстановителя и концентрации кислоты, чем активнее восстановитель и более разбавлена кислота, тем глубже протекает восстановление N+5 в HNO3, образуя N+4O2; N+2O; N2+1O; N20;
N-3H3(NH4NO3)

При действии сильно разбавленной азотной кислоты на активные металлы образуется нитрат аммония
![]()
4Ca0 + 10HN+5O3(оч.разб.) = 4Ca+2(NO3)2 + N-3H4NO3 + 3H2O
электронный баланс
|
Ca0 - 2ē = Ca2+ |
4 |
|
N5+ + 8ē = N-3 |
1 |
метод полуреакций
|
Ca0 - 2ē = Ca2+ |
4 |
|
NO3- + 10H+ + 8ē = NH4+ + 3H2O |
1 |
–––––––––––––––––––––––––––––––––
4Ca0 + NO3- + 10H+ = 4Ca2+ + NH4+ + 3H2O
При действии разбавленной азотной кислоты на активные металлы – оксид азота(I) или свободный азот
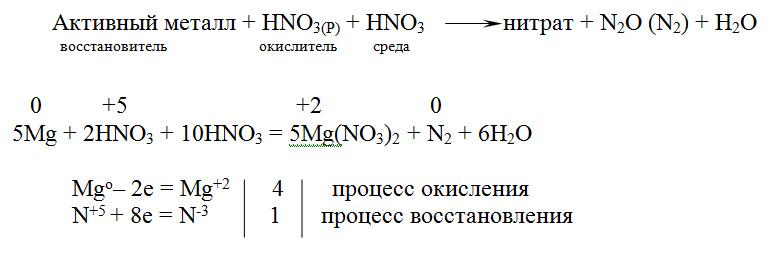
5Co0 + 12HN+5O3(разб.) = 5Co+2(NO3)2 + N20 + 6H2O
электронный баланс
|
Co0 - 2ē = Co2+ |
5 |
|
2N5+ + 10ē = N20 |
1 |
метод полуреакций
|
Co0 - 2ē = Co2+ |
5 |
|
2NO3- + 12H+ + 10ē = N2 + 6H2O |
1 |
–––––––––––––––––––––––––––––––––
5Co0 + 2NO3- + 12H+ = 5Co2+ + N2 + 6H2O
При действии разбавленной азотной кислоты на малоактивные металлы может выделяться оксид азота(II)
![]()
0 +5 + +2
3Ag + HNO3(P) + 3HNO3 = 3AgNO3 + NO + 2H2O
электронный баланс
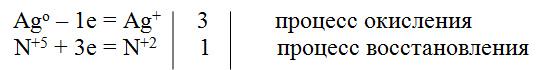
При действии концентрированной азотной кислоты на активные металлы образуется оксид азота(I)
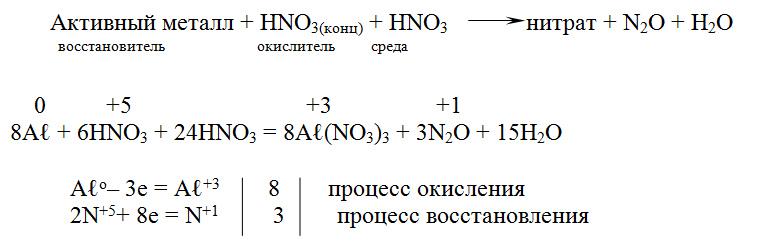
а в случае малоактивных металлов образуется оксид азота(IV)

Cu0 + 4HN+5O3(конц.) = Cu+2(NO3)2 + 2N+4O2 + 2H2O
электронный баланс
|
Cu0 – 2ē = Cu2+ |
1 |
|
N5+ + ē = N4+ |
2 |
метод полуреакций
|
Cu0 – 2ē = Cu2+ |
1 |
|
NO3- + 2H+ + ē = NO2 + H2O |
2 |
––––––––––––––––––––––––––––––––
Cu0 + 2NO3- + 4H+ = Cu2+ + 2NO2 + 2H2O
3Ag0 + 4HN+5O3(конц.) = 3Ag+1NO3 + N+2O + 2H2O
электронный баланс
|
Ag0 - ē = Ag+ |
3 |
|
N5+ + 3ē = N2+ |
1 |
метод полуреакций
|
Ag0 - ē = Ag+ |
3 |
|
NO3- + 4H+ + 3ē = NO + 2H2O |
1 |
––––––––––––––––––––––––––––––
3Ag0 + NO3- + 4H+ = 3Ag+ + NO + 2H2O
Чем активнее металл, реагирующий с кислотой, и чем более разбавлен ее раствор, тем полнее протекает восстановление. Например, реакции азотной кислоты разной концентрации с цинком
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2 + 2H2O
3Zn + 8HNO3(40 %) = 3Zn(NO3)2 + 2NO + 4H2O
4Zn + 10HNO3(20 %) = 4Zn(NO3)2 + N2O + 5H2O
5Zn + 12HNO3(6 %) = 5Zn(NO3)2 + N2 + 6H2O
4Zn + 10HNO3(0.5 %) = 4Zn(NO3)2 + NH4NO3 + 3H2O
С неметаллами HNO3 восстанавливается чаще до NO или NO2(реже). При этом неметалл полностью окисляется и превращается в высшую кислоту или в ангидрид, если кислота неустойчива
0 +5 +5 +2
3P + 5HNO3(P) + 2H2O = 3H3PO4 + 5NO
электронный баланс
![]()
3C0 + 4HN+5O3 = 3C+4O2 + 4N+2O + 2H2O
электронный баланс
|
C0 - 4ē = C4+ |
3 |
|
N5+ + 3ē = N2+ |
4 |
метод полуреакций
|
C0 + 2H2O - 4ē = CO2 + 4H+ |
3 |
|
NO3- + 4H+ + 3ē = NO + 2H2O |
4 |
–––––––––––––––––––––––––––––––––––––––––––––
3C0 + 6H2O + 4NO3- + 16H+ = 3CO2 + 12H+ + 4NO + 8H2O
или 3C0 + 4NO3- + 4H+ = 3CO2 + 4NO + 2H2O
б) реакции с серной кислотой
В разбавленной серной кислоте окислителем является ион водорода (H+) и поэтому разбавленная H2SO4 взаимодействует только с активными металлами и при этом выделяется молекулярный водород
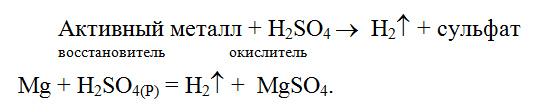
В концентрированной серной кислоте окислителем является S+6–ионы. Поэтому концентрированная серная кислота реагирует с активными и неактивными металлами, неметаллами и сложными веществами, восстанавливаясь при этом до Н2S, S и SO2, соответственно. Состав продуктов восстановления определяется главным образом активностью восстановителя, а также соотношением количеств восстановителя и серной кислоты, концентрацией кислоты и температурой системы. Чем активнее восстановитель и выше концентрация кислоты, тем более глубоко протекает восстановление.

Малоактивные металлы, а также бромоводород и некоторые неметаллы восстанавливают концентрированную серную кислоту до SO2

- компропорционированния (репропорционирование, конмутации, контрдиспропорционирования) – реакции, в которых участвуют два вещества, cодержащие атомы одного и того же элемента в разных степенях окисления, то есть окислитель и восстановитель один и тот же элемент, входящий в состав различных молекул в разных степенях окисления или реакции внутримолекулярного окисления- восстановления, в результате которых происходит выравнивание степеней окисления атомов одного и того же элемента
Cu0 + Cu+2Cl2 = 2Cu+1Cl
электронный баланс
Cu+2
+
е
= Cu+1
1
Cu0 - е = Cu+1 1
- реакции с участием озона. Озон является окислителем. В окислительно-восстанови-тельных реакциях с участием озона всегда выделяется кислород
![]()
восстановитель окислитель среда
электронный баланс
![]()
- реакции с участием пероксида водорода. Пероксид водорода содержит кислород в промежуточной степени окисления, поэтому в реакциях может выступать в роли окислителя, и в роли восстановителя, а так же участвовать в реакции диспропорционирования. Пероксид водорода восстанавливается в зависимости от среды
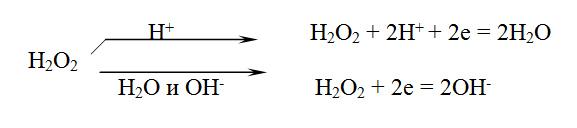
Обычно пероксид водорода используют как окислитель
H2O2 + 2HI- = I20 + 2H2O
электронный баланс
|
2I- - 2ē = I20 |
1 |
|
[O2]2- + 2ē = 2O2- |
1 |
метод полуреакций
|
2I- - 2ē = I20 |
1 |
|
H2O2 + 2H+ + 2ē = 2H2O |
1 |
––––––––––––––––––––––
2I- + H2O2 + 2H+ = I2 + 2H2O
2FeSO4 + H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O
восстановитель окислитель среда
![]()
2Fe2+ +H2O2 + 2H+ = 2Fe3+ + 2H2O.
В реакциях с сильным окислителем, таким, как перманганат калия KMnO4, персульфат аммония (NH4)2S2O8, пероксид водорода выступает как восстановитель, образуя кислород и воду
H2O2 + KMnO4 + H2SO4 = O2 + MnSO4 + K2SO4 + H2O
восстановитель окислитель среда
электронный баланс
|
[O2]2- - 2ē = O20 |
5 |
|
Mn7+ + 5ē = Mn2+ |
2 |
метод полуреакций
|
MnO4- + 8H+ + 5ē = Mn2+ + 4H2O |
2 |
|
H2O2 - 2ē = O2 + 2H+ |
5 |
––––––––––––––––––––––––––––––––––––––––––
2MnO4- + 5H2O2 + 16H+ = 2Mn2+ + 8H2O + 5O2 + 10H+
или 2MnO4- + 5H2O2 + 6H+ = 2Mn2+ + 8H2O + 5O2
5H2O2 + 2KMnO4 + 3H2SO4 = 5O2 + 2MnSO4 + K2SO4 + 8H2O
