
- •Основные законы химии
- •Моль. Молярная масса
- •Относительная атомная и молекулярная массы
- •Газовые законы
- •1. Закон о суммарном давлении смеси газов: давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений газов, составляющих смесь
- •Закон эквивалентов
- •Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Строение атома
- •Модели Томсона и Резерфорда
- •Закон Мозли
- •Электронная оболочка атомов по Бору
- •Представления квантовой механики
- •Современная модель состояния электрона в атоме
- •Строение электронных оболочек атомов
- •Способы записи электронных конфигураций атомов и ионов
- •Периодический закон и периодическая система элементов д.И. Менделеева в свете учения о строении атомов
- •Свойства атомов. Их периодичность
- •Химическая связь и строение молекул
- •Ковалентная связь
- •Метод валентных связей
- •Сигма () и пи ()-связи
- •Донорно-акцепторная связь
- •Свойства ковалентной связи
- •Полярные и неполярные молекулы
- •Относительная электроотрицательность атомов
- •Ионная связь
- •Гибридизация атомных орбиталей
- •Гибридизация орбиталей и пространственная конфигурация молекул
- •Металлическая связь
- •Водородная связь
- •Типы кристаллических решеток
- •Валентность
- •Степень окисления
- •Комплексные соединения (комплементарность) Структура комплексных соединений
- •Хелаты и внутрикомплексные соединения
- •Реакции образования комплексных соединений
- •Номенклатура комплексных соединений
- •Пространственное строение и изомерия комплексных соединений
- •Диссоциация комплексных соединений в растворах. Константа нестойкости. Константа устойчивости
- •Связь в комплексных ионах
- •Реакции с участием комплексных соединений
- •1) Реакции обмена
- •2) Окислительно-восстановительные реакции
- •Элементы химической термодинамики Основные понятия
- •Внутренняя энергия. Первый закон термодинамики. Энтальпия
- •Закон Гесса. Следствия из него
- •Второй закон термодинамики. Энтропия
- •Термодинамические потенциалы
- •14 Типы реакций, различающиеся возможностьюи условиями протекания в зависимости от характера изменения ∆н и ∆s
- •Химическая кинетика Основные понятия
- •Скорость химической реакции
- •Зависимость скорости реакции от концентрации реагентов
- •Влияние температуры на скорость реакции
- •Дисперсные системы
- •Классификация дисперсных систем
- •Классификация дисперсных систем
- •Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •Количественные характеристики дисперсных систем
- •Устойчивость дисперсных систем
- •Применение
- •Растворы Растворы в природе. Теории растворов
- •Механизм процесса растворения
- •Тепловые эффекты при растворении
- •Ненасыщенные, насыщенные и пересыщенные растворы
- •Растворимость различных веществ в воде
- •Выражение количественного состава растворов
- •Разбавленные растворы неэлектролитов и их свойства
- •Эбуллиоскопическая и криоскопическая константы
- •Растворы электролитов и их свойства
- •Диссоциация воды. Водородный показатель
- •Гидролиз солей
- •Буферные растворы
- •Водородный показатель (рН) растворов
- •Свойства кислотно-основных индикаторов
- •Применение
- •Окислительно-восстановительные реакции
- •Распространенные окислители и их продукты
- •Важнейшие восстановители и окислители
- •Методы составления уравнений окислительно-восстановительных реакций
- •Влияние среды на протекание окислительно-восстановительных реакций
- •Эквивалентные массы окислителя и восстановителя
- •Классификация окислительно-восстановительных реакций
- •4) Особые случаи овр:
- •Электрохимические системы Общая характеристика
- •Электродный потенциал. Измерение электродных потенциалов
- •Ряд стандартных электродных потенциалов (напряжений). Уравнение Нернста
- •Ряд напряжений металлов
- •Гальванические элементы, их электродвижущая сила
- •Аккумуляторы
- •Характеристики аккумулятора Эдисона и свинцового аккумулятора
- •Топливные элементы
- •Электролиз
- •Законы электролиза
- •Применение электролиза
- •Высокомолекулярные соединения (вмс) или полимеры
- •Физические свойства
- •Классификация
- •Полимеризационные полимеры
- •Поликонденсационные полимеры
- •Применение
- •Олигомеры
Связь в комплексных ионах
Что удерживает атомы в комплексном ионе? Существуют два возможных ответа. В некоторых комплексах, например в ионе [AlF6]3- связь между атомами обусловлена взаимным притяжением положительного иона Al3+ и отрицательно заряженных ионов F- . Следовательно, связь ионная. В других комплексных ионах, таких как [Fe(CN)6]3 -, налицо заметное обобщение электронов центрального атома-комплексообразователя и окружающих его групп. Следовательно, связь в основном ковалентная. При таком обобщении электрон или электронная пар присоединяющейся группы часть времени находится на орбите, принадлежащей центральному атому. В других случаях электронная пара образуется обоими атомами, участвующими в образовании химической связи.
Пространственная структура комплексных частиц может быть объяснена с позиций метода валентных связей (МВС). МВС для описания комплексных соединений разработал и предложил Л. Полинг. Основные положения его теории:
1) связь между комплексообразователем и лигандами донорно-акцепторная. Прочность связи зависит от степени перекрывания орбиталей;
2) орбитали комплексообразователя подвергаются гибридизации, что определяет пространственное строение комплекса;
3) дополнительное упрочнение комплекса обусловлено тем, что наряду с σ-связями могут возникать и π-связи;
4) магнитные свойства, комплексных соединений, объясняются наличием или отсутствием неспаренных электронов.
Этот метод предполагает, что комплексная частица возникает в результате образования ковалентных связей между комплексообразователем и лигандами. При этом ковалентная s-связь образуется в результате перекрывания вакантной орбитали атома (или иона) комплексообразователя (акцептора) с заполненными, т.е. содержащими неподеленные пары электронов, орбиталями лигандов (доноров). Максимально возможное число s-связей определяет координационное число комплексообразователя.
Поскольку при одинаковых лигандах образующиеся s-связи равноценны, то образование комплексной частицы сопровождается гибридизацией акцепторных орбиталей комплексообразователя. При координационном числе 4 чаще всего реализуется sp3 – гибридизация, что соответствует тетраэдрической координации лигандов, или dsp2 – гибридизация, отвечающая плоско-квадратной координации лигандов. Так, в комплексе [Zn(NH3)4]2+, ион Zn2+ является комплексообразователем. Нейтральный атом цинка имеет электронную структуру: 4s23d104p04d0; а ион Zn2+: 4s03d104p04d0. Таким образом, ион цинка предоставляет для электронных пар лигандов (условно показанных на схеме точками) одну 4s- и три 4p- орбитали.
[Zn(NH3)4]2+
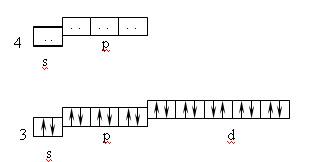
причем осуществляется sp3–гибридизация, ион [Zn(NH3)4]2+ обладает диамагнитными свойствами, так как нет неспаренных электронов.
Ионы d–элементов с четырьмя занятыми d–орбиталями (Pt2+, Pd2+, Au3+) при координационном числе 4 предоставляют для электронных пар лигандов одну d- , одну s- и две p-орбитали, например, в комплексе [Pt(NH3)4]2+, комплексообразователем является ион Pt2+. Нейтральный атом имеет электронную структуру: 6s14f145d96p06d0, а ион Pt2+: 6s04f145d86p06d0
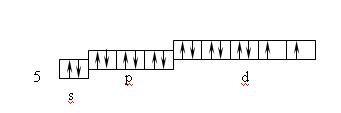
Лиганды NH3 связываясь с комплексообразователем, вызывают перераспределение электронов на его орбиталях.
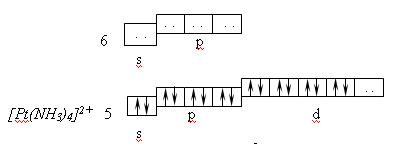
При этом осуществляется dsp2 -гибридизация. Комплекс [Pt(NH3)4]2+ - диамагнитен и в рамках МВС является внутриорбитальным.
При координационном числе 6 осуществляется октаэдрическая координация лигандов, которая определяется d2sp3 – или sp3d2 – гибридизацией. Такая координация имеет место, например в комплексе [Ni(NH3)6]2+. Комплексообразователем является ион Ni2+. Нейтральный атом никеля имеет электронную структуру: 4s23d84p04d0, а ион Ni2+ имеет следующую электронную конфигурацию: 4s03d84p04d0.
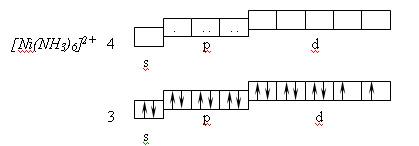
Лиганды NH3, входящие в состав комплексного иона, не вызывают перераспределения электронов комплексообразователя и образуют донорно-акцепторные связи с ним, используя свободные орбитали. Осуществляется sp3d2–гибридизация, ион [Ni(NH3)6]2+ обладает парамагнитными свойствами, то есть имеет два неспаренных электрона, которые придают повышенную реакционную способность и в рамках МВС относится к группе внешнеорбитальных комплексов.
Координационному числу 2 отвечает гибридизация sp–типа и линейная координация лигандов, например, в комплексе [Ag(NH3)2]+
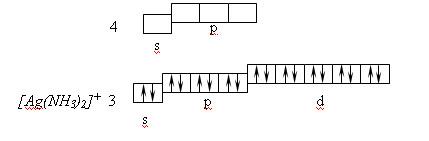
Рассмотренные примеры показывают, что МВС успешно объясняет определенные значения координационных чисел, геометрические формы комплексных частиц и магнитные свойства комплексных соединений.
С точки зрения МВС нельзя объяснить строение многих комплексных соединений, например «сандвичевых». Наиболее плодотворным в теории комплексных соединений, ведущим в настоящее время стал ММО. Молекулярные орбитали в комплексных соединениях образуются по тому же принципу и обладают теми же свойствами, что и молекулярные орбитали в двухатомных молекулах. Отличие их заключается в том, что молекулярные орбитали в комплексных соединениях являются многоцентровыми, делокализованными.
Теория кристаллического поля основана на представлениях об электростатической природе взаимодействия между центральным атомом и лигандами. Однако, в отличие от простой ионной теории, здесь учитывается различное пространственное расположение d-орбиталей и связанное с этим различное изменение энергии d-электронов центрального атома, вызываемое их отталкиванием от электронных облаков лигандов. Хотя теория кристаллического поля оказалась плодотворной в трактовке магнитных, оптических и некоторых других свойств комплексных соединений, она не смогла объяснить сам факт образования некоторых комплексов, например, так называемых «сандвичевых»- дибензолхрома ферроцена и их аналогов. Дело в том, что теория кристаллического поля, учитывая влияние лигандов на центральный атом, не принимает во внимание участия электронов лигандов в образовании химических связей с ним. Поэтому применение теории кристаллического поля ограничено, главным образом, комплексными соединениями с преимущественно ионным типом связи между центральным атомом и лигандами.
