
- •Основные законы химии
- •Моль. Молярная масса
- •Относительная атомная и молекулярная массы
- •Газовые законы
- •1. Закон о суммарном давлении смеси газов: давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений газов, составляющих смесь
- •Закон эквивалентов
- •Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Строение атома
- •Модели Томсона и Резерфорда
- •Закон Мозли
- •Электронная оболочка атомов по Бору
- •Представления квантовой механики
- •Современная модель состояния электрона в атоме
- •Строение электронных оболочек атомов
- •Способы записи электронных конфигураций атомов и ионов
- •Периодический закон и периодическая система элементов д.И. Менделеева в свете учения о строении атомов
- •Свойства атомов. Их периодичность
- •Химическая связь и строение молекул
- •Ковалентная связь
- •Метод валентных связей
- •Сигма () и пи ()-связи
- •Донорно-акцепторная связь
- •Свойства ковалентной связи
- •Полярные и неполярные молекулы
- •Относительная электроотрицательность атомов
- •Ионная связь
- •Гибридизация атомных орбиталей
- •Гибридизация орбиталей и пространственная конфигурация молекул
- •Металлическая связь
- •Водородная связь
- •Типы кристаллических решеток
- •Валентность
- •Степень окисления
- •Комплексные соединения (комплементарность) Структура комплексных соединений
- •Хелаты и внутрикомплексные соединения
- •Реакции образования комплексных соединений
- •Номенклатура комплексных соединений
- •Пространственное строение и изомерия комплексных соединений
- •Диссоциация комплексных соединений в растворах. Константа нестойкости. Константа устойчивости
- •Связь в комплексных ионах
- •Реакции с участием комплексных соединений
- •1) Реакции обмена
- •2) Окислительно-восстановительные реакции
- •Элементы химической термодинамики Основные понятия
- •Внутренняя энергия. Первый закон термодинамики. Энтальпия
- •Закон Гесса. Следствия из него
- •Второй закон термодинамики. Энтропия
- •Термодинамические потенциалы
- •14 Типы реакций, различающиеся возможностьюи условиями протекания в зависимости от характера изменения ∆н и ∆s
- •Химическая кинетика Основные понятия
- •Скорость химической реакции
- •Зависимость скорости реакции от концентрации реагентов
- •Влияние температуры на скорость реакции
- •Дисперсные системы
- •Классификация дисперсных систем
- •Классификация дисперсных систем
- •Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •Количественные характеристики дисперсных систем
- •Устойчивость дисперсных систем
- •Применение
- •Растворы Растворы в природе. Теории растворов
- •Механизм процесса растворения
- •Тепловые эффекты при растворении
- •Ненасыщенные, насыщенные и пересыщенные растворы
- •Растворимость различных веществ в воде
- •Выражение количественного состава растворов
- •Разбавленные растворы неэлектролитов и их свойства
- •Эбуллиоскопическая и криоскопическая константы
- •Растворы электролитов и их свойства
- •Диссоциация воды. Водородный показатель
- •Гидролиз солей
- •Буферные растворы
- •Водородный показатель (рН) растворов
- •Свойства кислотно-основных индикаторов
- •Применение
- •Окислительно-восстановительные реакции
- •Распространенные окислители и их продукты
- •Важнейшие восстановители и окислители
- •Методы составления уравнений окислительно-восстановительных реакций
- •Влияние среды на протекание окислительно-восстановительных реакций
- •Эквивалентные массы окислителя и восстановителя
- •Классификация окислительно-восстановительных реакций
- •4) Особые случаи овр:
- •Электрохимические системы Общая характеристика
- •Электродный потенциал. Измерение электродных потенциалов
- •Ряд стандартных электродных потенциалов (напряжений). Уравнение Нернста
- •Ряд напряжений металлов
- •Гальванические элементы, их электродвижущая сила
- •Аккумуляторы
- •Характеристики аккумулятора Эдисона и свинцового аккумулятора
- •Топливные элементы
- •Электролиз
- •Законы электролиза
- •Применение электролиза
- •Высокомолекулярные соединения (вмс) или полимеры
- •Физические свойства
- •Классификация
- •Полимеризационные полимеры
- •Поликонденсационные полимеры
- •Применение
- •Олигомеры
Реакции образования комплексных соединений
Различают два типа реакций:
1) по типу внедрения
AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2H2O
CuSO4 + 4NH4OH = [Cu(NH3)4]SO4 + 4H2O.
2) по типу присоединения
Zn(OH)2 + 2KOH = Zn(OH)2×2KOH = K2[Zn(OH)4]
HgJ2 + 2KJ = K2[HgJ4].
Классификация комплексных соединений
Их классифицируют по различным признакам:
1. По заряду комплексного иона:
а) комплексные катионы: [Pt+4 (NH3)6o]4+Cl4-; [Co+3(NH3o)4(CNS)2-];
б) комплексные анионы: K3+[Fe+3 (CN)6-]3-; K2+[Hg+2J4-]2-
в) нейтральные комплексы (неэлектролиты): [Co+2(NH3)3oCl3-]o; [Pt+4 (NH3)2oCl4-]o.
2. По числу центральных атомов (комплексообразователей):
а) одноядерные: K2+ [Zn+2(OH)4-]
б) многоядерные – содержащие два или несколько центральных атомов: [Co+3(NH3)6о]3+[Fe+3(CN)6-]3-.
3. По типу внешней сферы:
а) кислоты: H2[PtCl6];
б) основания: [Ag(NH3)2]OH;
в) соли: Na3[AlF6].
4. По типу лиганд:
а) аммиакаты - комплексы, в которых лигандами служат молекулы аммиака: [Cu(NH3)4]SO4;
б) аминаты - комплексы, в которых лигандами служат молекулы аминов: CH3NH2 (метиламин); NH2CH2CH2NH2 (этилендиамин);
в) аквакомплексы - комплексы, в которых лигандом выступает вода: [Co(H2O)6]Cl3; [Al(H2O)6]Cl3;
г) ацидокомплексы - комплексы, в которых лигандами являются анионы: K2[PtCl4]; H2[SiF6]; Na2[Sn(OH)4];
д) смешанные - комплексы, в которых лигандами являются разные частицы: [Pt(NH3)2Cl2].
е) карбонилы – комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): Fe(CO)5, Ni(CO)4. Химические связи в молекулах карбонилов металлов образованы аналогично химическим связям между другими лигандами и ионами металлов;
ж) «сандвичевые» («сэндвичевые») комплексные соединения – обширный класс, родоначальником которых является ферроцен. Ферроцен представляет собой желто-оранжевые кристаллы металлоорганического соединения, в котором атом железа располагается между двумя высокосимметричными пятичленными кольцами, образованными атомами углерода
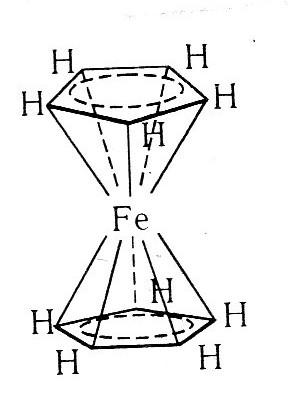
Структура ферроцена
Все перечисленные классы комплексных соединений содержат один центральный атом, то есть являются одноядерными
Номенклатура комплексных соединений
Согласно рекомендациям Международного союза теоретической и прикладной химии (ИЮПАК) названия комплексных солей образуют по общему правилу: сначала называют анион, а затем катион в родительном падеже.
Название комплексного катиона составляют следующим образом: сначала называют анион соли, образующий внешнюю сферу комплекса, затем указывают числа (используя греческие числительные: ди, три, тетра, пента, гекса и т.д.) и названия отрицательно заряженных лигандов с окончанием «о» (Cl- - хлоро, CN- - циано, SO32- - сульфито, ОН- - гидроксо и т.п.); затем указывают числа и названия нейтральных лигандов, причем вода – аква, аммиак- аммин; последним называют комплексообразователь, указывая степень его окисления (в скобках римскими цифрами после названия комплексообразователя). Например:
[Ag(NH3)2]ClO4 - перхлорат диамминсеребра(I),
[Pt(H2O)(NH3)2OH]NO3 - нитрат гидроксодиамминакваплатины(II).
Название комплексного аниона строится также как и для комплексного катиона, только степень окисления комплексообразователя ставится после его латинского или русского названия к которому добавляют суффикс «ат». Затем называют катион находящийся во внешней сфере. Например:
Na2[PtCl6] - гексахлороплатинат(IY) натрия;
Na[Zn(OH)4] - тетрагидроксоцинкат(II) натрия.
Названия нейтральных комплексных частиц образуются также, как и катионов, но комплексообразователь называют в именительном падеже, а степень его окисления не указывают, т.к. она определяется электронейтральностью комплекса. Например:
[Co(NH3)3Cl3] - трихлоротриамминкобальт,
[Co(H2O)3(NO3)3] - тринитротриаквакобальт.
