
- •Основные законы химии
- •Моль. Молярная масса
- •Относительная атомная и молекулярная массы
- •Газовые законы
- •1. Закон о суммарном давлении смеси газов: давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений газов, составляющих смесь
- •Закон эквивалентов
- •Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Строение атома
- •Модели Томсона и Резерфорда
- •Закон Мозли
- •Электронная оболочка атомов по Бору
- •Представления квантовой механики
- •Современная модель состояния электрона в атоме
- •Строение электронных оболочек атомов
- •Способы записи электронных конфигураций атомов и ионов
- •Периодический закон и периодическая система элементов д.И. Менделеева в свете учения о строении атомов
- •Свойства атомов. Их периодичность
- •Химическая связь и строение молекул
- •Ковалентная связь
- •Метод валентных связей
- •Сигма () и пи ()-связи
- •Донорно-акцепторная связь
- •Свойства ковалентной связи
- •Полярные и неполярные молекулы
- •Относительная электроотрицательность атомов
- •Ионная связь
- •Гибридизация атомных орбиталей
- •Гибридизация орбиталей и пространственная конфигурация молекул
- •Металлическая связь
- •Водородная связь
- •Типы кристаллических решеток
- •Валентность
- •Степень окисления
- •Комплексные соединения (комплементарность) Структура комплексных соединений
- •Хелаты и внутрикомплексные соединения
- •Реакции образования комплексных соединений
- •Номенклатура комплексных соединений
- •Пространственное строение и изомерия комплексных соединений
- •Диссоциация комплексных соединений в растворах. Константа нестойкости. Константа устойчивости
- •Связь в комплексных ионах
- •Реакции с участием комплексных соединений
- •1) Реакции обмена
- •2) Окислительно-восстановительные реакции
- •Элементы химической термодинамики Основные понятия
- •Внутренняя энергия. Первый закон термодинамики. Энтальпия
- •Закон Гесса. Следствия из него
- •Второй закон термодинамики. Энтропия
- •Термодинамические потенциалы
- •14 Типы реакций, различающиеся возможностьюи условиями протекания в зависимости от характера изменения ∆н и ∆s
- •Химическая кинетика Основные понятия
- •Скорость химической реакции
- •Зависимость скорости реакции от концентрации реагентов
- •Влияние температуры на скорость реакции
- •Дисперсные системы
- •Классификация дисперсных систем
- •Классификация дисперсных систем
- •Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •Количественные характеристики дисперсных систем
- •Устойчивость дисперсных систем
- •Применение
- •Растворы Растворы в природе. Теории растворов
- •Механизм процесса растворения
- •Тепловые эффекты при растворении
- •Ненасыщенные, насыщенные и пересыщенные растворы
- •Растворимость различных веществ в воде
- •Выражение количественного состава растворов
- •Разбавленные растворы неэлектролитов и их свойства
- •Эбуллиоскопическая и криоскопическая константы
- •Растворы электролитов и их свойства
- •Диссоциация воды. Водородный показатель
- •Гидролиз солей
- •Буферные растворы
- •Водородный показатель (рН) растворов
- •Свойства кислотно-основных индикаторов
- •Применение
- •Окислительно-восстановительные реакции
- •Распространенные окислители и их продукты
- •Важнейшие восстановители и окислители
- •Методы составления уравнений окислительно-восстановительных реакций
- •Влияние среды на протекание окислительно-восстановительных реакций
- •Эквивалентные массы окислителя и восстановителя
- •Классификация окислительно-восстановительных реакций
- •4) Особые случаи овр:
- •Электрохимические системы Общая характеристика
- •Электродный потенциал. Измерение электродных потенциалов
- •Ряд стандартных электродных потенциалов (напряжений). Уравнение Нернста
- •Ряд напряжений металлов
- •Гальванические элементы, их электродвижущая сила
- •Аккумуляторы
- •Характеристики аккумулятора Эдисона и свинцового аккумулятора
- •Топливные элементы
- •Электролиз
- •Законы электролиза
- •Применение электролиза
- •Высокомолекулярные соединения (вмс) или полимеры
- •Физические свойства
- •Классификация
- •Полимеризационные полимеры
- •Поликонденсационные полимеры
- •Применение
- •Олигомеры
Гибридизация атомных орбиталей
Перестройка электронной структуры атома, представляет собой гибридизацию атомных орбиталей. Из исходных s-, p-, d-орбиталей (электронных облаков) образуются равноценные гибридные орбитали (электронные облака), вытянутые по направлению к соседним атомам. При этом обеспечивается более полное перекрывание с облаками этих соседних атомов, что приводит к выигрышу энергии, достаточному, чтобы с избытком компенсировать затраты на деформацию исходных электронных облаков.
sp-Гибридизация происходит у орбиталей атомов элементов II группы периодической системы Д.И. Менделеева, при образовании галогенидов. Атомы этих элементов в нормальном состоянии имеют во внешнем уровне два спаренных s-электрона. В результате возбуждения один из s-электронов переходит в р-состояние, появляются два неспаренных электрона, один из которых s-электрон, другой р-электрон
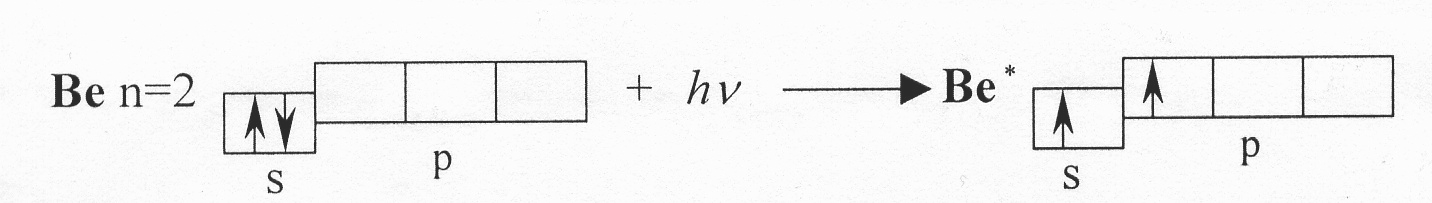
Энергия электронов р-подуровня выше, чем энергия электронов s-подуровня. Из исходных s- и р-орбиталей возбужденного атома бериллия (Be*) образуются две гибридные, одинаковые по энергии орбитали (облака) в форме неправильной гантели, расположенные под углом 180о друг к другу
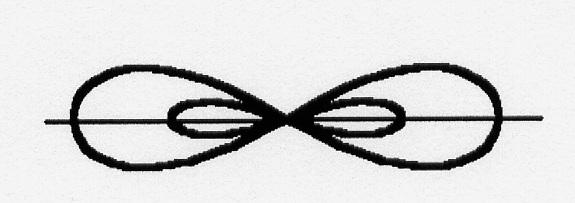
При взаимодействии с р-орбиталями хлора, происходит перекрывание электронных облаков вдоль линии, соединяющей ядра взаимодействующих атомов. Форма молекул при sp-гибридизации линейная
![]()
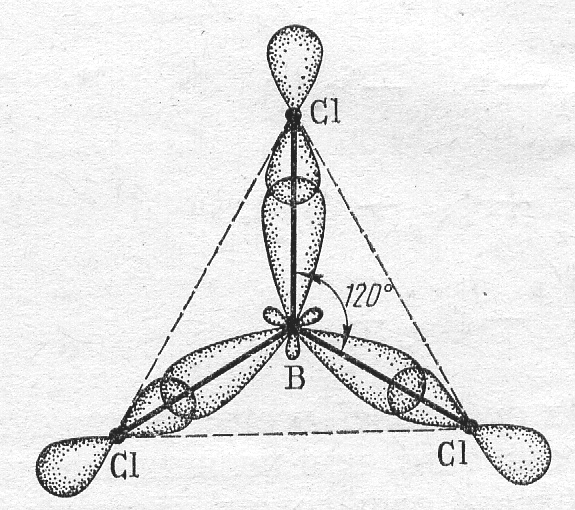
sp2-Гибридизация происходит у орбиталей атома бора и его аналогов. Возбужденный атом бора обладает тремя неспаренными электронами – одним s-электроном и двумя р-электронами

Из трех орбиталей образуются три эквивалентные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120о друг к другу
Электронно-графическая формула фтора
В образовании молекулы ВF3 участвуют 3 гибридных электронных облака атома бора и три р-электронных облака атома фтора. Форма молекул молекулы ВF3 – правильный треугольник на плоскости
sp3-Гибридизация характерна для атомов углерода и его аналогов – кремния, германия. Из одной s- и трех р-орбиталей атомов в возбужденном состоянии образуются четыре гибридных орбитали, расположенные под углом 109,5о друг к другу, они направлены к вершинам тетраэдра, в центре которого находится атом углерода; ребрами тетраэдра являются диагонали сторон куба

Молекула СН4 имеет форму тетраэдра, причем все четыре С-Н связи сигма (σ) равноценны
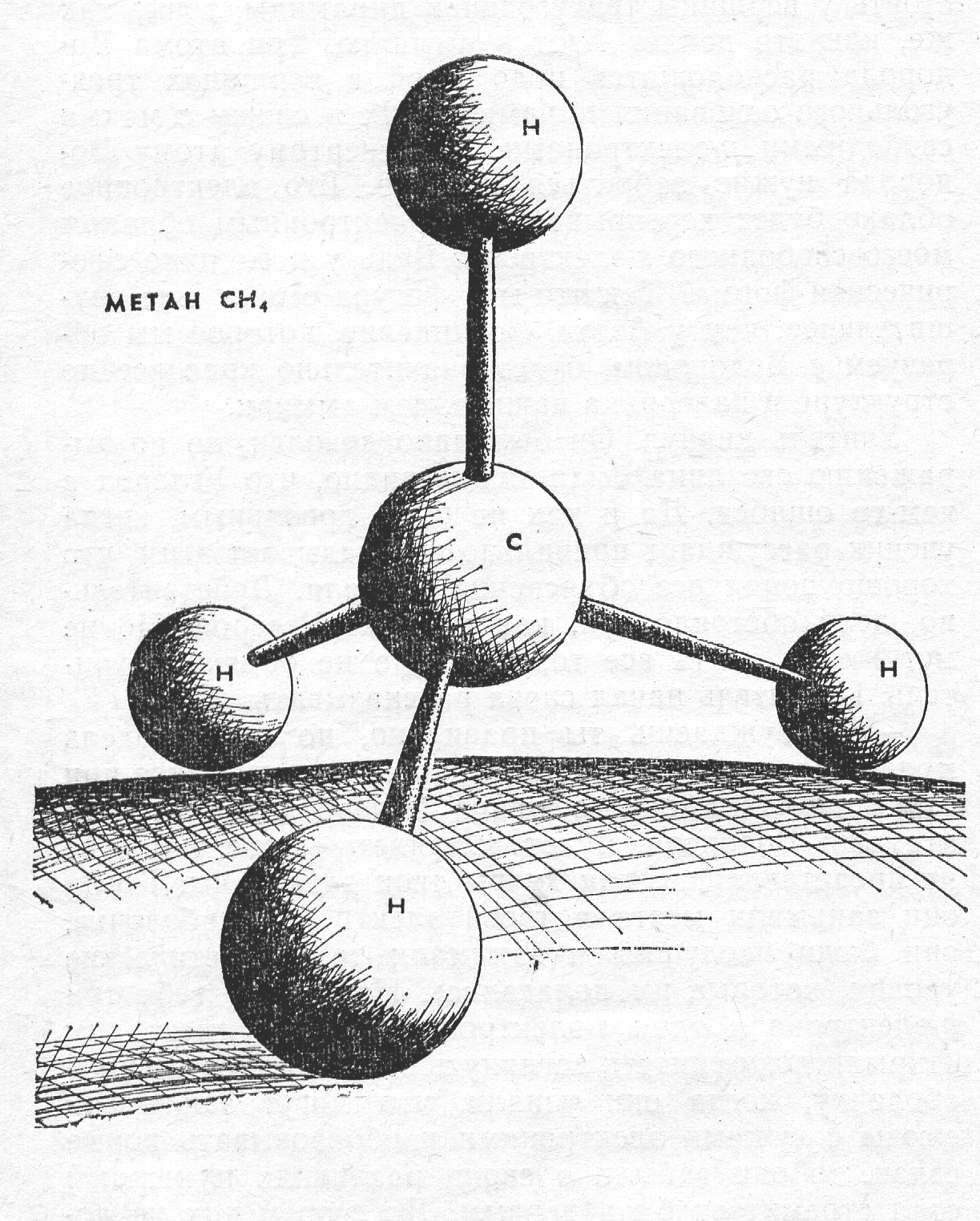
Пространственная структура СН4
В таблице даны типы гибридизации орбиталей и «архитектуры» молекул.
Гибридизация орбиталей и пространственная конфигурация молекул
|
Тип молекулы |
Исходные орбитали атома А |
Тип гибридизации |
Число гибридных орбиталей атома А |
Пространственная конфигурация молекулы |
|
АВ2 АВ3 АВ4 |
s + p s + p + p s + p + p + p |
sp sp2 sp3 |
2 3 4 |
линейная треугольная тетраэдрическая |
При образовании двойных, тройных связей в органических соединениях (этилен, ацетилен) происходит перекрывание р-электронных облаков в плоскостях, перпендикулярно σ-связям и образование π-связей.
Металлическая связь
Атомы большинства металлов на внешнем энергетическом уровне содержат небольшое число электронов (1, 2. 3), это в основном s- и d-элементы. В обычных условиях металлы - кристаллические вещества (кроме ртути). На рисунке представлена схема кристаллической решетки натрия.
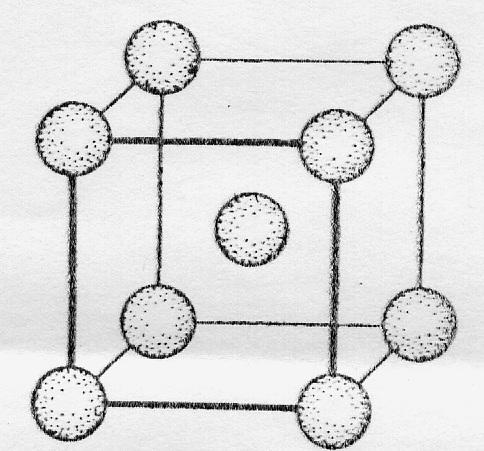
Кристаллическая решетка натрия
Как видно, каждый атом натрия окружен восемью соседними атомами. У атома натрия, как и у других металлов, имеется избыток валентных орбиталей и недостаток электронов. При сближении атомов в результате образования кристаллической решетки валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются из одной орбитали в другую, осуществляя связь между всеми атомами кристалла металла. Такой тип химической связи называется металлической.
Между ковалентной и металлической связью имеется большое сходство – оба типа химической связи основаны на обобществлении валентных электронов. Только в металлах обобществленные электроны обслуживают весь кристалл, то есть они полностью делокализованы. Электроны, осуществляющие связь, обобществлены («электронный газ») и перемещаются по всему объему металла, в целом электронейтрального. Этим объясняется отсутствие пространственной направленности металлической связи и высокие координационные числа металлических структур. Это означает, что металлическая связь не проявляет свойств насыщаемости, столь характерных для ковалентной связи. Делокализация же валентных электронов в металлах является следствием многоцентрового характера металлической связи и причиной хорошей электро- и теплопроводности металлов, пластичности и ковкости. Для веществ с ковалентной связью при отсутствии примесей электропроводность может быть обеспечена только в результате разрушения этих связей. Объясняется это тем, что ковалентная связь соединяет только два соседних атома, а общие электроны пребывают в непосредственной близости от них и прочно с ними связаны.
Металлическая связь – многоцентровая химическая связь с дефицитом электронов, основанная на обобществлении внешних электронов атомов. Таким образом, металлическая связь характерна только для конденсированного состояния вещества. В паро- и газообразном состоянии атомы всех веществ, в том числе и металлов, связаны между собой только ковалентной связью.
Аналогия между ковалентной и металлической связями подтверждается распределением электронной плотности между атомными остовами. Для обоих типов связей в пространстве между атомными остовами сохраняется значительная электронная плотность, образуя электронные мостики между взаимодействующими атомами.
Разница заключается в том, что в ковалентной связи электронные мостики имеют строго определенное пространственное направление, а у металлической связи электронная плотность равномерно распределена по всем направлениям. В результате в решетке типичных металлов все атомы кристаллографически эквивалентны и эффективные заряды атомов равны нулю.
