
- •Основные законы химии
- •Моль. Молярная масса
- •Относительная атомная и молекулярная массы
- •Газовые законы
- •1. Закон о суммарном давлении смеси газов: давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений газов, составляющих смесь
- •Закон эквивалентов
- •Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Строение атома
- •Модели Томсона и Резерфорда
- •Закон Мозли
- •Электронная оболочка атомов по Бору
- •Представления квантовой механики
- •Современная модель состояния электрона в атоме
- •Строение электронных оболочек атомов
- •Способы записи электронных конфигураций атомов и ионов
- •Периодический закон и периодическая система элементов д.И. Менделеева в свете учения о строении атомов
- •Свойства атомов. Их периодичность
- •Химическая связь и строение молекул
- •Ковалентная связь
- •Метод валентных связей
- •Сигма () и пи ()-связи
- •Донорно-акцепторная связь
- •Свойства ковалентной связи
- •Полярные и неполярные молекулы
- •Относительная электроотрицательность атомов
- •Ионная связь
- •Гибридизация атомных орбиталей
- •Гибридизация орбиталей и пространственная конфигурация молекул
- •Металлическая связь
- •Водородная связь
- •Типы кристаллических решеток
- •Валентность
- •Степень окисления
- •Комплексные соединения (комплементарность) Структура комплексных соединений
- •Хелаты и внутрикомплексные соединения
- •Реакции образования комплексных соединений
- •Номенклатура комплексных соединений
- •Пространственное строение и изомерия комплексных соединений
- •Диссоциация комплексных соединений в растворах. Константа нестойкости. Константа устойчивости
- •Связь в комплексных ионах
- •Реакции с участием комплексных соединений
- •1) Реакции обмена
- •2) Окислительно-восстановительные реакции
- •Элементы химической термодинамики Основные понятия
- •Внутренняя энергия. Первый закон термодинамики. Энтальпия
- •Закон Гесса. Следствия из него
- •Второй закон термодинамики. Энтропия
- •Термодинамические потенциалы
- •14 Типы реакций, различающиеся возможностьюи условиями протекания в зависимости от характера изменения ∆н и ∆s
- •Химическая кинетика Основные понятия
- •Скорость химической реакции
- •Зависимость скорости реакции от концентрации реагентов
- •Влияние температуры на скорость реакции
- •Дисперсные системы
- •Классификация дисперсных систем
- •Классификация дисперсных систем
- •Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •Количественные характеристики дисперсных систем
- •Устойчивость дисперсных систем
- •Применение
- •Растворы Растворы в природе. Теории растворов
- •Механизм процесса растворения
- •Тепловые эффекты при растворении
- •Ненасыщенные, насыщенные и пересыщенные растворы
- •Растворимость различных веществ в воде
- •Выражение количественного состава растворов
- •Разбавленные растворы неэлектролитов и их свойства
- •Эбуллиоскопическая и криоскопическая константы
- •Растворы электролитов и их свойства
- •Диссоциация воды. Водородный показатель
- •Гидролиз солей
- •Буферные растворы
- •Водородный показатель (рН) растворов
- •Свойства кислотно-основных индикаторов
- •Применение
- •Окислительно-восстановительные реакции
- •Распространенные окислители и их продукты
- •Важнейшие восстановители и окислители
- •Методы составления уравнений окислительно-восстановительных реакций
- •Влияние среды на протекание окислительно-восстановительных реакций
- •Эквивалентные массы окислителя и восстановителя
- •Классификация окислительно-восстановительных реакций
- •4) Особые случаи овр:
- •Электрохимические системы Общая характеристика
- •Электродный потенциал. Измерение электродных потенциалов
- •Ряд стандартных электродных потенциалов (напряжений). Уравнение Нернста
- •Ряд напряжений металлов
- •Гальванические элементы, их электродвижущая сила
- •Аккумуляторы
- •Характеристики аккумулятора Эдисона и свинцового аккумулятора
- •Топливные элементы
- •Электролиз
- •Законы электролиза
- •Применение электролиза
- •Высокомолекулярные соединения (вмс) или полимеры
- •Физические свойства
- •Классификация
- •Полимеризационные полимеры
- •Поликонденсационные полимеры
- •Применение
- •Олигомеры
Современная модель состояния электрона в атоме
При химических реакциях ядро атома не претерпевает изменений. Изменению подвергаются электронные оболочки атомов, строением которых объясняются многие свойства химических элементов. Поэтому состоянию электронов в атоме и структуре электронных оболочек уделяется большое внимание при изучении химии.
Состояние электрона в атоме описывается квантовой механикой, которая изучает движение и взаимодействие микрочастиц, то есть элементарных частиц, атомов, молекул и атомных ядер. По представлениям квантовой механики микрочастицы имеют волновую природу, то есть выступают как носители и корпускулярных, и волновых свойств. Применительно к электрону можно сказать, что он ведет себя и как частица, и как волна, то есть обладает, как и другие микрочастицы, корпускулярно-волновым дуализмом (двойственностью).
Электроны в атоме не имеют траекторий движения. Квантовая механика рассматривает вероятность нахождения электрона в пространстве вокруг ядра. Быстро движущийся электрон может находиться в любой части околоядерного пространства, и различные положения его рассматриваются как электронное облако с определенной плотностью отрицательного заряда. Более наглядно это можно представить так. Если бы удалось через весьма малые промежутки времени фотографировать положение электрона в атоме (он отразится на фотографии в виде точки), то при наложении множества таких фотографий получилась бы картина электронного облака. И там, где число точек наибольшее, облако наиболее плотное. Максимальная плотность отвечает наибольшей вероятности нахождения электрона в данной части атомного пространства.
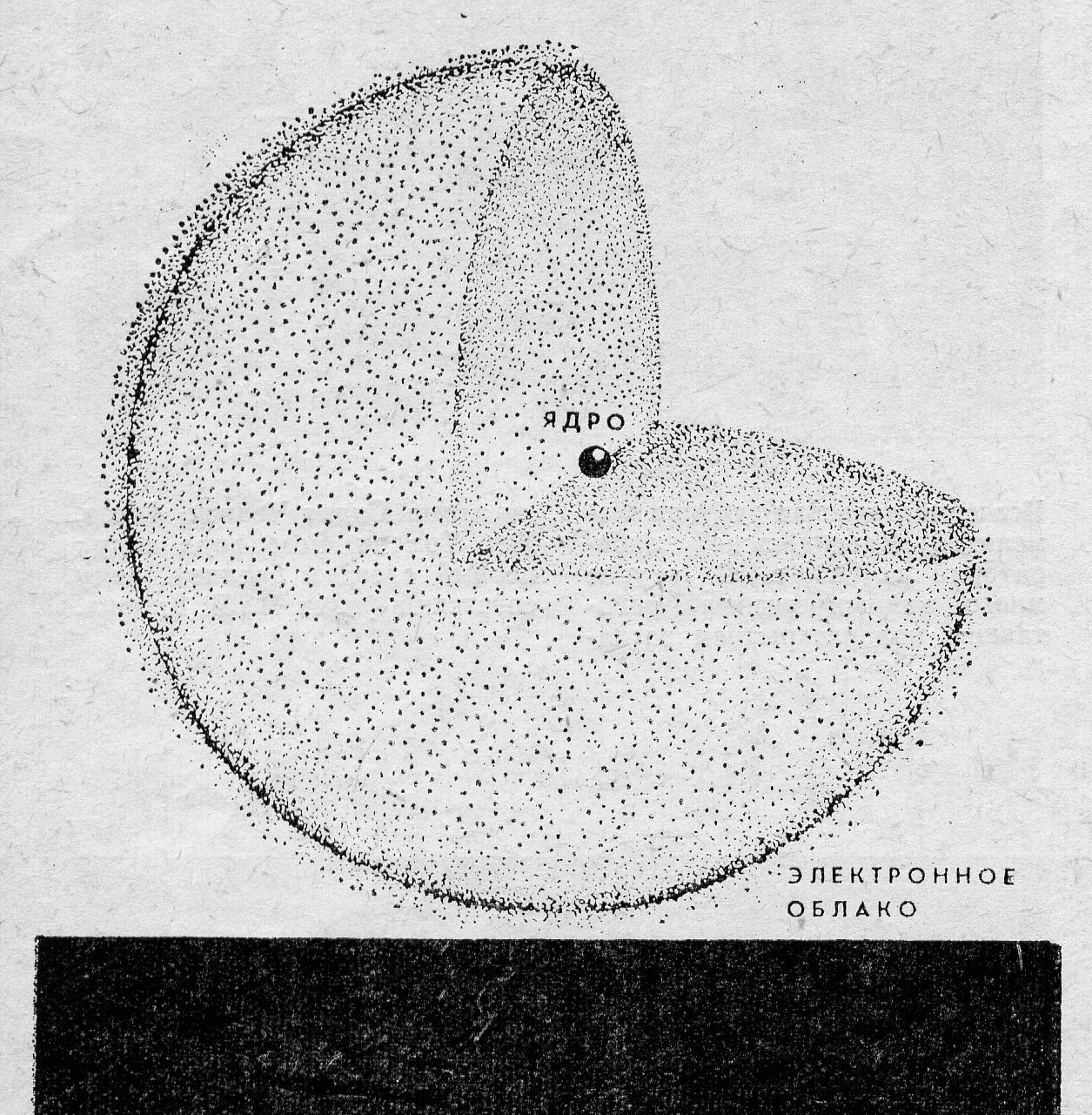
Электронное облако атома водорода
Чем прочнее связан электрон с ядром, тем более плотным по распределению заряда и меньшим по размерам должно быть электронное облако.
Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. В нем заключается 90 % электронного облака. Это означает, что около 90 % времени электрон находится в этой части пространства.
Очевидно, что электроны, движущиеся в орбиталях меньшего размера, сильнее притягиваются ядром, чем электроны, движущиеся в орбиталях большего размера. Электроны, которые движутся в орбиталях близкого размера, образуют энергетические уровни (электронные слои). Энергетические уровни нумеруются, начиная с 1, 2, 3, 4 … Иногда их обозначают буквами K, L, M, N … Целое число n, обозначающее номер уровня, называется главным квантовым числом. Оно характеризует размер электронного облака, энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней обладают большим запасом энергии. Очевидно, менее прочно связаны с ядром электроны внешнего уровня.
Число заполняемых электронами энергетических уровней в атоме равно номеру периода, в котором находится элемент: у атомов элементов I периода – один энергетический уровень, II периода – два, III – периода – три и т.д. Наибольшее число электронов на энергетическом уровне равно удвоенному квадрату номера уровня
N = 2n2,
где N – число электронов; n – номер уровня (считая от ядра), или главное квантовое число.
В соответствии с данным уравнением на первом, ближайшем к ядру, энергетическом уровне может находиться не более 2, на втором – 8, на третьем – 18, на четвертом – 32 электронов.
Кроме главного квантового числа существует еще три энергетических параметра, определяющих состояние электрона в атоме. Это побочное (орбитальное, азимутальное) квантовое число l, определяющее форму атомной орбитали. Оно может принимать целочисленные значения от 0 … до (n – 1) (l = 0, 1, …, n-1). Каждому значению l соответствует орбиталь особой формы. При l = 0 орбиталь независимо от значения главного квантового числа имеет сферическую форму (s-орбиталь). Значению l = 1 соответствует орбиталь, имеющая форму гантели (р-орбиталь). Еще более сложную форму имеют орбитали, отвечающие высоким значениям l, равным 2, 3 и 4 (d-, f-, g-орбитали).
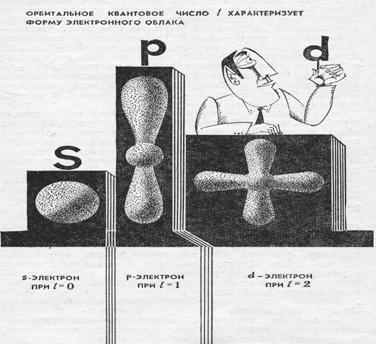
Характеристика орбитального квантового числа
Магнитное квантовое число (ml) определяет положение атомной орбитали в пространстве относительно внешнего магнитного или электромагнитного поля. Магнитное квантовое число связано с орбитальным квантовым числом, изменяясь –l , до + l, включая 0. Следовательно, каждому значению l соответствует (2l + 1) значений магнитного квантового числа.
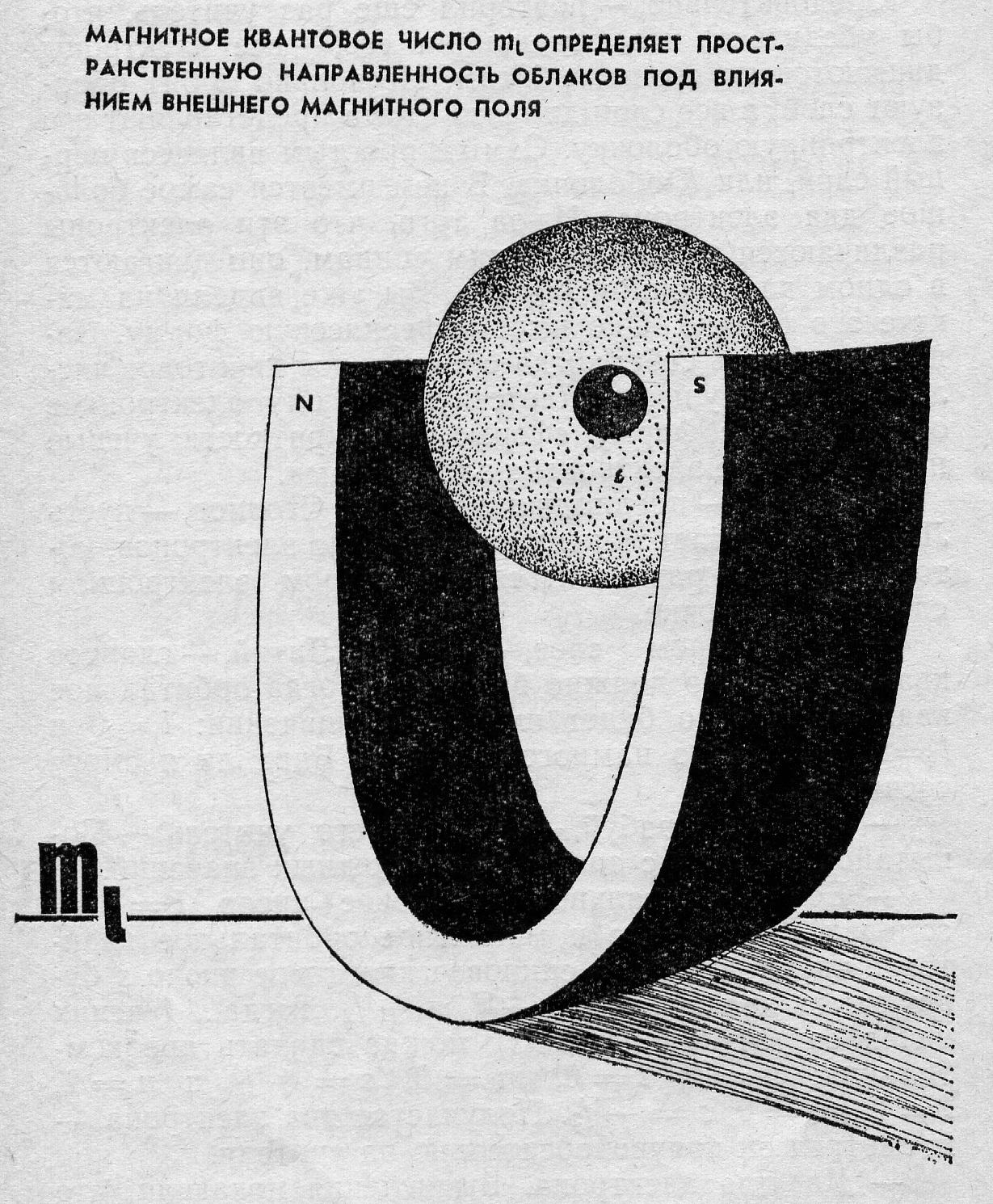 Характеристика
магнитного квантового числа
Характеристика
магнитного квантового числа
Спиновое квантовое число (s) может принимать лишь два возможных значения +½ и -½. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона.
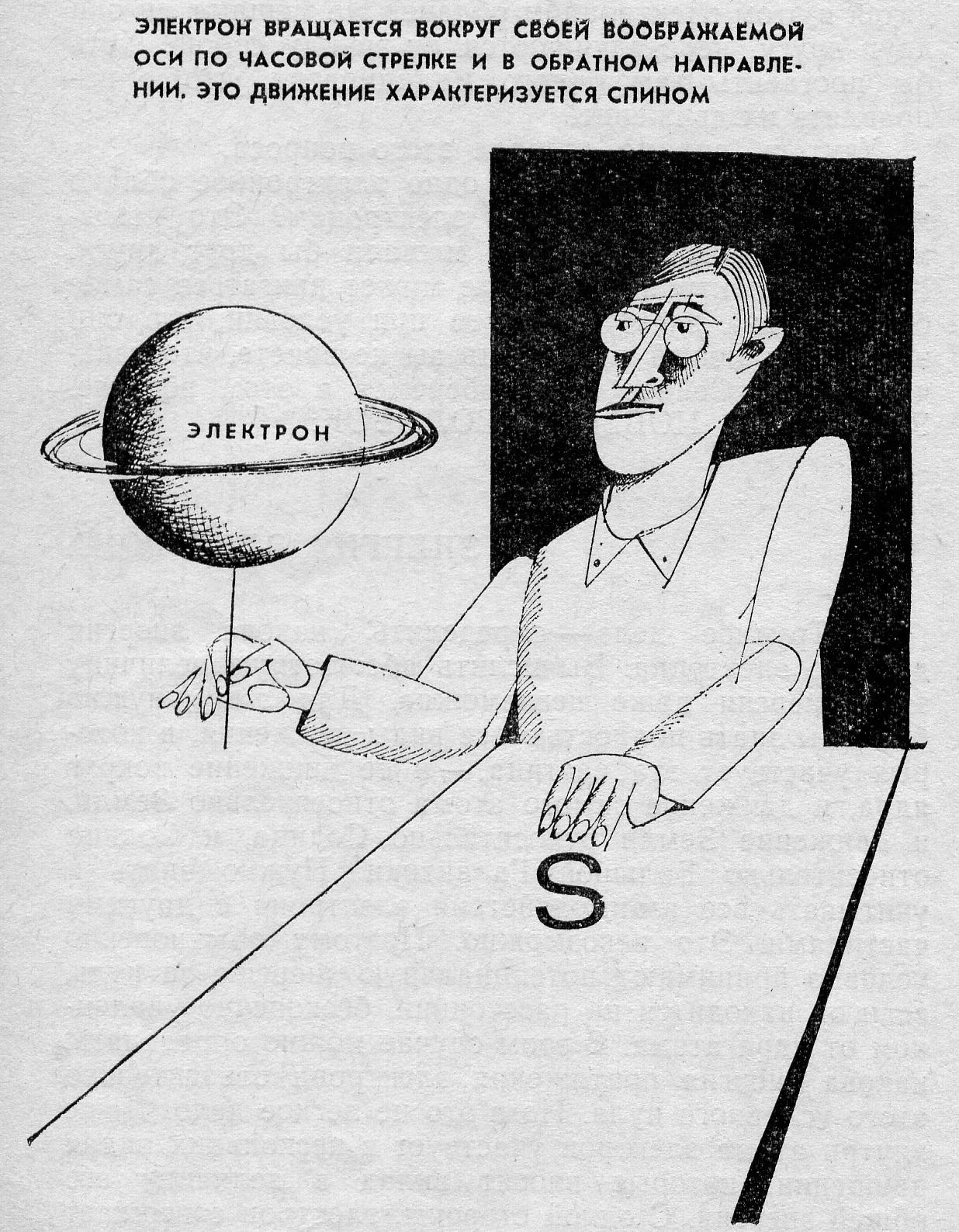 Характеристика
спинового квантового числа
Характеристика
спинового квантового числа
