
- •I группа. Компоненты этой группы широко распространены и необходимые пределы обнаружения аналитических методов, используемых для их обнаружения, легко достигаются:
- •III группа:
- •Природной среды
- •2. Проблема пробоотбора.
- •3. Новые методы и методики.
- •5. Проблема метрологического обеспечения
- •1. Аналитический цикл и его этапы. Универсальная система химического анализа
- •2. Методы экоаналитического контроля
- •3. Нормирование качества природной среды
- •2.3.1. Атмосфера
- •1. Виды проб
- •2. Отбор проб воздуха
- •2.1. Контейнеры
- •2.2. Абсорбционное улавливание
- •2.3. Криогенное концентрирование (улавливание)
- •2.4. Сорбция (адсорбция)
- •Современное состояние и проблемы
- •1.2. Определение в воздухе соединений азота (nh3, no2 и другие оксиды, n2h4)
- •1.3. Определение o3
- •1.4. Определение оксидов углерода
- •1.5. Определение фтороводорода
- •1.6. Определение лос. Хромато-масс-спектромерия
- •2. Определение аэрозолей, пылей
- •2.1. Индекс черного дыма
- •2.2. Гравиметрический метод определения взвешенных частиц
- •2.3. Определение асбеста
- •3. Металлы
- •3.1. Тетраэтилсвинец и свинец в атмосферных аэрозолях
- •3.2. Другие металлы, ртуть
- •4. Автоматические приборы для контроля качества воздуха
2.2. Абсорбционное улавливание
Этот способ пробоотбора был очень распространен в СССР в 30-40х годах, т.к. основные методики определения токсичных компонентов в воздухе были фотометрические и для выполнения анализа были нужны растворы. Абсорбционное улавливание загрязнений воздуха – это отбор веществ, находящихся в воздухе в газо- и парообразном состоянии, в жидкие поглотительные среды (вода, кислоты, спирты, органические растворители), в которых определяемое вещество растворяется или химически связывается поглотительной средой.
Абсорбционное улавливание дает возможность одновременно концентрировать все определяемые примеси кроме аэрозолей и твердых частиц. Этот способ пробоотбора отличается высокой селективностью и упрощением предварительной обработки пробы.
В то же время для него характерны недостатки:
1. Невысокая степень обогащения пробы микропримесями.
2. Невозможно получить представительную пробу при наличии в воздухе аэрозолей и твердых частиц.
Для абсорбционного улавливания токсикантов загрязненный воздух пропускают через поглотительную склянку (абсорбер), содержащую несколько миллилитров растворителя, природа которого определяется составом пробы. На рис. 6. изображены абсорберы, широко используемые в практике санитарно-химического анализа.
1 2 3 4
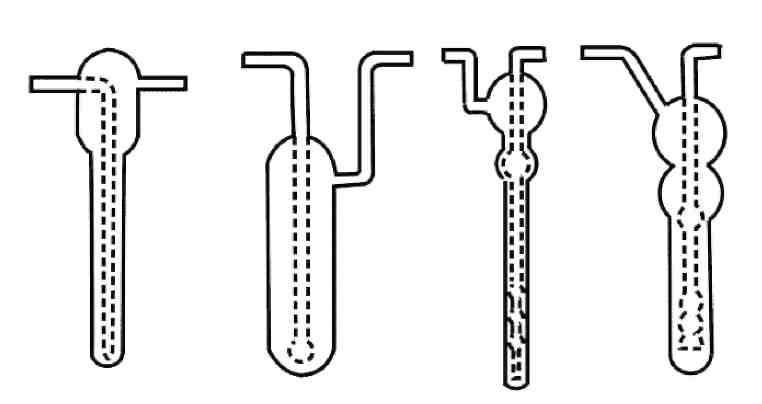
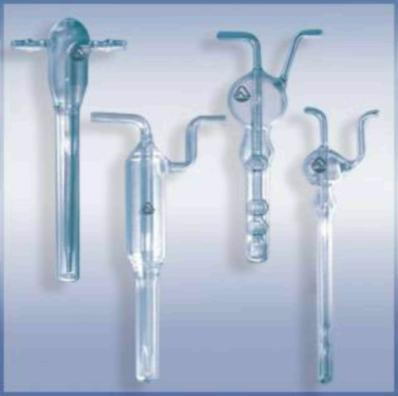
Рис.6. Поглотительные приборы (абсорберы) из стекла: Зайцева (1), Киселева (2), Рыхтера (3 – малый, 4 – скоростной)
Наибольшее распространение получили абсорберы со стеклянными пористыми пластинками, поглотительные сосуды Рыхтера и Зайцева. Пористая пластинка уменьшает размер пузырьков воздуха и увеличивается контакт воздуха с раствором. Полнота поглощения зависит от природы анализируемых примесей и абсорбента, их концентрации, скорости потока воздуха. Для летучих органических поглотителей абсорбер охлаждают смесью льда и соли. Скорость аспирации воздуха через поглотительный прибор не должна превышать 50 л/час. Скорость аспирации регулируется расходомерными устройствами (реометр, ротаметр, газовые часы).
Примеры химического состава некоторых поглотительных растворов представлены в табл. 2.
Таблица 2. Поглотительные растворы при улавливании некоторых загрязнений воздуха рабочей зоны (МуравьеваС.И., Казнина Н.И., Прохорова Е.К. Справочник по контролю вредных веществ в воздухе. – М.: Химия, 1988. – 320 с.)
|
Определяемый компонент |
Поглотительный раствор |
|
Фтороводород |
Ализаринкомплексонат лантана(III) + La(III) |
|
Хлороводород |
Hg(SCN)2 или AgNO3 |
|
Диоксид азота |
Реактив Грисса
+ |
|
Тринитротолуол |
то же |
|
Диокид серы |
KCl |
|
Сероводород |
Na3AsO3 или AgNO3 |
|
Этилмеркаптан |
Hg(CH3COO)2 |
|
Арсин |
NaBrO |
|
Фосфин |
(NH4)2MoO4 и KMnO4 |
|
Циановодород |
Br2
Br2,
пиридин аналин |
|
Уксусная кислота |
H2O |
|
Метанол |
Хромотроповая кислота |
|
Фенол |
С2Н5ОН |
|
Бром |
КОН |
|
Аммиак |
Реактив Несслера: K2HgI4 в KOH |
|
Сероуглерод |
Диэтиламин и Cu(CH3COO)2 |
|
Триоксид серы |
BaCl2 |
|
Диоксид углерода |
Ca(OH)2 |
Особенно эффективным является поглощение, основанное на химических реакциях абсорбируемых веществ с поглотителями. Например, реакционно способный триоксид серы поглощается раствором хлорида бария, а диоксид углерода – раствором гидроксида кальция:
SO3 + H2O = H2SO4
H2SO4 + BaCl2 = BaSO4 + 2HCl
CO2 + H2O = H2CO3
H2CO3 + Ca(OH)2 = CaCO3 + 2H2O
Причины возможных погрешностей при аспирационном улавливании:
Неправильное измерение объема аспирируемого воздуха.
Пренебрежение агрегатным состоянием анализируемых веществ. Возможно улавливание только веществ в паро- и газообразном
состоянии. Аэрозоли и твердые вещества (пыль, сажа) не улавливаются, т.к. они не успевают растворяться и вступать в реакцию с абсорбентом при прокачивании воздуха через раствор.
3. Не оптимальный выбор поглотительных сред и скорости аспирации воздуха.
Слишком высокая скорость аспирации приводит к «проскоку» целевых компонентов, а ЛОС в процессе такого пробоотбора могут терять до 50% своей массы.
4. Наличие микропримесей сопутствующих или посторонних веществ в поглотительных растворах.
Вода, органические растворители могут содержать примеси. Например, примесь воды в поглотительной нитросмеси при определении бензола в воздухе способствует неполной реакции нитрования и уменьшению количества динитробензола, по количеству которого судят о содержании бензола в воздухе.
Характеристика фотометрических методов определения некоторых токсичных газов в воздухе после их абсорбционного улавливания представлена в табл. 3.3.
Абсорбционный раствор можно затем использовать для повторного концентрирования некоторых токсикантов, т.к. даже хроматографическим методом с высокочувствительным пламенно-ионизационным детектором и детектором электронного захвата не всегда удается достичь необходимого предела обнаружения токсикантов. Методами дополнительного
концентрирования могут быть экстракция либо выпаривание
абсорбционной жидкости, для чего используют специальные
микроконцентраторы с дефлегматорами. Можно выпаривать в роторных испарителях, в вакууме.
Таблица
3. Фотометрическое определение некоторых токсичных газов в воздухе после аспирационного отбора проб (Муравьева С.И., Казнина Н.И., Прохорова Е.К. Справочник по контролю вредных веществ в воздухе. – М.: Химия, 1988. – 320 с.)
|
Вещество |
Принцип фотометрического метода определения |
Отбор проб |
Диапазон определяемых концентраций, мг/м3 |
Избирательность |
|
Аммиак |
Реакция с гипохлоритом и фенолом в присутствии нитропруссида натрия λ=630 нм |
Поглотительный прибор Рыхтера с 6 мл 0,1% раствора серной кислоты, расход 0,2 л/мин |
0,06-0,6 |
Мешают ароматические амины, формальдегид в больших концентрациях |
|
Реакция с реактивом Несслера, λ=450 нм |
Поглотительный прибор Рыхтера с 6 мл 0,005 М раствора серной кислоты, расход 1 л/мин |
0,066-0,7, погрешность 25% |
Мешают аммонийные соли, формальдегид, сероводород, хлор. Не мешают оксиды азота. | |
|
Реакция с натриево-салицилатным реактивом в присутствии гипохлорита натрия λ=597 нм |
Поглотительный прибор Рыхтера с 6 мл 0,005 М раствора серной кислоты, расход 1 л/мин |
0,004-0,04 |
Не мешает диоксид серы свыше 3 мг/м3, сероводород свыше 0,2 мг/м3, сероуглерод свыше 0,7 мг/м3 | |
|
Диоксид азота |
Реакция с сульфаниловой кислотой и нафтиламином |
Поглотительный прибор с пористой пластинкой с |
0,03-0,64 |
Не мешает озон в концентрациях, |
|
|
(реактив Грисса) λ=540 нм |
6 мл раствора KI, расход 0,2 л/мин |
|
превышающих концентрации диоксида в 3 раза. |
|
Реакция с сульфаниловой кислотой и азот(1-нафтил)этилендиамином, λ=550 нм |
Два поглотительных прибора с пористой пластинкой с 5 мл раствора азот(1-нафтил)этилендиамина |
0,01-0,1 |
Мешают Н2О2 свыше 1 мг/м3, сероводород свыше 1 мг/м3, диоксид серы свыше 0,4 мг/м3, формальдегид свыше 0,08 мг/м3 | |
|
Диоксид серы |
Реакция с тетрахлор-меркуратом натрия, формальдегидом и парарозанилином, λ=575 нм |
Поглотительный прибор Рыхтера с 6 мл 0,04 М раствора тетрахлор-меркурата натрия, расход 2 л/мин |
0,003-0,24 |
Не мешают оксиды азота, оксид углерода |
|
Сероводород |
Реакция с диметил-п-фенилендиамином и перхлоратом железа в щелочной среде с триэтаноламином, λ=670 нм |
Поглотительный прибор Рыхтера с 5 мл раствора ацетата кадмия и цитрата калия с триэтаноламином, расход 4 л/мин |
0,004-0,12 |
Мешает диоксид серы свыше 10 мг/м3 |
|
Фотометрическая реакция с нитратом серебра, λ=346 нм |
Поглотительный прибор Рыхтера с 6 мл раствора арсенита калия, расход 4 л/мин |
0,007-0,07 |
Мешают хлориды, цианиды, роданиды в 10-кратном избытке | |
|
Фенол |
Реакция с диазотированным п-нитроанилином в среде |
Поглотительный прибор Рыхтера с 6 мл 0,08% |
0,004-0,02 |
Мешают крезолы и сероводород |
|
|
карбоната натрия, λ=494 нм |
раствора карбоната натрия, расход 2 л/мин |
|
|
|
Формальдегид |
Реакция с фенилгидразингид-рохлоридом в щелочной среде в присутствии гексацианоферрата калия, λ=520 нм |
Поглотительный прибор с пористой пластинкой с 6 мл 50% раствора изопропилового спирта, расход 1 л/мин |
0,012-0,6, погрешность 25% |
Мешают другие альдегиды |
|
Реакция с ацетилацетоном в среде ацетата аммония, λ=412 нм |
Два поглотительных прибора с пористой пластинкой с 5 мл ацетилацетонового раствора, расход 1,5 л/мин, расход 0,5 л/мин |
0,003-0,1, погрешность 15% |
Не мешают метиловый и этиловый спирты, этиленгликоль, аммиак, ацетальдегид, пропионовый альдегид | |
|
Реакция с хромотроповой кислотой, λ=570 нм |
Два поглотительных прибора с пористой пластинкой с 5 мл воды |
0,011-1 |
Мешают сероводород свыше сероводород свыше 0,03 мг/м3, диоксид серы свыше 3 мг/м3, метиловый спирт свыше 0,3 мг/м3, аммиак свыше 0,5 мг/м3 |
Еще один важный прием в пробоподготовке после абсорбции токсикантов – дериватизация. Дериватизация – это получение производных определяемых компонентов. Она особенно эффективна при использовании хроматографических методов, т.к. использование
специфических реагентов, которые вступают в реакцию только с контролируемыми компонентами, значительно повышает надежность идентификации целевых компонентов. Например, формальдегид является одним из важнейших загрязнителей воздуха. При аспирационном улавливании воздух пропускают через абсорбер, содержащий реагент ацетилацетон в ацетатном буферном растворе. В результате реакции между формальдегидом и ацетилацетоном образуется нелетучее производное формальдегида, окрашенное в желтый цвет. Поглотительный раствор нагревают на водяной бане и измеряют оптическую плотность окрашенного раствора.
Примером дериватизации в газовой хроматографии может служить определение до 2·10–7% HCN в воздухе. Пары кислоты поглощают водным раствором щелочи. В щелочной среде происходит реакция цианид-иона с пентафторбензилбромидом с образованием пентафторбензилцианида.
Образование фторпроизводного HCN позволило использовать селективный к галогенам детектор электронного захвата.
Боевое отравляющее вещество люизит конвертируют
(дериватизируют) в ацетилен, что позволило снизить предел обнаружения газохроматографического определения с пламенно-ионизационным
детектором до нескольких нанограмм люизита:
ClCH=CHAsCl2 + 6NaOH = CH≡CH + Na3AsO3 + 3H2O
