
- •Министерство образования и науки рф
- •Введение
- •Раздел I. Основы химической термодинамики
- •1.1 Основные понятия, используемые в химической термодинамике
- •1.2 Первый закон термодинамики
- •1.3 Термохимия
- •1.3.1 Закон Гесса и следствия из него. Расчет тепловых эффектов
- •1.3.2 Понятие о теплоемкости веществ
- •1.3.3 Влияние температуры на тепловой эффект
- •1.4 Второй закон термодинамики. Энтропия
- •1.4.1 Процессы самопроизвольные и несамопроизвольные,
- •1.4.2 Формулировки и математическое выражение
- •II закона термодинамики
- •1.4.3 Изменение энтропии – критерий направления
- •1.4.4 Статистическая интерпретация энтропии
- •1.4.5 Расчет изменения энтропии при протекании
- •1.4.6 Абсолютные значения энтропии твердых, жидких
- •1. Абсолютное значение энтропии твердых кристаллических тел.
- •2. Абсолютное значение энтропии жидкости.
- •3. Абсолютное значение энтропии газа.
- •1.5 Термодинамические потенциалы
- •Критерии оценки направления самопроизвольного протекания процессов
- •Раздел II. Растворы и гетерогенные равновесия
- •2.1 Основные понятия и определения
- •2.2 Химический потенциал
- •Условие термодинамического равновесия в растворе
- •2.4 Условие равновесия в гетерогенной системе
- •2.5 Правило фаз Гиббса
- •2.6 Равновесие в однокомпонентной двухфазной системе.
- •2.7 Применение правила фаз Гиббса к анализу диаграммы
- •2.8 Равновесие в гетерогенных системах, состоящих
- •2.8.1 Равновесие жидкость – пар. Закон Рауля
- •2.8.2 Коллигативные свойства растворов
- •2.8.3 Равновесие жидкость-жидкость. Распределение вещества
- •Раздел III. Химическое равновесие
- •3.1 Уравнение изотермы химической реакции
- •3.2 Влияние внешних условий на протекание химической реакции
- •Раздел IV. Электрохимия
- •4.1 Равновесие в растворах слабых электролитов
- •4.2 Термодинамика растворов сильных электролитов
- •4.3 Электрическая проводимость растворов электролитов
- •4.4 Электродвижущие силы и электродные потенциалы
- •Механизм возникновения электродных потенциалов и их расчет
- •Термодинамика гальванического элемента
- •Основные типы электродов и расчет их потенциала
- •Раздел V. Химическая кинетика и катализ
- •5.1 Основной закон химической кинетики.
- •5.2 Основы формальной кинетики кинетика необратимых реакций
- •5.3 Методы определения порядка реакции
- •3. Метод Вант-Гоффа.
- •5.4 Влияние температуры на скорость реакции
- •5.5 Основные понятия катализа
4.3 Электрическая проводимость растворов электролитов
В отсутствие внешнего электрического поля ионы в растворе находятся в непрерывном хаотическом тепловом движении. При возникновении разности потенциалов они приобретают направленное движение от одного полюса к другому: катионы и анионы движутся в противоположных направлениях. Таким образом, возникает электрический ток. В отличие от металлов, которые характеризуются электронным механизмом электропроводности, в растворах электролитов электричество переносится за счет движения ионов. Поэтому электролиты относят к проводникам второго рода.
Количественная характеристика способности системы проводить электрический ток – электрическая проводимость. Единицей электропроводности растворов электролитов служит удельная электрическая проводимость – величина, обратная удельному сопротивлению:
![]() ,
[Ом-1м-1
= См м-1]
,
[Ом-1м-1
= См м-1]
где – удельное сопротивление
![]() ;
;
R – общее сопротивление проводника, Ом;
l – длина проводника, м;
s – поперечное сечение проводника, м2.
Удельная электрическая проводимость раствора электролита – это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь 1 м2 и расположенными на расстоянии 1 м друг от друга.
Удельная электрическая проводимость зависит от
концентрации электролита;
вязкости и диэлектрической проницаемости растворителя;
температуры;
скорости движения ионов, которая зависит от величины заряда иона и его радиуса с учетом гидратации.
П ри
увеличении концентрации электролита
удельная электропроводность сначала
увеличивается, а затем уменьшается.
Такая зависимость характерна как для
сильных, так и для слабых электролитов.
Это объясняется для слабых электролитов
уменьшением степени диссоциации, а для
сильных – электростатическим
взаимодействием между ионами.
ри
увеличении концентрации электролита
удельная электропроводность сначала
увеличивается, а затем уменьшается.
Такая зависимость характерна как для
сильных, так и для слабых электролитов.
Это объясняется для слабых электролитов
уменьшением степени диссоциации, а для
сильных – электростатическим
взаимодействием между ионами.
Наряду с удельной электропроводностью в электрохимии используется молярная электрическая проводимость λ – электрическая проводимость, отнесенная к числу моль растворенного вещества в 1 м3 раствора:
![]() ,
[См м2
моль-1],
,
[См м2
моль-1],
где V – разведение (объем раствора, в котором содержится 1 моль электролита).
Для практических расчетов можно применять производные единицы измерения, например, если выразить концентрацию с в моль/дм3, то связь между молярной и удельной электропроводностью выражается уравнением:
![]() ;
[См дм2
моль-1],
;
[См дм2
моль-1],
Молярная электрическая проводимость раствора электролита равна электрической проводимости объема раствора электролита, содержащего 1 моль растворенного вещества и находящегося между двумя параллельными электродами площадью 1м2, расположенными на расстоянии 1 м друг от друга.
На рис. кривая I
соответствует сильному электролиту,
кривая II
– слабому электролиту.  Молярная
электропроводность всегда уменьшается
с увеличением концентрации электролита,
что объясняется электростатическим
взаимодействием между ионами. Чем больше
ионов в растворе, тем меньше расстояние
между ионами и сильнее взаимодействие,
таким образом, ионы мешают друг другу
перемещаться. С увеличением разбавления
молярная электропроводность возрастает
и при С
0 стремится к предельному значению λ.
(λ
– предельная
молярная электропроводность).
Поскольку в предельно разбавленном
растворе взаимодействие между ионами
отсутствует, можно принять, что каждый
ион движется независимо от других ионов
с максимальной скоростью.
Молярная
электропроводность всегда уменьшается
с увеличением концентрации электролита,
что объясняется электростатическим
взаимодействием между ионами. Чем больше
ионов в растворе, тем меньше расстояние
между ионами и сильнее взаимодействие,
таким образом, ионы мешают друг другу
перемещаться. С увеличением разбавления
молярная электропроводность возрастает
и при С
0 стремится к предельному значению λ.
(λ
– предельная
молярная электропроводность).
Поскольку в предельно разбавленном
растворе взаимодействие между ионами
отсутствует, можно принять, что каждый
ион движется независимо от других ионов
с максимальной скоростью.
В условиях предельного разбавления выполняется закон независимого движения ионов – закон Кольрауша, согласно которому предельная молярная электропроводность раствора электролита равна сумме молярных электропроводностей катиона и аниона при бесконечном разбавлении:
![]() ,
,
где
![]() - предельные электропроводности
(подвижности) катиона и аниона.
- предельные электропроводности
(подвижности) катиона и аниона.
Подвижность иона характеризует количество электричества, которое переносит ион и определяется абсолютной скоростью его движения (т.е. скоростью движения при напряженности электрического поля 1 В/м):
![]() ;
;
![]() ,
,
где F – число Фарадея F = 96480 Кл/моль;
![]() ,
,
![]() – абсолютные скорости движения катиона
и аниона в растворе данной концентрации
и при бесконечном разбавлении
соответственно.
– абсолютные скорости движения катиона
и аниона в растворе данной концентрации
и при бесконечном разбавлении
соответственно.
Абсолютная скорость движения большинства ионов равна (4 8)10-8 м2/(Вс). Исключение составляют только ионы Н+ и ОН–, абсолютные скорости движения которых очень велики.
Абсолютные скорости движения катионов и анионов неодинаковы, то доля электричества, переносимого отдельными ионами может различаться. Для характеристики количества электричества, переносимого данным видом ионов применяют числа переноса. Число переноса – это отношение количества электричества, перенесенного данным видом ионов к общему количеству электричества, перенесенного раствором электролита. Числа переноса катионов t+ и анионов t– можно выразить через электропроводности:
![]() ;
;
![]() .
.
Таким образом, числа переноса – это относительные подвижности ионов. Сумма чисел переноса катионов и анионов
![]() .
.
Влияние межионного взаимодействия на электропроводность раствора отражает коэффициент электрической проводимости f:
![]() .
.
Взаимосвязь с f и степенью диссоциации можно выразить уравнением:
![]() .
.
Для растворов слабых электролитов межионным взаимодействием можно пренебречь, тогда f 1, тогда
![]()
из чего следует
![]() .
.
Таким образом, измерив электропроводность раствора определенной концентрации, можно определить степень диссоциации электролита. Значение λ можно рассчитать по уравнению Кольрауша на основе справочных данных или определить экспериментально. Для этого измеряется электропроводность растворов слабого электролита различной концентрации. В соответствии с законом разбавления Оствальда
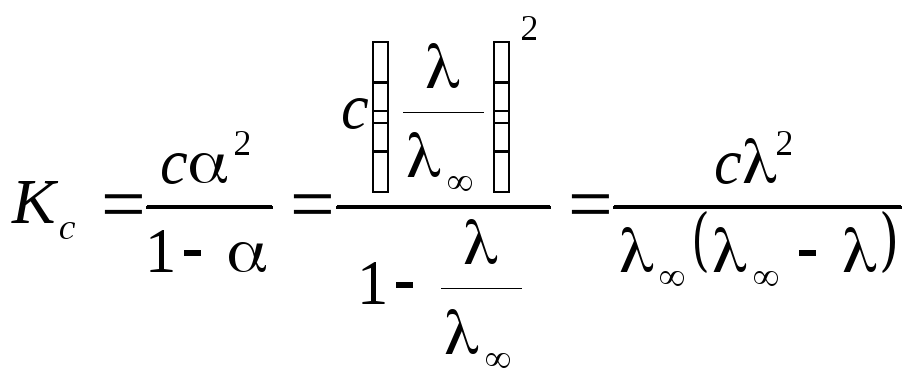 .
.
Приведем уравнение к линейному виду, разделив единицу на правую и левую части:
![]() ;
;
![]() .
.
Разделим на
![]() :
:
![]() .
.
П олучили
уравнение линейного вида
олучили
уравнение линейного вида![]() ,
где
,
где![]() ,
,![]() ,
,![]() ,
,![]() .
Для определенияλ
и Кс
строится график в координатах
.
Для определенияλ
и Кс
строится график в координатах
![]() ,
в соответствии с которым
,
в соответствии с которым![]() ,
,![]() ,
,![]() .
.
Зависимость электропроводности раствора слабого электролита от концентрации можно выразить с помощью уравнения Оствальда. Для раствора слабого бинарного электролита ( << 1) в соответствии с законом разбавления Оствальда получим:
 ,
,
тогда
![]() .
.
Из уравнения следует, что молярная электропроводность раствора слабого электролита уменьшается с увеличением концентрации.
Для сильных электролитов α ≈ 1, тогда
![]() ;
;
![]() ,
,
следовательно, по значению электрической проводимости раствора данной концентрации можно рассчитать коэффициент электропроводности.
Зависимость молярной электропроводности раствора сильного электролита от концентрации выражается уравнением Онзагера:
![]() ,
,
где а и b – теоретические коэффициенты, зависящие от диэлектрической проницаемости растворителя, вязкости растворителя и температуры.
Как видно из уравнения Онзагера, с увеличением концентрации электролита электропроводность раствора уменьшается.
С повышением температуры электропроводность растворов электролитов увеличивается. Это объясняется понижением вязкости раствора с возрастанием температуры и увеличением скорости перемещения ионов, а для слабых электролитов также увеличением степени диссоциации.
