
- •Министерство образования и науки рф
- •Введение
- •Раздел I. Основы химической термодинамики
- •1.1 Основные понятия, используемые в химической термодинамике
- •1.2 Первый закон термодинамики
- •1.3 Термохимия
- •1.3.1 Закон Гесса и следствия из него. Расчет тепловых эффектов
- •1.3.2 Понятие о теплоемкости веществ
- •1.3.3 Влияние температуры на тепловой эффект
- •1.4 Второй закон термодинамики. Энтропия
- •1.4.1 Процессы самопроизвольные и несамопроизвольные,
- •1.4.2 Формулировки и математическое выражение
- •II закона термодинамики
- •1.4.3 Изменение энтропии – критерий направления
- •1.4.4 Статистическая интерпретация энтропии
- •1.4.5 Расчет изменения энтропии при протекании
- •1.4.6 Абсолютные значения энтропии твердых, жидких
- •1. Абсолютное значение энтропии твердых кристаллических тел.
- •2. Абсолютное значение энтропии жидкости.
- •3. Абсолютное значение энтропии газа.
- •1.5 Термодинамические потенциалы
- •Критерии оценки направления самопроизвольного протекания процессов
- •Раздел II. Растворы и гетерогенные равновесия
- •2.1 Основные понятия и определения
- •2.2 Химический потенциал
- •Условие термодинамического равновесия в растворе
- •2.4 Условие равновесия в гетерогенной системе
- •2.5 Правило фаз Гиббса
- •2.6 Равновесие в однокомпонентной двухфазной системе.
- •2.7 Применение правила фаз Гиббса к анализу диаграммы
- •2.8 Равновесие в гетерогенных системах, состоящих
- •2.8.1 Равновесие жидкость – пар. Закон Рауля
- •2.8.2 Коллигативные свойства растворов
- •2.8.3 Равновесие жидкость-жидкость. Распределение вещества
- •Раздел III. Химическое равновесие
- •3.1 Уравнение изотермы химической реакции
- •3.2 Влияние внешних условий на протекание химической реакции
- •Раздел IV. Электрохимия
- •4.1 Равновесие в растворах слабых электролитов
- •4.2 Термодинамика растворов сильных электролитов
- •4.3 Электрическая проводимость растворов электролитов
- •4.4 Электродвижущие силы и электродные потенциалы
- •Механизм возникновения электродных потенциалов и их расчет
- •Термодинамика гальванического элемента
- •Основные типы электродов и расчет их потенциала
- •Раздел V. Химическая кинетика и катализ
- •5.1 Основной закон химической кинетики.
- •5.2 Основы формальной кинетики кинетика необратимых реакций
- •5.3 Методы определения порядка реакции
- •3. Метод Вант-Гоффа.
- •5.4 Влияние температуры на скорость реакции
- •5.5 Основные понятия катализа
2.6 Равновесие в однокомпонентной двухфазной системе.
Уравнение Клаузиуса-Клапейрона
Рассмотрим двухфазную однокомпонентную систему. При равновесии в соответствии с теоремой равновесия Гиббса:
![]() .
.
Так как состав фаз постоянен, то химический потенциал компонента зависит только от внешних параметров р и Т:
![]() .
.
Продифференцировав, получим
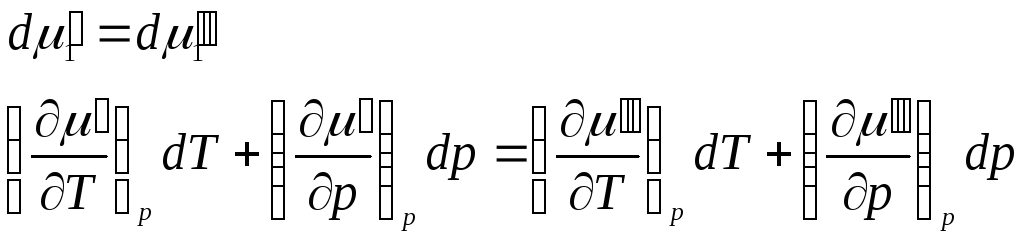 .
.
Так как химический
потенциал чистого компонента – есть
парциальная мольная энергия Гиббса
(![]() ),
то
),
то
![]() ,
,
где
![]() - мольная энтропия компонента в первой
и второй фазах соответственно;
- мольная энтропия компонента в первой
и второй фазах соответственно;
![]() - мольный объем
компонента в первой и второй фазах
соответственно.
- мольный объем
компонента в первой и второй фазах
соответственно.
Преобразуем:
![]() .
.
Разность
![]() - есть изменение мольной энтропии при
переходе вещества из фазы «′» в фазу
«″», то есть это энтропия фазового
превращения. Тогда
- есть изменение мольной энтропии при
переходе вещества из фазы «′» в фазу
«″», то есть это энтропия фазового
превращения. Тогда

Изменение энтропии при фазовом превращении
 ,
,
где
![]() – мольная теплота фазового перехода;
– мольная теплота фазового перехода;
Тф.п. – температура фазового перехода,
следовательно,
 . (2.6)
. (2.6)
Полученное уравнение (2.6) – уравнение состояния однокомпонентной двухфазной системы Клаузиуса-Клапейрона.
Применим полученное уравнение к различным процессам.
В процессе плавления
производная dp/dT
показывает, на какую величину нужно
изменить давление, чтобы изменить
температуру плавления вещества на 1
градус. Для большинства веществ плотность
ρт
> ρж,
тогда
![]() и
и![]() .
Следовательно, с повышением давления
температура плавления будет увеличиваться.
Еслиρт
< ρж,
например, для воды (глицерина или
висмута), то
.
Следовательно, с повышением давления
температура плавления будет увеличиваться.
Еслиρт
< ρж,
например, для воды (глицерина или
висмута), то
![]() и
и![]() и с повышением давления температура
плавления будет снижаться.
и с повышением давления температура
плавления будет снижаться.
Для процесса
возгонки твердого вещества или испарения
жидкости можно допустить, что
![]() .
Если паровую фазу можно считать идеальной,
то в соответствии с уравнением
Менделеева-Клапейрона
.
Если паровую фазу можно считать идеальной,
то в соответствии с уравнением
Менделеева-Клапейрона
![]() ,
,
тогда уравнение (2.6) запишется:
 .
.
Разделив переменные
и проинтегрировав в определенных
пределах в узком интервале температур,
считая
![]() постоянной величиной, получим
постоянной величиной, получим
 , (2.7)
, (2.7)
где
![]() – среднее значение мольной теплоты
фазового перехода в интервале температур
отТ1
до Т2.
– среднее значение мольной теплоты
фазового перехода в интервале температур
отТ1
до Т2.
На основе полученного уравнения (2.7) можно рассчитать:
температуру кипения вещества Т2 под давлением р2, если известна температура кипения Т1 этого вещества под давлением р1 и величина средней мольной теплоты испарения;
давление насыщенного пара индивидуального вещества р2 при температуре Т2, если известно давление насыщенного пара р1 при температуре Т1 и средняя мольная теплота испарения;
среднюю мольную теплоту испарения или возгонки вещества, если известны значения давления насыщенного пара вещества при двух температурах.
2.7 Применение правила фаз Гиббса к анализу диаграммы
состояния однокомпонентной системы
П рименим
правило фаз Гиббса к анализу диаграммы
состояния однокомпонентной системы,
например, воды (рис. 2.1). В области средних
давлений и средних температур вода
может находиться в жидком состоянии,
твердом (лед) и газообразном (пар). Так
как система однокомпонентная, ее
состояние характеризуется только двумя
внешними параметрами:р
и Т.
рименим
правило фаз Гиббса к анализу диаграммы
состояния однокомпонентной системы,
например, воды (рис. 2.1). В области средних
давлений и средних температур вода
может находиться в жидком состоянии,
твердом (лед) и газообразном (пар). Так
как система однокомпонентная, ее
состояние характеризуется только двумя
внешними параметрами:р
и Т.
Рис.2.1 Диаграмма состояния воды:
ОВС – состояние жидкой воды;
АОС – состояние пара;
АОD – состояние льда;
О – тройная точка;
ОВ – кривая плавления;
ОС – кривая испарения;
ОА – кривая возгонки;
ОD – кривая давления насыщенного пара над переохлажденной водой.
Рассмотрим различные равновесные состояния системы.
1. Если вода находится в однофазном состоянии, то m = 1, тогда
![]() .
.
Если C = 2, то мы можем произвольно в определенных пределах изменять два параметра: р и Т независимо друг от друга, при этом число и вид фаз системы не изменится. На диаграмме такому состоянию системы отвечают три плоскости, характеризующие состояние жидкой воды, пара и льда: OBC, AOC и AOD.
2. Если в равновесии находятся двухфазная гетерогенная система (жидкая вода – пар; жидкая вода – лед; лед – пар), то
![]()
Если С = 1, то возможно изменение только одного параметра: Т или р. На диаграмме такое состояние характеризуется тремя кривыми: ОС, ОВ и ОА, которые описываются уравнением Клаузиуса-Клапейрона. Например, если изменится температура, то в соответствии с уравнением будет меняться и давление, т.е. независимо изменяется только один параметр. Кривая ОВ показывает, что с повышением давления температура плавления льда уменьшается. Это также следует из уравнения Клаузиуса-Клапейрона.
3. Если в равновесии находится трехфазная система (вода – лед – пар), тогда
![]()
Если С = 0, то ни один из параметров состояния изменить нельзя. Это означает, что три фазы могут находиться в равновесии только при определенных условиях. На диаграмме такое состояние выражается точкой О, которая называется тройной. Если изменится Т или р, то изменится число фаз (система станет однофазной или двухфазной) и установится другое равновесное состояние.
