
- •Министерство образования и науки рф
- •Введение
- •Раздел I. Основы химической термодинамики
- •1.1 Основные понятия, используемые в химической термодинамике
- •1.2 Первый закон термодинамики
- •1.3 Термохимия
- •1.3.1 Закон Гесса и следствия из него. Расчет тепловых эффектов
- •1.3.2 Понятие о теплоемкости веществ
- •1.3.3 Влияние температуры на тепловой эффект
- •1.4 Второй закон термодинамики. Энтропия
- •1.4.1 Процессы самопроизвольные и несамопроизвольные,
- •1.4.2 Формулировки и математическое выражение
- •II закона термодинамики
- •1.4.3 Изменение энтропии – критерий направления
- •1.4.4 Статистическая интерпретация энтропии
- •1.4.5 Расчет изменения энтропии при протекании
- •1.4.6 Абсолютные значения энтропии твердых, жидких
- •1. Абсолютное значение энтропии твердых кристаллических тел.
- •2. Абсолютное значение энтропии жидкости.
- •3. Абсолютное значение энтропии газа.
- •1.5 Термодинамические потенциалы
- •Критерии оценки направления самопроизвольного протекания процессов
- •Раздел II. Растворы и гетерогенные равновесия
- •2.1 Основные понятия и определения
- •2.2 Химический потенциал
- •Условие термодинамического равновесия в растворе
- •2.4 Условие равновесия в гетерогенной системе
- •2.5 Правило фаз Гиббса
- •2.6 Равновесие в однокомпонентной двухфазной системе.
- •2.7 Применение правила фаз Гиббса к анализу диаграммы
- •2.8 Равновесие в гетерогенных системах, состоящих
- •2.8.1 Равновесие жидкость – пар. Закон Рауля
- •2.8.2 Коллигативные свойства растворов
- •2.8.3 Равновесие жидкость-жидкость. Распределение вещества
- •Раздел III. Химическое равновесие
- •3.1 Уравнение изотермы химической реакции
- •3.2 Влияние внешних условий на протекание химической реакции
- •Раздел IV. Электрохимия
- •4.1 Равновесие в растворах слабых электролитов
- •4.2 Термодинамика растворов сильных электролитов
- •4.3 Электрическая проводимость растворов электролитов
- •4.4 Электродвижущие силы и электродные потенциалы
- •Механизм возникновения электродных потенциалов и их расчет
- •Термодинамика гальванического элемента
- •Основные типы электродов и расчет их потенциала
- •Раздел V. Химическая кинетика и катализ
- •5.1 Основной закон химической кинетики.
- •5.2 Основы формальной кинетики кинетика необратимых реакций
- •5.3 Методы определения порядка реакции
- •3. Метод Вант-Гоффа.
- •5.4 Влияние температуры на скорость реакции
- •5.5 Основные понятия катализа
2.8.2 Коллигативные свойства растворов
Коллигативными называются физико-химические свойства разбавленных растворов, не зависящие от природы растворенного вещества и определяющиеся только его концентрацией и природой растворителя. К таким свойствам относятся: понижение давления пара над раствором по сравнению с чистым растворителем, понижение температуры замерзания и повышение температуры кипения раствора по сравнению с чистым растворителем, осмотическое давление.
Понижение давления пара над раствором по сравнению
с чистым растворителем
Рассмотрим разбавленный раствор нелетучего вещества. Для такого раствора коэффициент активности i-го компонента γi → 1 и ai → xi. Зависимость давления пара i-го компонента над раствором от его мольной доли выражается уравнением Рауля:
![]() .
.
Пусть 1 – летучий растворитель, а 2 – нелетучее растворенное вещество. Общее давление пара над раствором равно
![]() .
.
Давление пара над чистым нелетучим веществом р2 ≈ 0, следовательно им можно пренебречь, тогда
![]()
Так как мольная доля x < 1, то давление пара над раствором нелетучего вещества ниже по сравнению с давлением пара над чистым растворителем при той же температуре (рис. 2.5).
В ыразим
мольную долю растворителях1
через мольную долю растворенного
вещества х2:
ыразим
мольную долю растворителях1
через мольную долю растворенного
вещества х2:
![]() ,
,
тогда получим
![]()
Преобразуем
 .
(2.9)
.
(2.9)
У
Рис.
2.5. Зависимость давления насыщенного
пара от температуры для раствора и
чистого растворителя
вещества по сравнению с давлением пара чистого растворителя при той же температуре равно мольной доле растворенного вещества.
На рисунке:
1 – кривая зависимости давления насыщенного пара над чистым твердым растворителем (кривая возгонки)
2 – кривая зависимости давления насыщенного пара над чистым жидким растворителем (кривая испарения);
3 – кривая зависимости давления насыщенного пара над раствором нелетучего вещества с мольной долей х2;
р10 – давление насыщенного пара над чистым растворителем при температуре Т1;
р1 – давление насыщенного пара над раствором при температуре Т1.
Из рисунка видно, что р1 < р10.
Повышение температуры кипения растворов
Рассмотрим раствор
нелетучего вещества находящийся в
равновесии с паром. Так как растворенное
вещество нелетучее, то в паре будет
находиться только растворитель. Тогда
в соответствии с теоремой Гиббса
химический потенциал растворителя в
растворе
![]() и химический потенциал чистого
растворителя в паровой фазе
и химический потенциал чистого
растворителя в паровой фазе![]() одинаковы:
одинаковы:
![]()
При р = const химический потенциал растворителя в растворе зависит от состава раствора и температуры, а в паровой фазе, находящейся в равновесии с раствором –только от температуры:
![]() ,
,
где х1 – мольная доля растворителя в растворе.
Продифференцируем
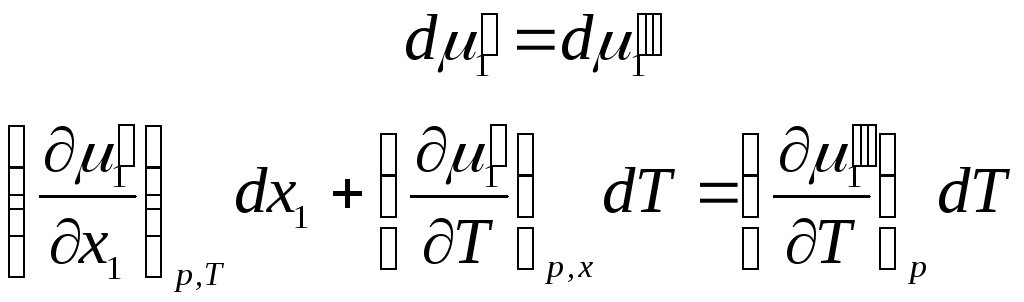 .
.
Зависимость химического потенциала компонента раствора от его состава при Т = const выражается уравнением:
![]() ,
,
тогда
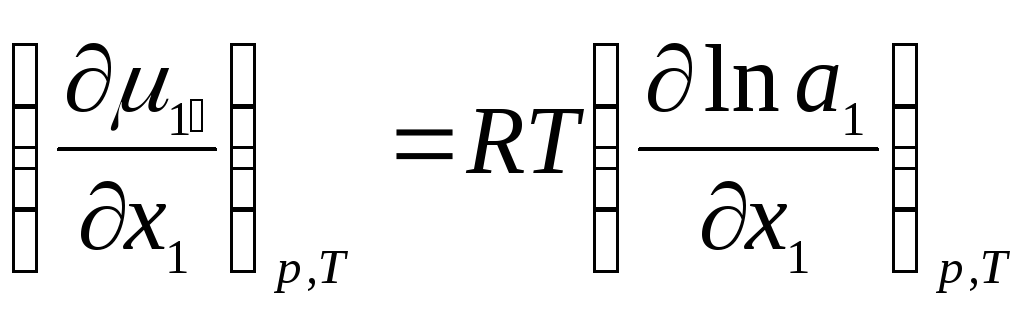 .
.
С учетом того, что
при р, Т =
const
![]() ,
получим:
,
получим:
 ,
,
где
![]() – парциальная мольная энтропия
растворителя в растворе данного состава;
– парциальная мольная энтропия
растворителя в растворе данного состава;
![]() –мольная энтропия
чистого растворителя в паровой фазе.
–мольная энтропия
чистого растворителя в паровой фазе.
Преобразуем:
![]() .
.
Рассмотрим
разбавленный раствор твердого вещества,
мольная доля растворенного вещества
х2
→ 0, а активность растворителя
![]() .
Выразимх1
через х2
и подставим в уравнение
.
Выразимх1
через х2
и подставим в уравнение
х1 = 1 – х2,
![]() .
.
Если х2 << 1, то можно принять
![]() .
.
С учетом этого получим:
![]()
В числителе получаем парциальную мольную энтропию испарения растворителя
![]() .
.
Так как раствор разбавленный, то можно принять, что парциальная мольная энтропия испарения растворителя из раствора равна мольной энтропии испарения чистого растворителя:
![]() ,
,
В результате получим:
 .
.
Процесс испарения идет при температуре кипения: Т = Тк = const. Пусть температура кипения чистого растворителя равна Тк0 а раствора – Тк, мольная доля растворенного вещества в чистом растворителе х2 = 0, а в растворе – х2. Проинтегрируем в интервале от Тк0 до Тк:
 ;
;
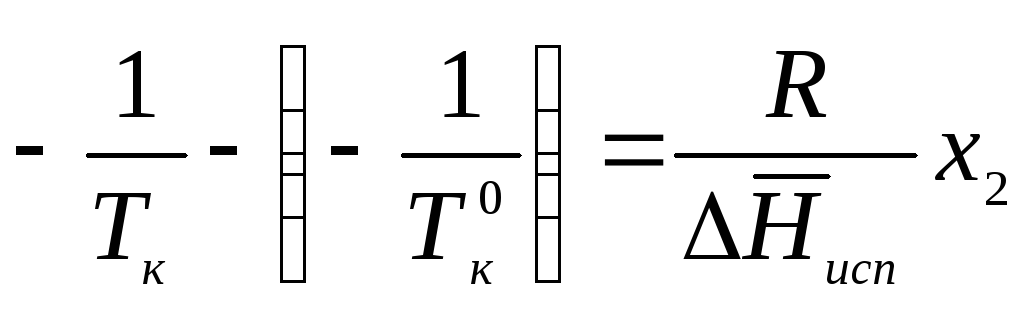 ;
;

Температуры кипения
Тк0
и Тк
выражены в К, следовательно,
![]() ,
поэтому в произведении
,
поэтому в произведении![]() можноТк
заменить на Тк0,
не вводя большой ошибки. Тогда получим
можноТк
заменить на Тк0,
не вводя большой ошибки. Тогда получим

Таким образом, при р = const раствор нелетучего вещества кипит при более высокой температуре, чем чистый растворитель (рис. 2.6). Повышение температуры кипения раствора нелетучего вещества по сравнению с температурой кипения чистого растворителя прямо пропорционально мольной доле растворенного вещества. Полученное уравнение справедливо только для разбавленных растворов.
На рисунке:
Тк10 – температура кипения чистого растворителя при давлении р1;
Тк1 – температура кипения раствора при давлении р1.
Из рисунка видно, что Тк1 > Тк10.
О чень
часто вместо мольных долей используют
другие способы выражения концентрации
растворенного вещества, например,
моляльность:
чень
часто вместо мольных долей используют
другие способы выражения концентрации
растворенного вещества, например,
моляльность:

Тогда если М1 – молярная масса растворителя, а М2 – молярная масса растворенного вещества, то на 1000 г растворителя получим:
Рис.
2.6. Повышение температуры кипения
раствора по сравнению с
чистым растворителем
 ;
;![]() ,
,
тогда
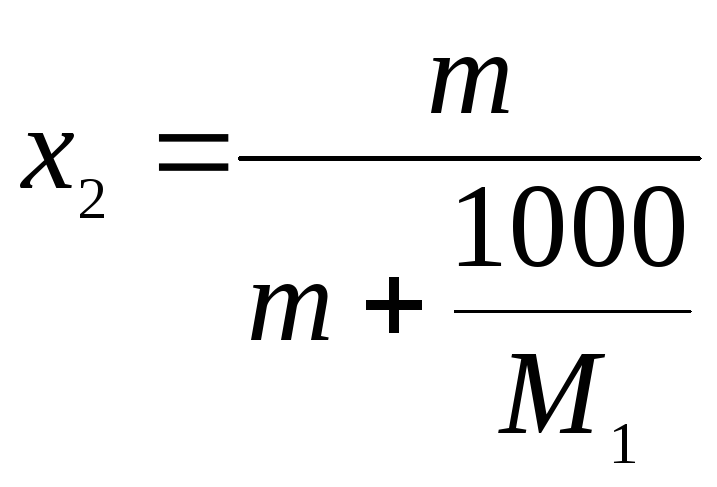 .
.
Поскольку раствор
разбавлен,

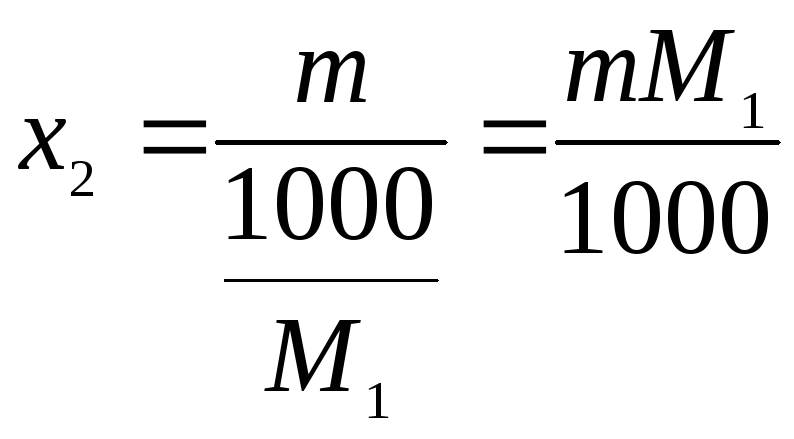 .
.
Подставим х2 в уравнение:
 .
.
Введем обозначение:
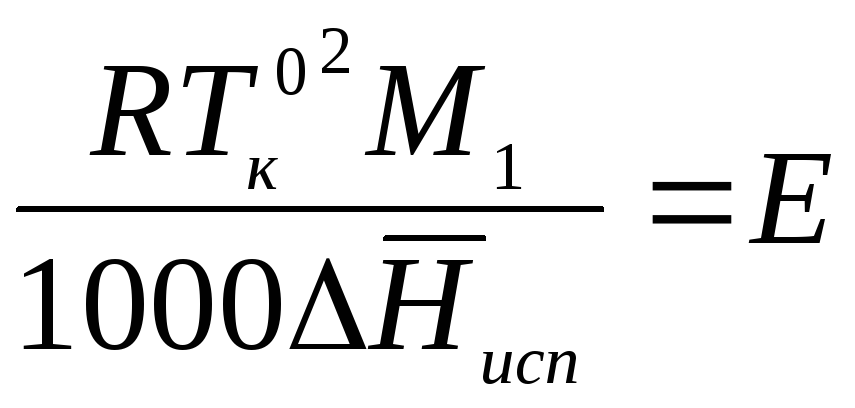 ,
,
где Е – эбулиоскопическая константа растворителя.
Тогда
![]() .
.
Эбулиоскопическая константа зависит от природы растворителя и не зависит от природы растворенного вещества. Физический смысл эбуллиоскопической константы: Е численно равна повышению температуры кипения раствора с концентрацией 1 моль/1000 г растворителя. Значения E для различных растворителей приведены в справочниках.
Если молекулы растворенного вещества подвергаются диссоциации, то число моль в растворе увеличивается. С учетом этого процесса уравнение для ∆Тк принимает вид:
![]() ,
,
где i – изотонический коэффициент или коэффициент Вант-Гоффа.
Коэффициент i равен отношению общего числа моль в растворе после диссоциации к числу моль растворенного вещества до диссоциации. Изотонический коэффициент можно определить по формуле:
![]() ,
,
где α – степень диссоциации электролита;
ν – число ионов, образующихся при диссоциации одной молекулы.
Физико-химические методы анализа, основанные на измерении повышения температуры кипения растворов, называются эбулиоскопическими. Эбулиоскопический метод применяется для для определения концентрации растворенного вещества, его молярной массы, изотонического коэффициента и степени диссоциации электролита. Для определения молярной массы растворенного вещества экспериментально измеряют ∆Тк раствора. Количество моль растворенного вещества в 1000 граммах растворителя, то есть моляльность можно выразить:
 ,
,
где g2 – масса растворенного вещества.
Тогда молярная масса растворенного вещества равна:
 .
.
Понижение температуры замерзания растворов
При охлаждении
разбавленных растворов нелетучих
веществ при определенной температуре
выкристаллизовывается растворитель,
т.е. появляется твердая фаза, образованная
чистым растворителем. Рассмотрим
разбавленный раствор нелетучего
вещества, находящийся в равновесии с
твердым растворителем. Тогда в соответствии
с теоремой Гиббса химический потенциал
растворителя в растворе
![]() и химический потенциал твердого
растворителя
и химический потенциал твердого
растворителя![]() одинаковы:
одинаковы:
![]()
Химический потенциал растворителя в растворе при постоянном давлении является функцией состава раствора и температуры, а твердого растворителя, находящегося в равновесии с раствором – функцией только температуры:
![]() .
.
Продифференцируем

Проведя аналогичные предыдущим преобразования, получим:
![]()
где
![]() – парциальная мольная энтропия
растворителя в растворе данного состава;
– парциальная мольная энтропия
растворителя в растворе данного состава;
![]() –мольная энтропия
твердого чистого растворителя.
–мольная энтропия
твердого чистого растворителя.
Разность, стоящая в числителе, равна парциальной мольной энтропии плавления:
![]()
Так как раствор разбавленный, то можно принять, что парциальная мольная энтропия плавления растворителя из раствора равна мольной энтропии плавления чистого растворителя:
![]() ,
,
![]() .
.
Аналогично предыдущему разделу можем принять, что
![]() ,
,
тогда
![]() .
.
Процессы плавления и кристаллизации противоположны и идут при Т = Тпл = Тз = const. Пусть температура замерзания чистого растворителя равна Тз0, а раствора – Тз. Мольная доля растворенного вещества в чистом растворителе х2 = 0, а в растворе – х2. Проинтегрируем в интервале Тз0 до Тз:
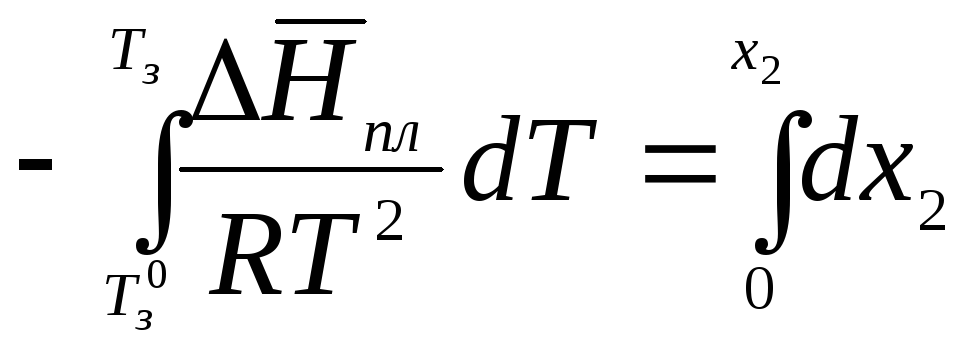 ;
;
 ;
;
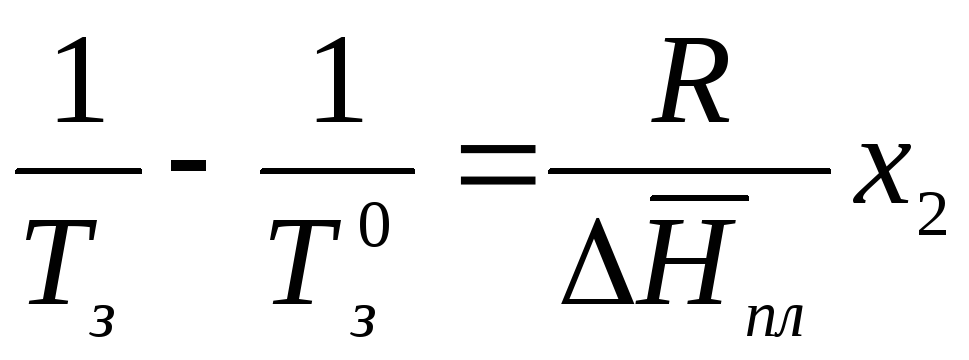

Аналогично заменяем
![]() на
на![]()

И з
полученного уравнения следует, что
раствор нелетучего вещества замерзает
при более низкой температуре, чем чистый
растворитель (рис. 2.7). Понижение
температуры замерзания разбавленного
раствора нелетучего вещества по сравнению
с температурой замерзания чистого
растворителя прямо пропорционально
мольной доле растворенного вещества.
з
полученного уравнения следует, что
раствор нелетучего вещества замерзает
при более низкой температуре, чем чистый
растворитель (рис. 2.7). Понижение
температуры замерзания разбавленного
раствора нелетучего вещества по сравнению
с температурой замерзания чистого
растворителя прямо пропорционально
мольной доле растворенного вещества.
На рисунке:
Т
Рис.
2.7. Понижение температуры замерзания
раствора по сравнению с
чистым растворителем
Тз – температура замерзания раствора.
Из рисунка видно, что Тз < Тз0.
Выразим мольную долю растворенного вещества через моляльность:
![]() ,
,
где К – криоскопическая константа растворителя.
Криоскопическая постоянная зависит от свойств растворителя и не зависит от природы растворенного вещества. Физический смысл криоскопической константы: К численно равна понижению температуры замерзания раствора с концентрацией 1 моль/1000 г растворителя.

Значения К для различных растворителей приведены в справочной литературе.
С учетом диссоциации растворенного вещества получим
![]()
Методы анализа, основанные на измерении понижения температуры замерзания, называются криоскопическими. Криоскопический метод также применяется для определения молярной массы, концентрации и степени диссоциации растворенного вещества и является более точным, чем эбуллиоскопический.
![]() .
.
Осмос. Осмотическое давление
Рассмотрим сосуд, разделенный на две части полупроницаемой мембраной (рис. 2.8). Заполним одну часть сосуда (I) чистым растворителем, а вторую (II) – раствором. заполненный индивидуальной жидкостью, например, водой. Мембрана пропускает молекулы растворителя, но не пропускает молекулы растворенного вещества. Раствор и растворитель, разделенные полупроницаемой мембраной, можно рассматривать как две фазы. Мембрана является границей раздела двух фаз.
В начальный момент времени химический
потенциал чистого растворителя (фазаI)
больше химического потенциала растворителя
в растворе (фаза II):
начальный момент времени химический
потенциал чистого растворителя (фазаI)
больше химического потенциала растворителя
в растворе (фаза II):
![]() .
.
С
Рис.
2.8. Осмометр (I –
растворитель, II–
раствор)
Осмос – самопроизвольное проникновение растворителя в раствор через полупроницаемую мембрану.
Проникновение растворителя в раствор и разбавление раствора можно предотвратить, если к нему приложить дополнительное давление.
Давление, которое необходимо приложить к раствору для предотвращения осмоса и приведения системы в равновесие, называется осмотическим давлением и обозначается π. Осмотическое давление не зависит от природы мембраны.
Получим уравнение для расчета осмотического давления.
Растворитель будет
проникать в раствор через полупроницаемую
перегородку до тех пор, пока в системе
не установится равновесие, которое
характеризуется равенством химических
потенциалов растворителя в растворе
![]() и чистого растворителя
и чистого растворителя![]() :
:
![]()
При
р,
Т
= const
![]() = const,
а
= const,
а
![]() .
Продифференцируем
.
Продифференцируем
![]() по составу раствора и давлению:
по составу раствора и давлению:
 .
.
Для разбавленного
раствора мольная доля растворенного
вещества х2
→ 0, а растворителя х1
→ 1, тогда
коэффициент активности γ1
→ 1, а активность растворителя
![]() .
Химический потенциал растворителя
можно выразить:
.
Химический потенциал растворителя
можно выразить:
![]() ,
,
тогда
 .
.
Так как химический потенциал – это парциальная мольная энергия Гиббса, то
 ,
,
где
![]() – парциальный мольный объем растворителя.
– парциальный мольный объем растворителя.
Для разбавленного раствора можно принять, что парциальный мольный объем растворителя равен его мольному объему.
Тогда
![]() .
.
Можно принять, что
![]() ,
,
тогда
![]() .
.
Проинтегрируем в
интервале от внешнего давления
![]() до общего давления
до общего давления![]() :
:
 ,
,
где π – избыточное давление, необходимо приложить к раствору с мольной долей х2 для предотвращения осмоса и сохранения равновесия в системе. Поэтому общее давление равно сумме внешнего давления и избыточного (осмотического).
После интегрирования получаем:
 .
.
Для разбавленных растворов
 ,
,
тогда
 .
.
Произведение
![]() ,
,
где V – объем растворителя.
Тогда
 ,
,
где с – число моль растворенного вещества в единице объема раствора (молярная концентрация).
Тогда уравнение для расчета осмотического давления примет вид:
![]() .
.
Полученное уравнение – уравнение Вант-Гоффа – подобно уравнению Менделеева-Клапейрона:
![]() .
.
Оно показывает, что осмотическое давление равно давлению, которое воспроизводило растворенное вещество, если бы оно в виде идеального газа занимало тот же объем, что и в растворе при той же температуре.
Если растворенное вещество диссоциирует, то осмотическое давление рассчитывается по формуле:
![]() .
.
Явление осмоса лежит в основе различных методов очистки и разделения смесей, которые называются мембранными. Если со стороны раствора приложить внешнее давление, превышающее осмотическое, то равновесие нарушится и химический потенциал растворителя в растворе станет больше, чем чистого растворителя:
![]()
Растворитель будет переходить через полупроницаемую перегородку из раствора в чистый растворитель и будет иметь место концентрирование раствора. Данное явление называется обратным осмосом, а метод разделения жидкой смеси – обратно-осмотическим. Обратный осмос широко применяется для деминерализации воды.
