
Кошкин
.pdf
6.5.5. Неорганические соединения
Общее содержание неорганических соединений в лубяных волокнах около 1 %. Они распределяются следующим образом: Р2О5-2,9%, К2О-17, СаО49,2, MgO-3,1, Mn2O3-0,9, SiO2 - 12,6, SO3 - 3,9, Fe2O3 + А12О3 - 7,7, Cl - 0,2 % от чистой золы.
6.6. Фотосинтетическая деятельность
Рассмотрим важнейшие показатели, характеризующие фотосинтетическую деятельность растений льна в ходе онтогенеза.
6.6.1. Динамика формирования поверхности листьев, индекс листовой поверхности, фотосинтетический потенциал
От всходов до начала периода быстрого роста растение достигает высоты 12 см и имеет площадь листьев 3—5 см2. В период быстрого роста суммарная площадь листьев быстро возрастает (за счет увеличения числа листьев) и достигает максимума в фазе бутонизации — начала цветения (от 20 до 90 см2 у разных сортов). К фазе желтой спелости площадь поверхности листьев снижается за счет их отмирания.
Известно, что растения с узкими листьями, расположенными вертикально и равномерно по длине стебля, имеют высокий ИЛП (8—10). Растение льна имеет именно такую архитектонику, а индекс листовой поверхности колеблется от 2,5 до 13.
Поверхность стебля льна начинает вносить свой вклад в формирование фотосинтетического поверхностного потенциала с момента всходов. Это отличает лен от многих культурных растений, у которых стебель формирует поверхность позднее. В фазе елочки поверхность стебля составляет 37 % от общей поверхности растения, а в фазе зеленой спелости — более 60 % (рис. 72).
Рис. 72. Площадь фотосннтезнрукмцей поверхности листьев (/) и стебля (2) растений льна в онтогенезе
231
6.6.2. Содержание хлорофилла
Максимальное общее содержание хлорофилла в листьях льна наблюдается в фазе цветения (табл. 39). Особенностью льна является более медленное накопление хлорофилла в период быстрого роста по сравнению с накоплением сухой массы: содержание его в листьях увеличивалось в 4 раза, тогда как сухая масса листьев возрастала в 5 раз. Именно поэтому в период быстрого роста отмечается снижение содержания хлорофилла, рассчитанное на грамм сухой массы листьев. В фазе зеленой спелости этот показатель значительно увеличивается, что объясняется скорее потерей большой части листьев в это время, чем убылью хлорофилла из них. У льна содержание хлорофилла в растении варьирует от 0,8 до 2,8 мг/раст.
39. Динамика содержания хлорофилла в листьях в процессе развития льна
Фаза (период) развития |
Содержание хлорофилла |
|
растения |
мг/лист |
мг/г сухой массы листьев |
Елочка |
0,210 |
10,5 |
Быстрый рост |
0,686 |
7,6 |
Цветение |
0,900 |
9,0 |
Зеленая спелость |
0,810 |
17,5 |
У льна-долгунца, как и у всех травянистых растений, содержат хлорофилл и фотосинтезируют не только листья, но и стебли, а начиная с фазы бутонизации и репродуктивные органы — метелки. Вклад нелистовых органов в содержание хлорофилла в фазе цветения — зеленой спелости в целом растении увеличивается.
6.6.3. Интенсивность фотосинтеза
Лен-долгунец имеет сравнительно невысокую интенсивность фотосинтеза. Ее значения максимальны в фазе цветения — зеленой спелости
(табл. 40).
40. Показатели фотосинтетической деятельности
|
|
Содержание |
Интенсивность |
|
||
Фаза |
|
хлорофилла |
фотосинтеза |
Ассимиляционное |
||
|
|
|
(мг СО2 / |
|
||
развития |
Орган растения |
мг/орган |
|
|
число, мг СО2/(мг |
|
% |
орган |
% |
||||
растения |
|
растения |
растения • |
хлорофилла- ч) |
||
|
|
|
|
|
||
|
|
|
|
ч) |
|
|
Период |
Листья |
0,686 |
82 |
0,82 |
82 |
1,2 |
быстрого |
Стебель |
0,150 |
18 |
0,18 |
18 |
1,2 |
роста |
Все растение |
0,836 |
100 |
1,00 |
100 |
1,2 |
Зеленая |
Листья |
0,810 |
29 |
0,75 |
34 |
0,9 |
Стебель |
1,300 |
47 |
0,53 |
24 |
0,4 |
|
спелость |
Метелки |
0,670 |
24 |
0,92 |
42 |
1,4 |
|
Все растение |
2,780 |
100 |
2,20 |
100 |
0,9 |
232
Впериод быстрого роста основные фотосинтезирующие органы — листья, хотя стебель также вносит довольно значительный вклад в фотосинтез всего растения. В фазе зеленой спелости интенсивность фотосинтеза целого растения выше, чем в период быстрого роста, поскольку растение имеет и максимальную массу, и более высокое содержание хлорофилла по органам. Несмотря на все еще высокую интенсивность фотосинтеза листьев, их вклад в фотосинтез целого растения снижается с 82 до 34 %. Самый высокий относительный вклад в фотосинтез растения вносят метелки.
Впериод быстрого роста ассимиляционные числа у листьев и стеблей одинаковы, а в фазе зеленой спелости, несмотря на более высокое содержание хлорофилла в них, эффективность его работы в отличие от метелок становится ниже.
Несмотря на то что индивидуальное растение льна-долгунца имеет невысокие значения интенсивности фотосинтеза, у посева льна более высокие величины КПД ФАР (3,61 %) по сравнению с большинством других сельскохозяйственных культур (1,9—2,7 %). Это объясняется высокими показателями энергетической эффективности фотосинтеза нижних (затененных) листьев растений в посевах с высоким ИЛП.
6.6.4. Чистая продуктивность фотосинтеза
Значения ЧПФ у льна за вегетационный период колеблются при различных условиях выращивания от 1 до 22 г/(м2 • сут), что вполне соизмеримо с величинами ЧПФ, рассчитанными для других культурных растений. Наиболее высокие значения ЧПФ обычно наблюдают в период быстрого роста (табл. 41).
41. Изменение ЧПФ в онтогенезе
|
|
ЧПФ |
|
Период определения ЧПФ |
|
|
мг сухой массы |
г/(м2∙суг) |
|
растения/мг |
|
|
|
|
хлорофилла в |
|
|
|
растении за 1 сут |
Всходы — елочка |
7,0 |
|
13,1 |
Елочка — цветение (быстрый |
10,5 |
|
15,0 |
рост) |
|
||
|
|
|
|
Цветение — зеленая спелость |
7,6 |
|
8,3 |
В последние годы появляется все больше данных о более тесной корреляции продуктивности сельскохозяйственных растений с содержанием хлорофилла в них, чем с площадью ассимилирующей поверхности. Имея в виду это обстоятельство, определяют также ЧПФ в миллиграммах сухой массы на миллиграмм хлорофилла за сутки, которая снижается по мере старения растений.
233
6.7. Интенсивность и направленность оттока ассимилятов
Ниже точки слома стебель льна легко разделяется вдоль на наружную и внутреннюю части. Разделение происходит по внутренней поверхности лубяных пучков. Внутренняя часть стебля представлена в основном ксилемой и является гетеротрофной. В наружной части стебля, куда входят лубяные волокна, почти все ткани содержат активно функционирующие хлоропласты.
Через 1 сут после двухминутного фотосинтеза целых растений льна в атмосфере 14СО2 происходит существенное перераспределение метки по органам (табл. 42). В период быстрого роста единственным донором ассимилятов служат листья. Через 1 сут после фотосинтеза с 14СО2 из них экспортируется 66 % меченых ассимилятов. Все транспортируемые из листьев ассимиляты поступают в стебель, причем основным их акцептором являются внутренняя часть стебля — ксилема (62 %) и растущая верхушка стебля (32 %); наружная (содержащая лубяные волокна) часть акцептор весьма слабый: в него попадает всего 7 % оттекших из листа ассимилятов.
42. Перераспределение метки по органам растений через 1 сут после двухминутной экспозиции целых растений льна в атмосфере 14СО2 (тыс. имп/мин)
Орган и часть |
Период быстрого роста |
Фаза зеленой спелости |
||
растения |
2 мин |
24 ч |
2 мин |
24 ч |
Листья |
408 |
139 |
372 |
73 |
Стебель, в том числе: |
92 |
361 |
271 |
370 |
верхушка |
54 |
139 |
Нет верхушки |
|
«волокно» |
38 |
56 |
271 |
125 |
«ксилема» |
0 |
166 |
0 |
245 |
Метелка |
Нет |
метелки |
457 |
657 |
Примечание. Верхушка — верхняя часть стебля до точки слома; «волокно» — наружная часть стебля ниже точки слома, содержащая эпидермис, коровую паренхиму, лубяные волокна; «ксилема» — внутренняя часть стебля ниже точки слома, состоящая в основном из ксилемы, но содержащая камбий, сосуды флоэмы и сердцевину.
На более поздних стадиях развития растений донорно-акцепторные отношения изменяются. Донором ассимилятов, кроме листьев, становится и наружная часть стебля. В фазе зеленой спелости из листьев экспортируется 80 % образовавшихся в них ассимилятов, из луба — 54 %. Наружная часть стебля не только обеспечивает свои потребности за счет собственного фотосинтеза, но и экспортирует значительную их часть. Основными акцепторами продуктов фотосинтеза, образовавшихся в листьях и наружной
234

части стебля, являются ксилема (55 %) и метелка с коробочками (45 %). Метелка для своего роста и развития в значительной степени использует собственные ассимиляты, образованные в процессе фотосинтеза.
Возникает вопрос, за счет каких ассимилятов образуются лубяные волокна. Судя по тому, что радиоактивность содержащей эти клетки части стебля не возрастает со временем, волокна если и используют часть ассимилятов листьев, то очень небольшую. Основными источниками ассимилятов для образования льняного волокна, по крайней мере на этапе утолщения его клеточной стенки, служат либо собственные хлоропласты волокна, либо клетки окружающей коровой паренхимы.
6.8.Дыхание
Врасчете на единицу сухой массы листья и стебель льна имеют самые высокие значения интенсивности темнового дыхания в фазе елочки, за исключением ИД репродуктивных органов в фазе цветения (рис. 73). Стебель льна по сравнению с листьями отличается более низкой интенсивностью темнового дыхания. В дальнейшем дыхательная активность этих органов уменьшается, однако даже у начавших желтеть листьев она не падает ниже 5 мг/(г сухой массы • ч).
Рис. 73. Интенсивность темнового дыхания различных органов в онтогенезе льна: □ — листья; ЕЗ — стебель;∙— репродуктивные органы
235
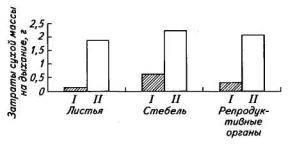
Рис. 74. Затраты на дыхание на рост (I) и дыхание на поддержание (II) отдельных органов растений льна за вегетационный период
В отличие от интенсивности темнового дыхания, рассчитанной на единицу массы, интенсивность темнового дыхания в расчете на всю массу растения имеет самые высокие значения в фазе зеленой спелости, при этом основной вклад вносит дыхание стебля (1,6 мг СО2/ч). Лен характеризуется довольно высокими величинами интенсивности темнового дыхания репродуктивных органов.
Расчетные показатели затрат на дыхание на рост и дыхание на поддержание свидетельствуют, что у льна затраты на дыхание роста листьев, стебля и репродуктивных органов составляют соответственно 5, 22 и 14 % от общих расходов дыхательного субстрата за вегетацию (рис. 74).
6.9. Биосинтез компонентов льняного волокна
Изучение биосинтеза компонентов льняных волокон крайне затруднено тем, что эти клетки находятся в толще стебля. Их выделение без повреждения практически невозможно, особенно на ранних стадиях развития. Тем не менее существуют приемы, позволяющие сделать ряд заключений. Ниже точки слома со стебля льна легко снимается «чулок» из наружных тканей, среди которых преобладают клеточные стенки лубяных волокон. Предварительные исследования часто проводят именно на таких препаратах, хотя доказано, что обнаруженные компоненты содержатся именно в клетках волокон, а не в эпидермисе или паренхиме. Данные о более ранних стадиях развития льняного волокна основаны прежде всего на результатах микроскопии, в том числе с использованием антител на образование различных полисахаридов и других соединений.
236
6.9.1. Источники субстратов для формирования компонентов льняного волокна
Клеточная стенка — мощный потребитель фотосинтетических ассимилятов. Именно компоненты клеточной стенки, в первую очередь целлюлозу, которая в растительном организме практически никогда не расщепляется, можно рассматривать как конечный продукт фотосинтеза. Формирование растительных клеточных стенок относится к наиболее масштабным процессам в биосфере: их компоненты — самые распространенные на Земле органические вещества. Клеточная стенка — ключевая структура растительного организма, выполняющая многообразные функции; на ее формирование растение затрачивает огромные ресурсы. После секвенирования генома арабидопсиса было подсчитано, что около 15 % всех его генов задействовано в формировании и функционировании клеточной стенки. Энергетические расходы, которые необходимы для образования субстратов синтеза ее компонентов, их транспортировки по растению и внутри клетки, формирования сложного ферментативного комплекса, огромны, тем более при формировании столь мощного образования, как клеточная стенка льняного волокна.
Полисахариды клеточной стенки синтезируются из сахаров. Их источниками в растительной клетке являются три основных процесса: фотосинтез, глюконеогенез, приток ассимилятов из других органов. В формирование льняного волокна все эти процессы вносят вклад, но он различен на разных стадиях развития.
Клетки льняного лубяного волокна содержат собственные хлоропласты. На ранних стадиях развития волокна их структура напоминает проламеллярные тела и свидетельствует об отсутствии интенсивного фотосинтеза. В этот период волокно имеет плазмодесмы, и субстраты для его развития могут поступать по симпласту. В ходе интрузивного роста плазмодесмы нарушаются и соответственно уменьшается симпластический приток ассимилятов. На этой стадии в клетках волокон интенсифицируется фотосинтез собственных хлоропластов. Их число в клетке достигает нескольких десятков. Стопка гран содержит до 15 тилакоидов, строма прозрачная и плотная, присутствуют пластидные рибосомы и пластоглобулы. В период быстрого роста в хлоропластах утолщающихся волокон наблюдаются крупные крахмальные зерна, которые в фазе зеленой спелости иногда занимают весь объем хлоропласта. Судя по развитой структуре хлоропластов, они являются фотосинтезирующими и могут вносить вклад в обеспечение субстратами процессов удлинения и утолщения волокон. Количественно оценить интенсивность фотосинтеза волокон не удается из-за невозможности их выделения в неповрежденном виде.
237

Глюконеогенез — комплекс биохимических реакций, которые позволяют сформировать сахара из других веществ, например из аминокислот и липидов. Эти процессы могут функционировать в льняном волокне на протяжении всей его жизни.
Особенностью притока ассимилятов в льняное волокно является отсутствие в нем плазмодесм, которые нарушаются в ходе интрузивного роста, осуществляемого всей поверхностью клетки. На стадии координированного роста ассимиляты из других органов попадают в волокно и по симпласту, и по апопласту, а позднее — только по апопласту.
6.9.2. Метаболические пути образования компонентов льняного волокна
Полисахариды клеточной стенки образуются не из свободных моносахаридов, а из их активированных форм. Непосредственными субстратами в реакции образования полисахаридов клеточной стенки служат нуклеозиддифосфатсахара, главный из которых — уридиндифосфатглюкоза. Взаимопревращения моносахаридов также происходят на уровне нуклеозиддифосфатов (рис. 75).
Фенольные соединения клеточной стенки синтезируются в многоступенчатом процессе из фенилаланина, производными которого являются также многие другие вторичные соединения клетки. Мономеры лигнина — довольно токсичные нестабильные
Рис. 75. Метаболические пути образования предшественников синтеза полисахаридов клеточной стенки
238
соединения, которые не накапливаются в живых клетках в свободном состоянии. Гликозилирование фенольной гидроксильной группы стабилизирует их и делает нетоксичными. Именно глюкозиды (образуются с участием УДФГ) служат как транспортной, так и запасной формой монолигнолов. Механизм транспорта монолигнолов к клеточной стенке и регулирующие его факторы неизвестны. Считается, что полимеризация свободных монолигнолов в лигнин происходит по свободно-радикальному механизму и инициируется путем окисления монолигнолов с участием пероксидаз и (или) лакказ.
У льна наиболее лигнифицированной тканью является ксилема, где содержание лигнина в клеточной стенке составляет около 20 %. Лигнин, с одной стороны, придает растениям устойчивость к полеганию, с другой стороны, при отложении в лубяных волокнах приводит к снижению качества урожая — уменьшению гибкости технического волокна. Повышенная лигнификация волокна характерна для тех сортов, у которых в конце вегетации интенсивное старение стебля сочетается с активной работой ассимиляционного аппарата. Для предотвращения сильного одревеснения волокна важно ускорить старение листьев после зеленой спелости.
6.9.3. Роль различных органелл в образовании компонентов льняного волокна
Синтез различных полимеров клеточной стенки локализован в нескольких компартментах клетки. Ферменты синтеза целлюлозы и каллозы встроены в плазмалемму. Формирование остальных полисахаридов клеточной стенки происходит в аппарате Гольджи. Из-за сложности строения полисахаридов для их биосинтеза необходимо большое число ферментов. В отличие от синтеза белков и нуклеиновых кислот, происходящего на матрицах, синтез полисахаридов основан на специфичности участвующих ферментов. Только в наиболее распространенных полисахаридах растительной клеточной стенки присутствует несколько сотен различных гликозидных связей. Для создания каждой из них необходим свой фермент. Большинство из них, особенно те, которые синтезируют остов полисахаридных молекул, являются мембранно-связанными ферментами. При попытке очистки эти сложнейшие белковые молекулы теряют активность, что лишает исследователей инструмента отбора нужных фракций. В результате до сих пор не удалось выделить большинство ферментов, участвующих в образовании полисахаридов клеточной стенки, что резко тормозит развитие молекулярно-биологических подходов в изучении формирования растительных клеточных стенок.
239
Белки клеточных стенок синтезируются на рибосомах шероховатого эндоплазматического ретикулума, в котором может происходить их гликозилирование, если оно необходимо. Дальнейшая модификация углеводной части молекулы и транспорт за пределы плазмалеммы осуществляются аппаратом Гольджи.
В процессе роста и удлинения клеток центральную роль играет цитоскелет — микротрубочки и микрофиламенты, которые поддерживают форму клетки, определяют направление ее растяжения и ориентацию микрофибрилл целлюлозы в клеточной стенке. Методом иммуноокрашивания тубулина (белка, из которого состоят микротрубочки) показано, что при интрузивном росте льняных волокон микротрубочки имеют спиральную ориентацию в средней части волокна и поперечную в кончиках. Это может быть связано с различной скоростью роста волокна в этих зонах или с тем, что концы растут только в длину, а средняя часть — еще и в ширину. В точке слома происходит смена ориентации микротрубочек на продольную, что еще раз подтверждает значимость процессов, происходящих в этой части стебля.
После выплескивания содержимого пузырьков аппарата Гольджи за пределы плазмалеммы полисахариды встраиваются в клеточную стенку. Механизмы сборки этой надмолекулярной структуры практически неизвестны. Имеются отрывочные сведения, что этот процесс основан не только на спонтанном взаимодействии полисахаридов в специфическом микроокружении, но и на участии не охарактеризованных пока белков. Кроме того, известно, что для предотвращения спонтанного связывания полисахаридов внутри аппарата Гольджи некоторые из них синтезируются в несколько измененном виде: карбоксильные группы уроновых кислот метилируются, а некоторые нейтральные сахара подвергаются ацетилированию. Отщепление этих «довесков» происходит за пределами плазмалеммы. От степени метилирования уроновых кислот зависит их упаковка в клеточной стенке, а также связывание кальция, которое влияет на способность клетки к растяжению.
6.10. Основные виды льнопродукции
Лен-долгунец — одна из немногих технических культур, у которых вся надземная часть растения идет в переработку (рис. 76). За многовековую историю возделывания льна сложились специфические термины как для продуктов этой переработки, так и для ее стадий. В первую очередь очень ценны длинное волокно и масло, сфера применения которых становится все шире. Остановимся на процессах, происходящих при получении льняного волокна.
240
